p-ERK1/2、CD34、层粘连蛋白在乳腺癌组织中的表达及其意义
2016-06-18冯城婷袁高峰梁容瑞
冯城婷 王 莹 史 悦 袁高峰 李 伟 陶 敏 梁容瑞
215006 苏州大学附属第一医院(冯城婷,史 悦,李 伟,陶 敏,梁容瑞);215001 苏州市立医院(王 莹);223900 泗洪县人民医院(袁高峰)
·基础研究·
p-ERK1/2、CD34、层粘连蛋白在乳腺癌组织中的表达及其意义
冯城婷王莹史悦袁高峰李伟陶敏梁容瑞
215006 苏州大学附属第一医院(冯城婷,史悦,李伟,陶敏,梁容瑞);215001 苏州市立医院(王莹);223900 泗洪县人民医院(袁高峰)
【摘要】目的探讨p-ERK1/2、CD34、层粘连蛋白(LN)在乳腺癌中的表达及其意义。方法收集乳腺癌患者肿瘤组织蜡块76例,行免疫组化染色,检测乳腺癌患者癌组织标本中p-ERK1/2的表达水平,分析p-ERK1/2水平与其临床病理因素及CD34、LN的相关性。结果p-ERK1/2、CD34 、LN在乳腺癌组织中的表达水平与肿瘤TNM分期显著相关。CD34在乳腺癌组织中广泛表达,与p-ERK1/2水平正相关。LN在乳腺癌组织中表达与TNM分期及p-ERK1/2水平均呈负相关。结论ERK通路异常活化与乳腺癌生长和浸润有关,可能参与了乳腺癌的发展过程,ERK通路可能通过促进血管生成及降解基底膜发挥促进乳腺癌进展的作用。
【关键词】p-ERK1/2;CD34;层粘连蛋白;乳腺癌
(ThePracticalJournalofCancer,2016,31:697~700)
乳腺癌的浸润和转移是影响患者生存质量和生存时间的重要因素[1]。MAPK-ERK信号通路异常活化可导致细胞分化、凋亡功能的丧失,引起细胞恶性转化,异常增殖、肿瘤发生,侵袭能力增强、肿瘤转移等[2],但其在乳腺癌中的作用及机制目前仍未阐明。本文拟采用免疫组织化学方法(S-P法)检测p-ERK1/2、CD34与LN在乳腺癌组织中的表达及其变化特征,探讨p-ERK1/2、CD34与LN三者与乳腺癌的发生、发展和预后的相关性,为临床乳腺癌侵袭转移机制研究提供理论依据。
1材料与方法
1.1组织来源
选取2012年1月至2013年9月泗洪县人民医院普外科手术切除前未经过任何放化疗治疗的乳腺癌患者肿瘤组织蜡块76例,年龄30~82岁,中位年龄为37岁,均为浸润性导管癌,腋窝淋巴结转移42例,分组资料采用国际抗癌联盟分期(international union against cancer,UICC)标准进行分期,其中Ⅰ期6例,Ⅱ期49例,Ⅲ期21例。
1.2免疫组化染色法
采用SP法行p-ERK1/2、CD34及LN免疫组化染色。PBS代替一抗作为阴性对照,以己知阳性切片作为阳性对照。采用双盲法判断结果。p-ERK1/2染色判定:以抗体在细胞核出现棕黄色颗粒为阳性信号。每张切片均随机观察5个高倍视野(×400),阳性细胞数<5%为(-),5%~25%为(+),26%~50%为(++),>50%为(+++),以(+)~(+++)均视为阳性表达,(-)视为阴性表达。CD34染色判定:参考Takahashi等[3]微血管计量方法,在双盲法下进行计数。LN染色判定:LN阳性呈现为黄褐色或棕褐色颗粒,表达于上皮下基底膜。先在低倍(100倍)光学显微镜下观察整张切片,随机选择间质和癌巢中5个高倍视野(400倍)下观察染色情况。上皮下无阳性反应为(-),出现阳性反应带呈浅棕色不连续为(+),呈连续棕色细线为(++),呈连续深棕色粗线为(+++)。
1.3统计学分析
应用SPSS 20.0统计软件,采用Kolmogorov-Smirnov检验法作数据正态分布检验,进行卡方检验、t检验及秩和检验等分析。以P<0.05有统计学意义。
2结果
2.1p-ERK1/2、CD34、LN在乳腺癌组织中的表达情况
乳腺癌组织中p-ERK1/2阳性率为43.4%,所有标本中均检测到CD34阳性细胞,中位MVD为50.5个。LN中位阳性率为84.2%(60/76),其中LN(+)31例(40.8%),LN(++)20例(26.3%),LN(+++)13例(17.1%)。
2.2乳腺癌组织中p-ERK1/2的表达与其临床病理因素的关系
分析发现:p-ERK1/2表达水平与肿瘤长径呈显著正相关(P=0.000;γ=0.673),p-ERK1/2表达水平与HER-2、ER、PR表达状态等其它临床病理因素未见明显相关性(P>0.05)(表1),p-ERK1/2阳性率随TNM分期升高而升高(γ=0.586,P=0.040,表2)。
2.3乳腺癌组织中 LN表达与其临床病理因素的关系
LN(-~+)共33例,LN阳性(++与+++)共43例,阳性率为56.6%。分析结果显示:LN表达水平与肿瘤长径呈显著正相关(P=0.005;γ=0.342),LN表达水平与HER-2、ER、PR表达状态等其它临床病理因素未见明显相关(P>0.05,表3),LN表达水平随TNM分期升高而升高(γ=0.586,P=0.040,表4)。
2.4乳腺癌中p-ERK1/2与CD34表达的相关性
分析发现:p-ERK1/2表达与MVD水平呈正相关性(γ=0.284),p-ERK1/2阳性患者比阴性患者MVs细胞水平高,两组间有显著性差异(P=0.013,图1)。 p-ERK1/2阴性组MVs均数为(42.23±25.52)个,中位数为48个;p-ERK1/2阳性组MVs均数为个(62.36±23.22)个,中位数为58个。

表1 BC组织中p-ERK1/2表达与其临床病理因素的
注:◇为应用χ2检验;□为应用t检验,*表示有显著统计学意义。

表2 76例不同分期BC患者p-ERK1/2阳性率比较(例,%)
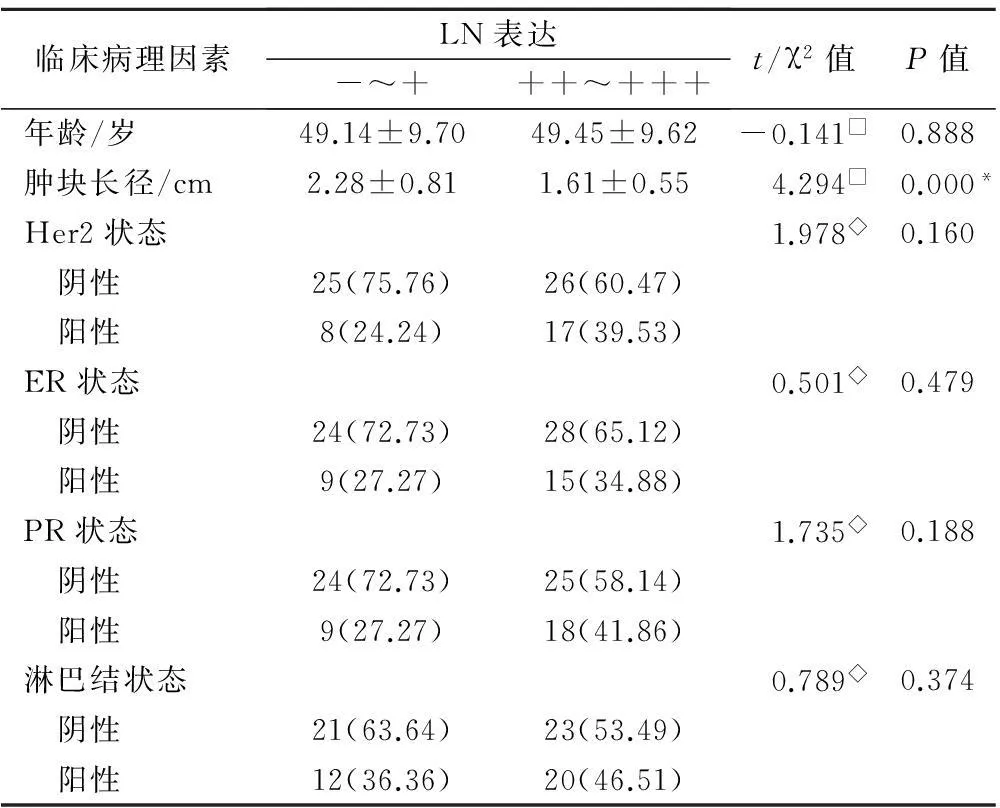
表3 BC患者中LN表达水平与其临床病理因素的
注:◇为应用χ2检验;□为应用t检验。*表示有显著统计学意义。
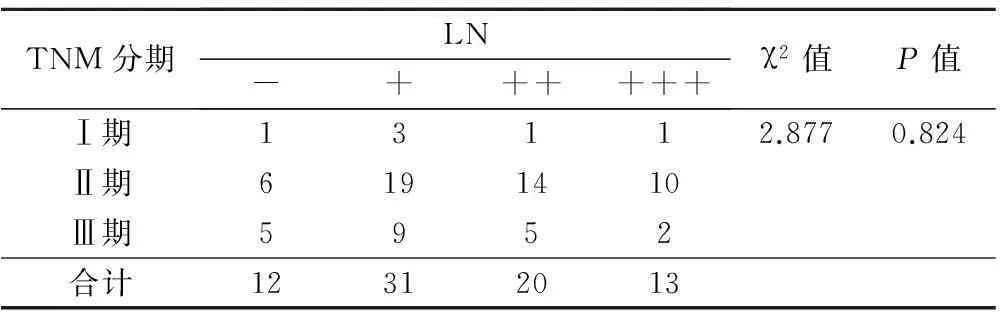
表4 乳腺癌中LN水平与TNM分期相关性分析/例
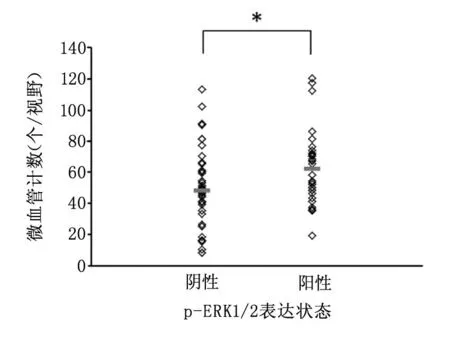
图1 不同p-ERK1/2水平乳腺癌标本中MVs数量情况
2.5乳腺癌中p-ERK1/2表达与LN水平的相关性
p-ERK1/2表达水平与LN水平呈负相关(γ=-0.378),p-ERK1/2阳性患者LN水平较阴性患者低,两组间存在显著差异(P=0.000),见表5。
3讨论
MAPK/ERK信号通路是介导细胞外刺激从而引起细胞内反应的重要信号转导系统,对于细胞的增殖、分化和凋亡等方面具有重要作用[4]。其中,细胞外信号调节蛋白激酶(extracellular signal regulated kinase,ERK)通路备受关注,也是迄今研究得较为透彻的重要 MAPK 信号转导通路,参与了对肿瘤发生发展及多药耐药等的调控[2]。ERK通路与乳腺癌的关系已越来越受到研究人员的关注,孟媛等[5]发现p-ERK过表达可能与乳腺癌的组织学分级有关。曾宪旭等[6]发现p-ERK表达水平在一定程度上提示了乳腺导管非典型增生向乳腺癌的转化潜能,并且ERK传导路径在乳腺癌癌变过程中具有重要作用。我们的研究发现,乳腺癌中p-ERK1/2水平还与肿瘤大小正相关,且其阳性率随TNM分期升高而升高,这同样支持ERK通路的活化可能促进了乳腺癌的发展。
乳腺癌的浸润和转移与微血管的生成密切相关。
新生血管为肿瘤组织的生长不断提供所需营养,促进了肿瘤的增长,同时微血管的增加,肿瘤细胞进入血液循环的可能性也增加,进而侵入靶器官开始增殖[7-8]。CD34抗原被认为是最敏感的内皮细胞,能直接反映微血管生成情况。甄乐峰等[9]研究发现,CD34在乳腺癌肿瘤大小、组织学分级和淋巴结转移及pTNM分期中的差异有统计学意义,表明原发肿瘤越大、组织学分级越高、淋巴结转移数目越多、pTNM分期越晚,乳腺癌中微血管的形成越多。我们的研究发现,p-ERK1/2阳性组病例中CD34水平显著高于p-ERK1/2阴性组,提示ERK活化程度高的乳腺癌中MVD水平也相应升高,这可能是ERK通路促进肿瘤生长的机制之一。
基膜是1种特化的细胞外基质,是肿瘤浸润过程中必须穿越的物理屏障。肿瘤细胞通过分泌基质降解酶类破坏基膜的组织结构,同时调节细胞外基质受体整合素的表达,为穿过基膜和在靶器官粘附、增殖创造有利条件[10]。LN作为基底膜的主要成分,一方面起着支撑和连接细胞、维持器官形态的机械性作用;另一方面可调节细胞的分化、增殖和功能,在多种生理和病理过程中发挥作用。Molino等[11]发现乳腺癌的浸润可能跟LN的破坏降解有关。本实验观察到LN 在乳腺癌组织中表达失去连续性,甚至有明显的断裂,提示肿瘤组织中出现了明显的基膜破坏,并且LN的表达水平还与肿块长径及TNM分期成正相关,表明肿瘤的进展与LN的破坏相关。
有研究发现,ERK通路的激活使肿瘤细胞分泌血管内皮生成因子(VEGF)[12],微血管生成增加,CD34的表达亦增加。Park等[13]研究发现乳腺癌细胞及肝细胞肝癌的细胞中ERK信号途径的活化能使MMP-1、3基因转录;Kim等[14]研究表明,ERK的激活可诱导SKBR3乳腺癌细胞株内MMP-9的分泌。MMP-9是MMPs家族中相对分子量最大的酶,主要功能是降解、破坏细胞外基质中最主要的组份Ⅳ、Ⅴ型胶原和明胶,从而可以降解基膜。本研究结果显示,乳腺癌中p-ERK1/2阳性患者比阴性患者CD34水平明显升高,提示ERK通路的活化可能促使肿瘤微血管的生成;与此同时,对比p-ERK1/2阳性组标本与p-ERK1/2阴性组标本,前者LN的表达强度明显低于后者,提示ERK通路的活化可能促进了肿瘤细胞对基膜的降解,从而致使肿瘤浸润进展。
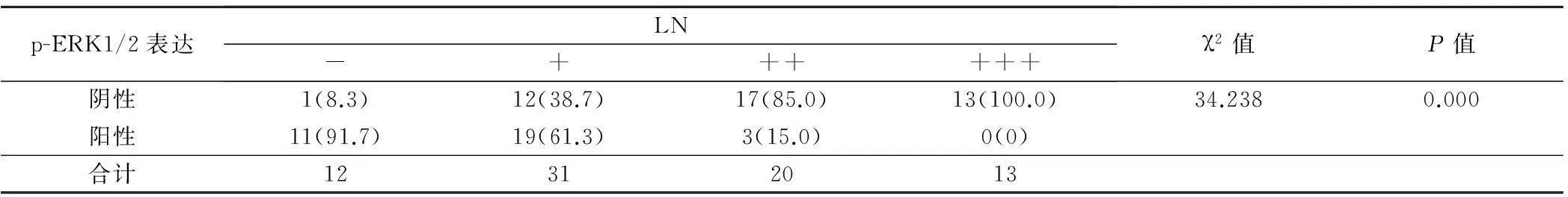
表5 乳腺癌中p-ERK1/2表达与LN水平相关性分析(例,%)
参考文献
[1]Scully OJ,Bay B-H,Yip G,et al.Breast Cancer Metastasis〔J〕.Cancer Genomics & Proteomics,2012,9(5):311-320.
[2]McCubrey JA,Steelman LS,Chappell WH,et al.Roles of the Raf/MEK/ERK pathway in cell growth,malignant transformation and drug resistance〔J〕.Biochim Biophys Acta,2007,1773(8):1263-1284.
[3]Takahashi Y,Cleary KR,Mai M,et al.Significance of vessel count and vascular endothelial growth factor and its receptor(KDR)in intestinal-type gastric cancer〔J〕.Clin Cancer Res,1996,2(10):1679-1684.
[4]Wada T,Penninger JM.Mitogen-activated protein kinases in apoptosis regulation〔J〕.Oncogene,2004,23(16):2838-2849.
[5]孟媛,董经宇,甄娟,等.SIAH2与P-ERK在乳腺癌中的表达及其临床意义〔J〕.中国组织化学与细胞化学杂志,2011,20(3):220-226.
[6]曾宪旭,关剑,韩艳春,等.p-Bad112/136、p-Akt、p-Erk在乳腺癌癌变过程中的表达及意义〔J〕.中国肿瘤临床,2006,33(13):738-742.
[7]Chi Y,Huang S,Peng H,et al.Critical role of CDK11(p-58)in human breast cancer growth and angiogenesis〔J〕.Bmc Cancer,2015,15:701.
[8]Rykala J,Przybylowska K,Majsterek I,et al.Angiogenesis Markers Quantification in Breast Cancer and Their Correlation with Clinicopathological Prognostic Variables〔J〕.Patho Oncol Res,2011,17(4):809-817.
[9]甄乐锋,叶长生,刘民锋,等.D2-40和CD34在乳腺浸润性导管癌中的表达及其意义〔J〕.南方医科大学学报,2010,30(7):1548-1551.
[10]Fernandez-Perianez R,Molina-Privado I,Rojo F,et al.Basement Membrane-Rich Organoids with Functional Human Blood Vessels Are Permissive Niches for Human Breast Cancer Metastasis〔J〕.Plos One,2013,8(8):e72957.
[11]Molino A,Pedersini R,Micciolo R,et al.Prognostic significance of laminin,laminin receptor,and bone marrow micrometastases in breast cancer patients:are these markers of aggressive behavior and metastatic potential〔J〕.Appl Immunohistochem Mol Morphol,2003,11(4):311-318.
[12]Lee CC,Chen SC,Tsai SC,et al.Hyperbaric oxygen induces VEGF expression through ERK,JNK and c-Jun/AP-1 activation in human umbilical vein endothelial cells〔J〕.J Biomed Sci,2006,13(1):143-156.
[13]Park CH,Lee MJ,Ahn J,et al.Heat shock-induced matrix metalloproteinase(MMP)-1 and MMP-3 are mediated through ERK and JNK activation and via an autocrine interleukin-6 loop〔J〕.J Invest Dermatol,2004,123(6):1012-1019.
[14]Kim S,Choi JH,Lim HI,et al.EGF-induced MMP-9 expression is mediated by the JAK3/ERK pathway,but not by the JAK3/STAT-3 pathway in a SKBR3 breast cancer cell line〔J〕.Cell Signal,2009,21(6):892-898.
(编辑:吴小红)
The Expression and Clinical Significance of p-ERK1/2,CD34,Laminin in Breast Cancer
FENGChengting,WANGYing,SHIYue,etal.
TheFirstAffiliatedHospitalofSoochowUniversity,Suzhou,215006
【Abstract】ObjectiveTo study the expression and clinical significance of p-ERK1/2,CD34 and laminin(LN)in breast cancer.Methods76 tumor tissue paraffin blocks were collected from patients with breast cancer,which were sliced into sections and immunohistochemically stained.Activated ERK expression levels were detected in cancer tissue specimens of breast cancer patients.The relationships among p-ERK1/2 level,clinical pathological factors,CD34 and LN were analyzed.ResultsThe expression of p-ERK1/2 、CD34 and LN in breast cancer tissues was significantly associated with the tumor TNM staging.CD34 was widely expressed in breast cancer tissues,which was positively associated with the p-ERK1/2 level.The expression of LN in breast cancer tissues was negatively associated with the TNM staging and the p-ERK1/2 level.ConclusionP-ERK1/2,which is associated with the development and invasion of breast cancer,may play an important role in promoting breast cancer progression by promoting the angiogenesis and the degradation of basement membranes.
【Key words】p-ERK1/2;CD34;Laminin;Breast cancer
基金项目:国家自然科学基金资助项目(81272542)
通讯作者:梁容瑞
DOI:10.3969/j.issn.1001-5930.2016.05.001
中图分类号:R737.9
文献标识码:A
文章编号:1001-5930(2016)05-0697-04
(收稿日期2015-07-09修回日期 2016-01-05)
