钛表面构建成骨细胞膜片的体外研究*
2016-06-17毛久凤周成菊
毛久凤, 夏 茜, 吴 镭, 杨 红, 周成菊, 方 艺, 董 强
(1.贵州医科大学, 贵州 贵阳 550004; 2.贵州医科大学附属口腔医院 口腔内科, 贵州 贵阳 550004; 3.贵阳市口腔医院, 贵州 贵阳 550004; 4.贵州医科大学 病理学教研室, 贵州 贵阳 550004; 5.贵州医科大学 口腔医学院 口腔修复学教研室, 贵州 贵阳 550004)
钛表面构建成骨细胞膜片的体外研究*
毛久凤1, 夏茜2, 吴镭1, 杨红3, 周成菊3, 方艺4, 董强5**
(1.贵州医科大学, 贵州 贵阳550004; 2.贵州医科大学附属口腔医院 口腔内科, 贵州 贵阳550004; 3.贵阳市口腔医院, 贵州 贵阳550004; 4.贵州医科大学 病理学教研室, 贵州 贵阳550004; 5.贵州医科大学 口腔医学院 口腔修复学教研室, 贵州 贵阳550004)
[摘要]目的: 研究成骨细胞膜片在钛表面的生长情况。方法: 将体外培养鉴定的的大鼠成骨细胞接种在纯钛表面,构建大鼠成骨细胞膜片,连续培养1、2、3周,分别于第1、2、3周末收集成骨细胞膜片,倒置显微镜下观察细胞膜片的组成,光镜测量各时间点细胞膜片的厚度。结果: 原代培养细胞符合成骨细胞形态学特征;第2、3周末细胞膜片厚度较第1周末细胞膜片厚度明显增加(P<0.05);与第3周末细胞膜片相比,第2周末细胞膜片厚度增加最明显,差异具有统计学意义(P<0.05)。结论: 钛表面构建的成骨细胞膜片拥有良好的增殖生长活性。
[关键词]成骨细胞; 钛; 组织工程; 细胞膜片
由于外伤、牙周疾病等因素导致的种植术区牙槽骨骨缺损,给缺牙区的种植修复带来了困难且修复失败率高。基于组织工程方法促进骨组织再生、恢复其结构与功能已引起人们广泛的关注。传统的组织工程方法利用细胞与支架的直接复合,出现细胞活性差、细胞利用率低等缺点。随着组织工程无支架细胞膜片技术(cell sheet technology,CST)的不断发展,利用细胞与细胞外基质聚合物再生组织的方法,一定程度上有效的解决了细胞流失的问题。该技术已成功应用于构建皮肤、角膜、牙周膜等多种组织[1-4]。钛作为可供选择的植入材料,与宿主骨之间具有良好的生物相容性,但其生物惰性使钛与宿主骨之间短时间内难以形成很好的骨整合,构建具有成骨活性的细胞膜片,对植体周围快速成骨、缩短骨愈合时间具有重要的临床指导意义[5]。目前尚未见有关钛表面构建细胞膜片的报道。本实验旨在钛表面构建大鼠成骨细胞膜片,从形态学、组织学观察不同时间段细胞膜片的厚度,初步评估其在钛表面的生物学变化。
1材料与方法
1.1主要试剂和仪器
DMEM高糖培养基及胰蛋白酶购自美国HyClone公司,胎牛血清购自浙江杭州四季青公司,Ⅰ型胶原酶购自美国Gibco公司,抗坏血酸购自美国Solarbio-Sigma-Ultra公司,超净工作台、恒温培养箱、离心机及倒置相差显微镜及照相系统购自美国Corning-Costar公司,钛片由陕西省西安泰金工业电化学技术有限公司生产,SD大鼠乳鼠购自贵州医科大学实验动物中心。
1.2方法
1.2.1大鼠成骨细胞的培养及鉴定新生24 h内SD大鼠乳鼠于无菌超净台内剥离颅骨,预冷的PBS液洗3次后,刮净骨膜结缔组织,剪碎骨片。加入胰蛋白酶(含0.25% EDTA)消化约15 min,弃消化液;0.1%Ⅰ型胶原酶2 mL,于37 ℃消化20 min,重复消化3次,收集消化液,1 000 r/min离心5 min,弃上清;沉淀制成细胞悬液,差数贴壁法纯化,用含有15 %胎牛血清的DMEM的高糖培养基培养,每2~3 d更换培养液1次。细胞融合单层铺满瓶底约80%~90%进行传代培养,传至3代。从形态学、碱性磷酸酶染色、茜苏红染色对细胞进行鉴定。
1.2.2钛片的准备准备厚约1 mm,直径3.5 cm的2级纯钛片,以不同粗糙度的金相砂纸打磨表面、抛光后呈镜面,丙酮超声清洗180 min,之后依次使用75 %酒精、去离子水清洗15 min,置于空气中自然干燥,实验前高压灭菌。
1.2.3构建大鼠成骨细胞膜片第3代成骨细胞以2×106个/孔的细胞密度接种于6孔细胞培养板内钛表面,用DMEM高糖培养基(含15%胎牛血清、50 mg/L抗坏血酸及100 U/mL青霉素-链霉素)连续培养3周,培养基每2 d更换1次。
1.3观察指标
分别于细胞膜片培养的第1、2、3周末时,用细胞刮将其小心的分离钛表面,置于PBS里倒置相差显微镜下观察;然后置于4 %的多聚甲醛中固定、脱水、石蜡包埋、连续切片,进行HE染色,光镜下观察细胞膜片的形态及组成。用Image-Pro Plus图像分析软件(200倍视野,图像尺寸1 280×1 024)采集各时间点细胞膜片的组织学切片图像,同样像素和视野下设置标尺,随机选取5个点,根据标尺测量其厚度并取平均值,此值为膜片的厚度。
1.4统计学分析
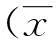
2结果
2.1大鼠成骨细胞形态
原代培养的细胞呈圆形类圆形,5 h后有部分细胞贴壁,贴壁细胞呈梭形、星形。第7~8天时后有细胞集落生长,融合成片,细胞铺满瓶底即可传代。碱性磷酸酶染色检测阳性,符合成骨细胞的生物学特性。连续培养21 d,茜苏红染色出现钙结节。见图1。
2.2大鼠成骨细胞膜片
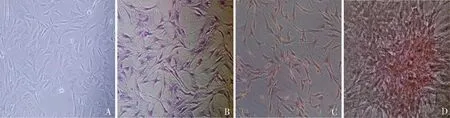
细胞膜片培养第1、2及3周末均可观察到钛表面形成薄层乳白色膜状物,利用细胞刮可将成骨细胞膜片从钛表面分离(图2A),膜片有一定韧性,可收缩成团,具有一定的操作性。将膜片置于倒置显微镜下观察膜片层由细胞和细胞外基质形成,细胞间连接紧密(图2B)。
2.3成骨细胞膜片厚度
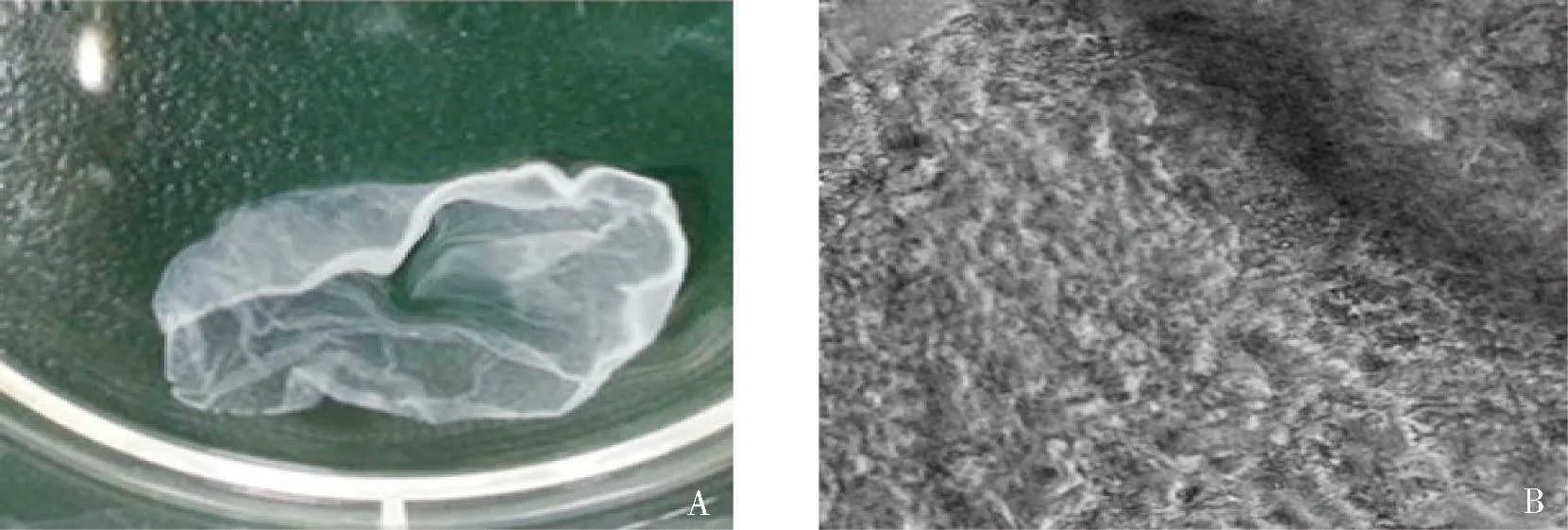
细胞膜片厚度测量结果(如图3),第1周末(13.336 1±0.455 51)μm,第2周末(27.759 5±0.444 88)μm,第3周末(34.768 2±0.399 78)μm,第2周末和第3周末的膜片厚度逐渐增加,差异具有统计学意义(P<0.05)。提示通过在纯钛表面高密度接种的成骨细胞,用含有抗坏血酸的培养基连续培养,可形成膜片层结构,且随时间的增加膜片厚度增加,其中第2周膜片厚度增加最明显。
注:A为原代成骨细胞,B为HE染色,C为碱性磷酸酶染色,D为茜苏红染色图1 大鼠成骨细胞形态(100×)Fig.1 Morphological characteristics of osteoblasts of rats
注:A为大体观,B为镜下观图2 大鼠成骨细胞膜片(100×)Fig.2 Osteoblast cell sheets of rats
注: A(200×)和B(400×)为培养第1周末膜片,C(200×)和D(400×)为培养第2周末膜片,E(200×)和F(400×)为培养第3周末膜片图3 培养不同时间的成骨细胞膜片(HE)Fig.3 Osteoblast cell sheet cultured in different time
3讨论
相较于传统的组织工程方法,CST作为一种新型的组织再生技术,具有细胞利用率高、无组织排斥反应等优点,细胞膜片结构保留了一些重要的细胞表面蛋白如细胞生长因子受体、细胞-细胞连接蛋白等可通过温度反应培养皿法、物理刮取法等方法获得完整的膜片结构,由于膜片结构保留了细胞与细胞、细胞与细胞外基质间连接,它可同一时间将大量细胞移植到受体区,移植细胞活性和生理功能及结构的完整性受到保护[6]。本研究采用CST的方法,利用成骨细胞在钛表面构建了大鼠成骨细胞膜片,研究发现,利用抗坏血酸成骨诱导后的成骨细胞在钛表面培养5~7 d,即能形成薄层膜状物,膜片内细胞随机排列并重叠生长,细胞间充满细胞外基质(extracellular matrix,ECM),膜片结构能很好的黏附于钛表面,并且可以在钛表面维持至少2~3周。钛材料与周围环境的整合过程需要细胞的粘附、增殖、分化等行为。成骨细胞增殖、分化的前提是细胞的黏附。不同于其它金属,金属钛表面可以对一些大分子物质的吸附来调节细胞的生物学行为。有研究提示采用ECM蛋白处理的钛表面促进了成骨细胞的增殖、分化[7]。ECM蛋白的存在影响细胞的黏附能力,钛表面大量细胞与细胞外基质间的反应对调节细胞内信号通路、细胞的黏附、增殖很重要[8-10]。本实验前期已对体外构建的成骨细胞膜片有一定研究,其主要成分是细胞及细胞自分泌的细胞外基质蛋白,现对成骨细胞膜片在钛表面的生物学变化评估提示,丰富的ECM蛋白可以增强膜片结构在钛表面的黏附能力,ECM作为细胞自身的细胞外支架有利于维持细胞的稳定、促进细胞间的连接,便于细胞间信息的沟通。细胞膜片通过ECM的黏附与周围环境相互作用影响细胞的功能。本实验通过测量钛片上细胞膜片的厚度结果显示,借助细胞刮将膜片与钛表面分离,组织学对其厚度分析,诱导过程中随着时间的延长,膜片厚度增加,其中第2周末和第3周末较第1周末厚度明显增加,提示通过在纯钛表面高密度接种的成骨细胞,用含有抗坏血酸的培养基连续培养,可形成膜片层结构,且随时间的增加膜片厚度增加;与第3周末比较,第2周末膜片厚度增加最明显,细胞膜片在钛表面培养2周,增殖能力降低,有可能膜片内细胞开始进入分化阶段。提示在钛表面构建的成骨细胞膜片能很好的与钛表面形成接触,并且在表面生长增殖,这可能与细胞的发育需要生长因子和细胞因子等细胞信号分子的激发完成,而这些信号分子能够募集细胞,诱导细胞的增殖、分化[11]。综上,本研究应用细胞和细胞外基质膜片技术在钛表面构建的由多层细胞聚集形成的细胞膜片模拟了体内骨基质的形成过程。在钛表面,成骨细胞膜片仍然存在细胞增殖活性。
4参考文献
[1] Cerqueira MT, Pirraco RP, Martins AR, et al. Cell sheet technology-driven re-epithelialization and neovas-cularization of skin wounds.Acta Biomater, 2014(10):3145-3155.
[2] Hitani K, Yokoo S, Honda N, et al. Transplantation of a sheet of human corneal endothelial cell in a rabbit Model. Mol Vis, 2008(14):1-9.
[3] Roge′ rio PP, Haruko O, Takanori I,et al.Development of osteogenic cell sheets for bone tissue engineering applications.Tissue engineering: Part A, 2011(11):1507-1515.
[4] Prgeeth Pandula PKC,Samaranayake LP,Jin LJ,et al. Human umbilical vein endothelial cells synergize osteo/odontogenic differentiation of periodontal ligament stem cells in 3D cell sheets. J Periodont Res, 2014(49):299-306.
[5] Zhao Y,Wong SM,Wong HM,et al.Effects of carbon and nitrogen plasma immersion ion implantation on in vitro and in vivo biocompatibility and titanium alloy. ACS Appl Mater Interfaces, 2013(4):1510-1516.
[6] 周成菊,周建奖,杨红,等.抗坏血酸对大鼠成骨细胞膜片BMP-2mRNA表达的影响. 实用口腔医学杂志, 2015(3):305-308.
[7] Noriko H,Teruhito Y,Shunsuke U,et al.High-performance scaffolds on titanium surfaces:osteoblast differentiation and minerlization promoted by a globular fibrinogen layer through cell-autonomous BMP signaling.Material Science and Engineering, 2015(46):86-96.
[8] Huang CF,Hsi-Jen Chiang,Hao-JanLin,et al.Comparison of cell response and surface characteristics on titanium implant with SLA and SLAffinity.Functionalization JES, 2014(3):15-20.
[9] Geiger B, Spatz JP, Bershadsky AD. Environmental sensing through focal adhesions. Nat Rev Mol Cell Biol, 2009(10):21-33.
[10]Haiyong A,Youtao X,Honglue T,et al .Improved hMSC functions on titanium coatings by type I collagen immobilization. J Biomed Mater Res Part A, 2014(102A):204-214.
[11]Verrier S,Meury TR,Kupcsik L, et al.Platelet-released supernatant induces osteoblastic differentiation of human mesenchymal stem cells: Potential role of BMP-2.Eur Cell Mater, 2010(20):403-414.
(2016-01-06收稿,2016-03-18修回)
中文编辑: 戚璐; 英文编辑: 刘华
Studyinvitroof Osteoblast Cell Sheet on Titanium Surface
MAO Jiufeng1, XIA Qian2, WU Lei1, YANG Hong3, ZHOU Chengju3, FANG Yi4, DONG Qiang5
(1.GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 2.DepartmentofOralMedicine,theAffiliatedStomatologicalHospitalofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 3.GuiyangStomatologicalHospital,Guiyang550004,Guizhou,China; 4.DepartmentofPathology,GuizhouMedicalUniversity,Guiyang550004,Guizhou,China; 5.DepartmentofProsthodontics,StomatologicalCollegeofGuizhouMedicalUniversity,Guiyang550004,Guizhou,China)
[Abstract]Objective: To investigate the growth activity of osteoblast cell sheet on the titanium surface. Methods: Rats' osteoblasts were cultured in vitro and identified. Then osteoblast cell sheets were vaccinated on the titanium surfaces and cultured for 1 week, 2 weeks and 3 weeks. At different designated time points the cell-sheets were collected with a cell scraper and its structure and composition were examined under the inverted microscope, and the thickness of the cell sheet was measured by light microscope. Results: The cells on cell sheet were consistent with the morphological characteristics of osteoblasts, suggesting the cell sheets were successfully constructed on the titanium surface. The results showed that the thickness of the cell sheet significantly increased at 2ndweek and 3rdweek after culture compared with at the 1stweek(P<0.05). The thickness of the cell sheet increased more significantly at the 2ndweek compared with at the 3rdweek (P<0.05). Conclusion: The osteoblast cell sheets on the titanium surface have a good proliferation activity.
[Key words]osteoblast; titanium; tissue engineering; cell sheet
*[基金项目]贵州省科技厅省校合作协议项目[黔科合LH字(2014)7115号]; 贵阳市科技计划项目[筑科合同(20141001)39号]
[中图分类号]R318.021
[文献标识码]A
[文章编号]1000-2707(2016)05-0535-04
DOI:10.19367/j.cnki.1000-2707.2016.05.010
**通信作者 E-mail:dongq666@163.com
网络出版时间:2016-05-13网络出版地址:http://www.cnki.net/kcms/detail/52.5012.R.20160513.2030.016.html
