转Cry30Fa1基因抗褐飞虱水稻的获得及鉴定
2016-06-16王海鹏黄晓西梁越洋朱军张翠霞王秀梅贡常委郑爱萍邓其明李双成王玲霞李平王世全
王海鹏 黄晓西 梁越洋 朱军 张翠霞 王秀梅 贡常委 郑爱萍 邓其明 李双成 王玲霞 李平 王世全
(四川农业大学 水稻研究所, 四川 温江 611130;*通讯联系人, E-mail: sqwangscau@163.com)
转Cry30Fa1基因抗褐飞虱水稻的获得及鉴定
王海鹏黄晓西梁越洋朱军张翠霞王秀梅贡常委郑爱萍邓其明李双成王玲霞李平王世全*
(四川农业大学 水稻研究所, 四川 温江 611130;*通讯联系人, E-mail: sqwangscau@163.com)
王海鹏, 黄晓西, 梁越洋, 等. 转Cry30Fa1基因抗褐飞虱水稻的获得及鉴定. 中国水稻科学, 2016, 30(3): 256-264.
摘要:将编码高效杀褐飞虱蛋白的苏云金芽胞杆菌基因Cry30Fa1密码子改造后,通过农杆菌介导法转入蜀恢818(R818),并最终获得46个转基因植株。通过定量PCR及Western Blot鉴定了Cry30Fa1在转录水平和蛋白水平的表达,并通过分子检测固定稳定表达的抗性基因,并结合传统育种系谱法选择具有优良农艺性状株系。对选育的株系在室内和大田环境下进行了抗虫性鉴定,选育的R818-Cry30Fal株系抗性明显优于亲本材料并达到抗的水平;在单株抗虫试验中,观察到了转基因株系对褐飞虱具有致死作用。说明转入Cry30Fa1基因使水稻产生了对褐飞虱抗性。培育出了具有抗褐飞虱蛋白的新型恢复系R818-Cry30Fal,为三系杂交育种提供了新的抗性材料并丰富了抗褐飞虱水稻种质资源。
关键词:褐飞虱; 农杆菌介导法; 抗虫性; Cry30Fa1
水稻是世界三大主要粮食作物之一,其产量和质量对保障人类生活至关重要[1-2]。不过水稻也是虫害最多的粮食作物之一。以稻飞虱吸取汁液的刺吸式口器的害虫不仅直接为害,同时还传播病毒病, 严重影响水稻的产量及品质。传统的防治方法主要是使用各种农药来杀灭害虫,不但提高了生产成本,增加了环境污染,破坏了生态平衡,而且褐飞虱易产生抗药性,因而培育自身能够抗虫的水稻品种是防治害虫最经济、有效的方法[3]。目前主流的培育抗虫水稻品种方式是利用水稻本身的抗性基因通过分子标记育种等手段培育抗虫的水稻,但培育周期相对较长,并且随着抗性品种种植年限的增加,其对褐飞虱抗性水平逐渐下降,即褐飞虱群体克服了含抗性基因水稻品种的抗性[4]。同时,由于受到种质资源的限制,传统抗虫育种愈发困难。
随着分子生物学、基因工程、转基因技术的发展,遗传转化开始成为作物育种的一种有效途径[5]。利用基因工程手段将外源抗虫基因通过农杆菌介导法导入水稻,使水稻自身产生抗虫蛋白从而达到防治害虫的目的。应用于水稻抗虫性改良的外源基因最多的是来自苏云金芽孢杆菌(Bacillusthuringinensis,Bt)的杀虫基因,比如被导入水稻的Bt抗螟虫基因有Cry2A[6]、Cry1A(b)[7]、Cry1C*[8]等。还有一些非Bt基因被成功导入水稻中,通过转雪花莲凝集素(Galanthusnivalisagglutinin,GNA)[9-10]和半夏凝集素基因(PTA)[11]等外源凝集素基因实现获取抗褐飞虱的转基因材料,但这些非Bt基因在水稻中可能会分泌出一种对人有低毒的蛋白[12]。Bt基因对应分泌的蛋白只对一种或少数的昆虫产生毒害作用且不对人畜产生毒害作用,所以Bt基因将会有极大的应用价值。Bt基因的杀虫范围很广包括很多鳞、鞘、双翅目及螨、线虫等害虫,同时对抗半翅目基因的研究也有进展,比如Cry30GA1[13]、Cry54Ab1[14]、Cry54Aa1及Cry30Fa1[15]等Bt基因。
本研究采用农杆菌介导法将Cry30Fa1密码子优化后的基因导入恢复系蜀恢818,通过分子手段筛选出具有Cry30Fa1的转基因株系,通过后代自交分离筛选获得农艺性状好且去除标记基因的纯系,并进行实时荧光定量PCR检测在转录水平上的表达量及对转基因材料进行Western Blot相对定量检测,同时选择纯系转基因材料进行苗期及抽穗期大田抗虫鉴定。通过分子育种与传统育种相结合的方式,以期最终获得安全的无选择标记基因抗褐飞虱水稻株系。
1材料与方法
1.1材料
1.1.1供试水稻品种及褐飞虱
转基因受体亲本为本实验室培育的三系恢复系:蜀恢818(即R818);褐飞虱为本实验室室内培养多代的稻褐飞虱。
1.1.2Bt基因及密码子优化改造
Cry30Fa1基因采用本实验室从海螺沟采集的
Bt菌BtMc28分离克隆[15],参照周宗梁等[16]Bt基因的改造方法,将Cry30Fa1按照水稻密码子偏好性进行改造。修改后的基因序列见辅助性表S1(http://www.ricesci.cn/CN/articl/showSupportInfo.do?id=2597)。
1.1.3根癌农杆菌及转基因载体
转基因过程中使用根癌农杆菌(A.tumefaciens),菌株为LBA4404。同时使用的表达载体为pCDMAR-Cry30Fa1-Hyg(图1)。
1.2方法
1.2.1农杆菌介导法转化转基因植株
参考李双成等[17]的农杆菌介导法,获得转基因株系。
1.2.2转基因植株的检测
分别取转基因植株分蘖盛期叶片3~5 cm,然后放入标记的试管中,加入5 mL浓度为40 mg/L潮霉素检测溶液,同时取转基因植株叶片作对照,每天观察叶片情况,5 d后记录实验结果。
采用CTAB法提取水稻叶片组织总DNA。根据Cry30Fa1基因编码序列分别设计PCR引物,上下游引物序列分别为F21(5′-CGGAGATGACTGGGCAAAGGC-3′)和F22(5′-CTGGCAGGGGAAGACAAGAAG-3′ ),扩增产物为957 bp。根据潮霉素抗性基因序列设计扩增引物,分别为Hyg F(5′-GGCGTAATAGCGAAGAGGC-3′)和Hyg R(5′-AATGTGTGAGTAGTTCCCAGA-3′),扩增产物为568 bp。
1.2.3标记基因去除及高代纯系的选择
通过对T1、T2代分离株进行鉴定,采取PCR检测手段和浸泡潮霉素两种方法相结合选取含有目的基因且不含标记基因Hyg的阳性株,连续自交授粉收种,直至收获目的基因连续两代不分离转基因种子为止。

图1载体pCDMAR-Cry30Fa1-Hyg的骨架
Fig.1. Skeleton of vector pCDMAR-Cry30Fa1-Hyg.
1.2.4转基因材料主要农艺性状分析
在转基因水稻株系后代选择不仅需要选择去除选择标记基因的株系,而且需要选择农艺性状较好的材料。 选择转基因株系103、129、131和亲本蜀恢818进行抽穗期、株高、分蘖数、穗长、结实率、千粒重等农艺性状分析。具体方法如下:抽穗期,当小区主穗有50%的材料抽出5 cm时记为抽穗期;株高,从水稻地面直到最高穗顶的高度;分蘖数,对灌浆后有超过5颗种子分蘖进行统计;主穗长,统计每颗水稻主穗穗尖至穗颈的长度;结实率,统计主穗的有效结实率;千粒重,统计主穗千粒重。
1.2.5转录水平及蛋白表达量检测
对T6代连续稳定遗传的转基因水稻叶片提取RNA,反转录合成cDNA,稀释10倍,密封后放置在-80℃超低温冰箱保存备用。同时,根据Cry30Fa1基因编码序列分别设计荧光定量PCR引物,上下游引物分别为30Fa1Q1-F(5′-TCCGTATGCGTTATGCC-3′)和30Fa1Q1-R(5′-GATGAAGGTTGTCCCGATT-3′),扩增产物为89 bp。内参使用水稻通用的Ubi,上下游引物分别为Ubi-F(5′-GCCCAAGAAGAAGATCAAGAAC-3′)和Ubi-R(5′-AGATAACAACGGAAGCATAAAAGTC-3′)。
选取相应转基因株系抽穗期的剑叶提取DNA,通过对Cry30Fa1基因的调取、亚克隆及表达载体构建、原核体系蛋白表达制备抗原、采用Western Blot检测及最后使用Thermo Scientific NanoDrop 2000通过测量目标蛋白和内参蛋白的灰度值对目标蛋白进行相对定量分析。
1.2.6抗虫性鉴定
采用目前普遍使用标准苗期集团筛选法 (the standard seedbox screening technique, 简称SSST)[18]并加以改进,同时为了更加全面客观地了解转基因材料苗期的抗虫性,增加了苗期单株试管抗虫鉴定。试验中水稻材料苗期和大田抗虫性均参考刘光杰等[19]的评价标准进行,选择阴性对照为高感褐飞虱TN1和亲本材料为蜀恢818,阳性对照含Bph14、Bph15基因的抗褐飞虱株系985,处理为转Cry30Fa1材料分别为103、129、131。当实验中TN1死苗率达到95%左右时,统计其他材料死苗率或者褐飞虱死亡率。
苗期单株试管抗虫鉴定为了易于观察和记录数据,采用试管固体培养基在人工培养箱内培养水稻及养虫。具体方法如下:每个株系为1个处理,每个处理1株苗,15个重复,待2~3叶时接20只2~3龄稻褐飞虱,记录褐飞虱的存活情况。为了全面评价转基因材料的抗虫性,增加了集团苗期鉴定法。具体方法如下:1个株系为1个处理,3个重复,每个重复20株材料左右,待2~3叶期时接入2~3龄褐飞虱。
为了进一步探究转基因水稻抗虫性,同时采用了田间抗虫性鉴定法。均以以上材料作为处理材料,在四川农业大学水稻研究所海南南繁基地按照每个材料40株,3次重复,采用完全随机的方法排列,用孔径100目的细网盖住,田间正常管理但不施农药,待水稻长到抽穗期,用人工方法在每个小区中心位置均匀放入带有大量褐飞虱稻桩每天观察,从第6天开始每天统计各个材料死亡情况,直到TN1死苗率为95%左右时,统计其他材料最终存活单株数,计算各材料水稻死亡率。以全株枯萎且失绿作为水稻死亡标准。
1.2.7统计分析
数据处理使用Excel 2010;数据统计分析采用SPSS 19.0,使用单因素方差分析(One-way ANOVA)检验各处理之间的差异;制图处理使用Origin 9.0完成。
2结果与分析
2.1转基因植株的获得
经过胚性愈伤组织的诱导及继代、农杆菌介导的遗传转化、转基因植株再生等阶段,成功获得水稻T0代转化植株233株,如图2所示。
2.2转基因抗性植株T0代的检测
2.2.1转基因抗性植株T0代的抗潮霉素基因检测
取转基因T0代植株和阴性对照蜀恢818的离体叶片在潮霉素溶液中放置5 d后观察,结果发现233株转基因T0代植株的离体叶片中有80株一直保持绿色,其余植株的叶片与阴性对照相同,逐渐褪绿,最后完全枯黄。浸泡潮霉素结果与PCR潮霉素基因检测结果保持一致(图3)。浸泡潮霉素结果与PCR潮霉素基因检测结果保持一致(图4)。
2.2.2转基因再生植株T0代的目的基因检测

A-成熟胚的诱导; B-愈伤组织的继代; C-抗性愈伤的筛选; D-抗性愈伤的分化; E-抗性植株的生根。
A, Induction of seed; B, Subculture of callus; C, Screening of resistant callus; D, Regeneration of resistance callus; E, Rooting of resistance callus.
图2转基因转化的整个过程
Fig. 2. Procedure of transformation of rice.

1-阴性对照; 2,3-未转进潮霉素基因的植株; 4-阳性对照; 5~7-转入潮霉素基因的植株。
1, Leaves of non-transgenic rice; 2,3, Leaves of non-Hygtransgenic rice; 4, Positive control; 5,6,7, Leaves ofHygtransgenic rice.
图3再生植株潮霉素T0代抗性检测
Fig. 3. Response of leaves from transgenic plants T0to hygromycin solution.
对鉴定出含潮霉素基因的80个株系进行Cry30Fa1基因特异片段的PCR扩增,结果显示,有46株为阳性,共转化率为19.7%。蜀恢818转Cry30Fa1基因阳性植株PCR扩增得到片段大小为957 bp,与阳性对照相同(图5)。
2.3标记基因的去除及纯系的选择
经T0代收种,连续多代对各株系PCR检测目的基因Cry30Fa1及潮霉素基因,最后在T6代150个小区中选择出31个株系为连续两代不分离的株系,其中带有标记基因株系有15个,没有标记基因的阳性株系16个。余下119个小区在转基因水稻出现连续两代中存在基因分离甚至全部丢失的现象。
2.4纯系株系农艺性状分析
对T6代材料中表现稳定的材料103、129、131和亲本蜀恢818进行农艺性状分析。由表1可知,有效分蘖数、结实率、千粒重这三个农艺性状中转基因材料和亲本之间没有明显差异,但从结实率上看转基因材料均比亲本高,材料103、129有效分蘖数和千粒重上也优于亲本蜀恢818;同时在株高和主穗长上两个转基因材料与亲本存在显著差异。综上可见,转基因材料经过人工对农艺性状的选择后,仍然可以选育出和亲本农艺性状相似甚至在某些农艺性状上优于亲本的转基因材料。
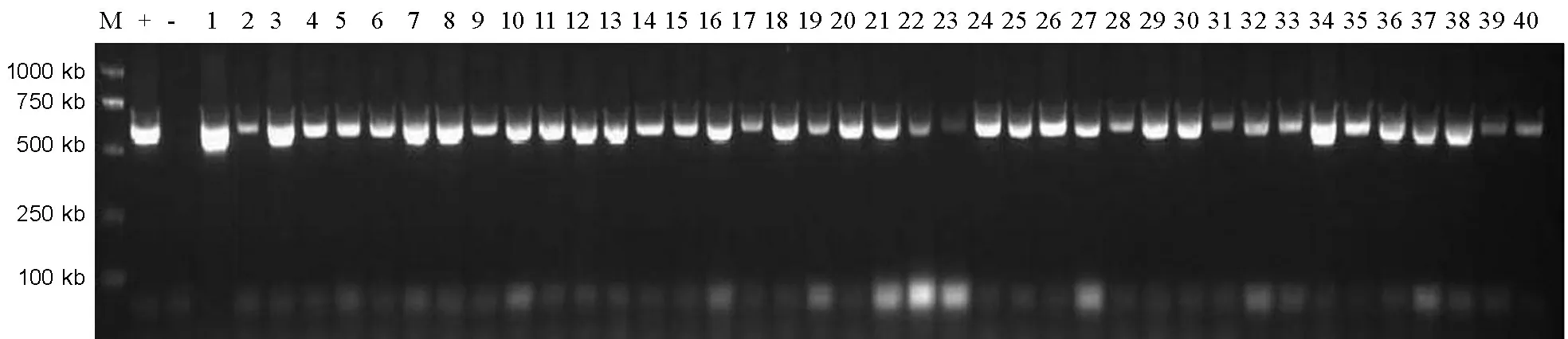
M-DNA 标记,“+”表示以质粒pCDMAR-Cry30Fa1作为阳性对照,“-”表示以未进行转化的蜀恢818作为阴性对照;1-40为转入Hyg的T0代植株。
M, DNA marker; “+”, Plasmid ofpCDMAR-Cry30Fa1; “-”, Non-transgenic Shuhui 818; 1-40, T0transformants carringHyg.
图4T0转化植株Hyg基因的PCR检测
Fig. 4. Confirmation of Hyg gene in T0generation by PCR.

M-DNA 标记;“+”-质粒pCDMAR-Cry30Fa1作为阳性对照,“-”-未进行转化的蜀恢818作为阴性对照;1~40-转入Cry30Fa1的T0代植株。
M, DNA marker; +, Plasmid ofpCDMAR-Cry30Fa1; -, Non-transgenic Shuhui 818; 1-40, T0transformants carringCry30Fa1.
图5T0转化植株Cry30Fa1基因的PCR检测
Fig. 5. Confirmation of Cry30Fa1 gene in T0plants by PCR.
2.5Bt基因转录水平
取T6代中表现稳定的株系103、129、131和亲本蜀恢818灌浆期叶片进行实时定量PCR检测(图6),结果显示Cry30Fa1基因在亲本蜀恢818中没有表达,在3份转基因材料上均有表达,但是各株系两两之间表达量均存在极显著差异,其中株系129表达量最小。
2.6Bt蛋白相对表达量
采用Western Blot检测3份稳定材料灌浆期叶片里Bt蛋白的相对表达量(图7),结果显示103、129、131这3份转基因材料中均有Bt蛋白表达。
表1转基因材料的主要农艺性状(平均值±标准差,n=3)
Table 1. Major agronomic traits of transgenic materials(mean±SD,n=3).
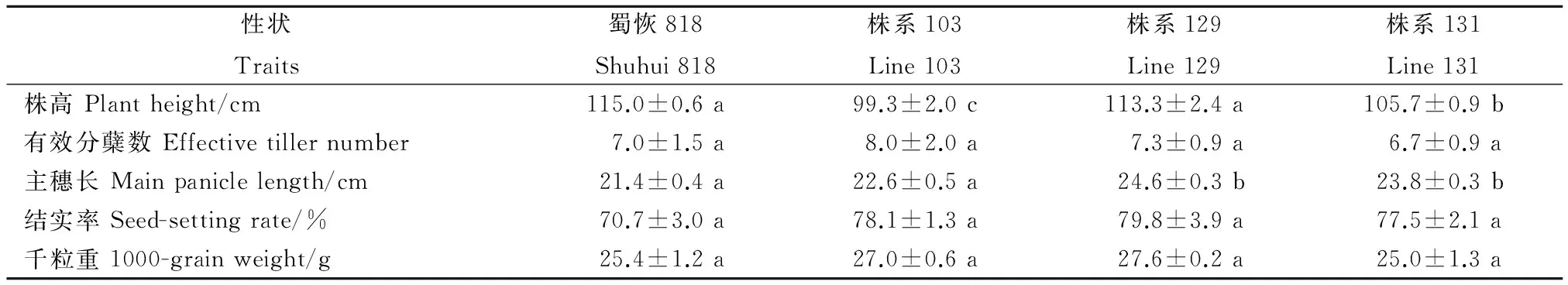
性状Traits蜀恢818Shuhui818株系103Line103株系129Line129株系131Line131株高Plantheight/cm115.0±0.6a99.3±2.0c113.3±2.4a105.7±0.9b有效分蘖数Effectivetillernumber7.0±1.5a8.0±2.0a7.3±0.9a6.7±0.9a主穗长Mainpaniclelength/cm21.4±0.4a22.6±0.5a24.6±0.3b23.8±0.3b结实率Seed-settingrate/%70.7±3.0a78.1±1.3a79.8±3.9a77.5±2.1a千粒重1000-grainweight/g25.4±1.2a27.0±0.6a27.6±0.2a25.0±1.3a
同一行数据后带相同字母者表示品种间差异未达显著水平(P>0.05)。
Within a row, data followed by the same letters show no significant difference(P>0.05).

**在0.01水平差异显著。
**,Significant difference at 0.01 level.
图6Cry30Fa1在灌浆期叶片中的表达情况
Fig. 6. Expression level of Cry30Fa1 in leaf at the filling stage.
株系103与129的相对表达量之间存在极显著差异,株系129灌浆期叶片组织里蛋白相对表达量较株系103、131低。
2.7抗虫鉴定结果
当感稻褐飞虱材料TN1死苗率达到95%左右时,统计其他处理材料死苗率(图8,表2)。结果发现集团抗虫鉴定中亲本蜀恢818死苗率均高于其他处理材料且存在显著性差异, 3份转基因材料与抗稻褐飞虱材料985无显著性差异,但这4份材料抗性级别均高达7级,属于中感材料(MS)。在单株抗虫鉴定时,结果表明3份转基因材料稻褐飞虱死亡率比亲本蜀恢818高且呈现显著性差异。对比两个抗虫鉴定方法可以看出,抗稻褐飞虱材料985在集团苗期抗性上和转基因材料抗性差异不明显,同时在单株鉴定时抗稻褐飞虱材料985试管中褐飞虱死亡率低于3份转基因材料且无显著性差异。转基因材料可能是由于表达了具有杀虫性的Bt蛋白,造成转基因材料的稻褐飞虱死亡率均显著高于亲本R818。
当大田感褐飞虱材料TN1死亡率在95%左右时统计发现(图8,表2),抗褐飞虱株系985水稻死亡率为0%,抗性级别为0级,属于免疫材料(Ⅰ);亲本蜀恢818水稻死亡率为64.17%,抗性级别为7级,属于中感材料;材料131水稻死亡率16.67%,株系103水稻死亡率29.17%,抗性级别都为3级,属于抗材料(R);129水稻死亡率为35.5%,抗性级别为5级,属于中抗材料,同时3份转基因材料与亲本蜀恢818在水稻存活率上存在显著差异,且抗性水平明显优于亲本蜀恢818。
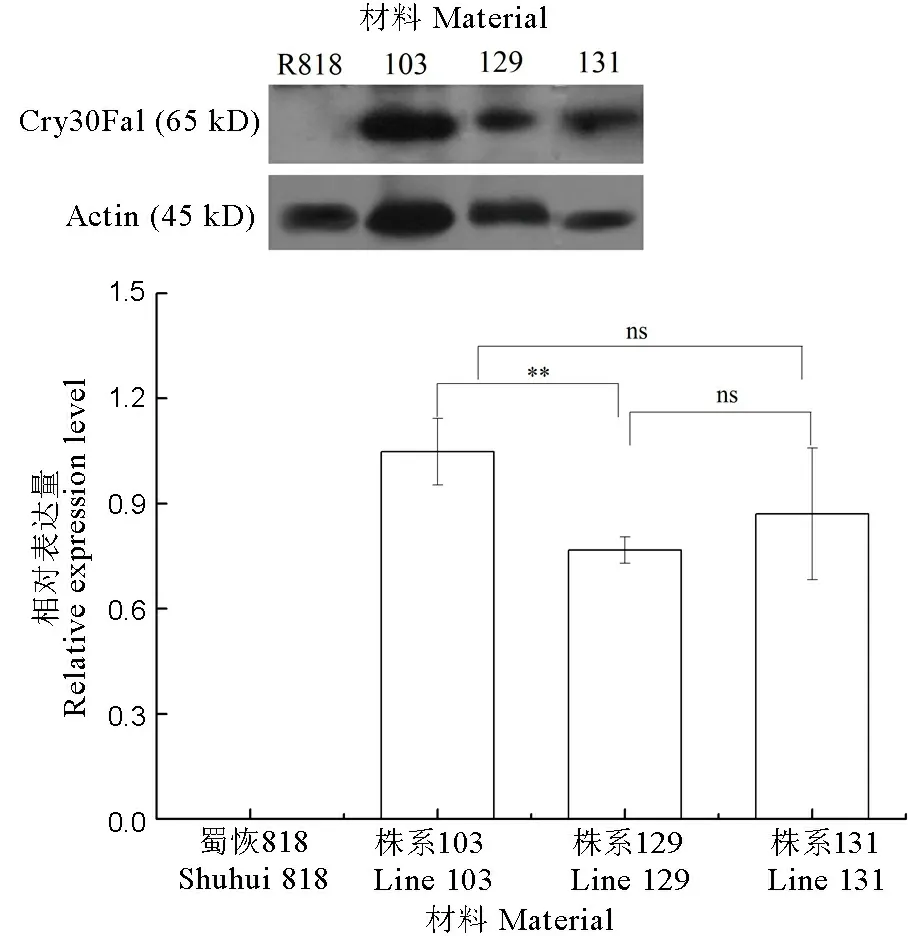
ns-无显著差异; **在0.01水平差异显著。
ns,No significant difference;**,Significant difference at 0.01 level.
图7Cry30Fa1在灌浆期叶片中的表达情况
Fig. 7. Expression of Cry30Fa1 in leaf at the filling stage.
3讨论
3.1转基因材料的获得及选育
程海鹏等[20]研究表明,多拷贝插入基因容易造成基因沉默,同时也会导致后代的遗传和抗性不稳定。本研究经过转基因水稻连续多代的自交分离选择了31份纯系的转基因材料,但仍有株系高代分离和丢失基因的现象存在,这与前人研究结果相似。有研究表明农杆菌介导的遗传转化过程中,外源基因的插入是一个随机的过程, 有可能插入某个基因内部而造成农艺性状的变化,外源基因拷贝数越高,其农艺性状变异越大[21]。通过对3份转基因材料的主要农艺性状进行分析,我们可以看出通过连续多次的人工选育及分子标记选择,仍然可以获得农艺性状变化不大的转基因株系,根据前人的研究结果猜测这3份转基因材料可能是低拷贝转基因株系,同时接下来需要对拷贝数进行分析予以验证。
3.2转基因材料分子水平的表达
A-单株抗虫性鉴定; B-苗期集团抗虫鉴定; C-大田抗虫性鉴定。
A, Individual identification of pest resistance; B, Pest resistance identification in seedling group; C, Field identification of pest resistance.
图8三种不同抗虫鉴定方法的鉴定结果
Fig. 8. Pest resistance identification results by three different methods.
在转录和翻译水平分析外源基因表达时,往往容易出现个别样品在转录和翻译水平不一致的问题[22],在转基因植物中外源基因拷贝数常影响目的基因的表达水平和遗传稳定性[23]。通过对31份转基因株系进行了实时荧光定量PCR和Western Blot蛋白分析,31份材料在转录水平均有表达,但有6份材料没有蛋白表达,这可能由于蛋白表达量过低无法检测到或者翻译受阻造成蛋白未表达;同时我们对3份材料进行重点分析,3份材料在基因表达量和目标蛋白表达量上均有差异且两者差异变化趋势相同,可以看出基因的转录水平和翻译水平的表达量呈现正相关。
表2不同鉴定方法下水稻抗虫性的分析(平均值±标准差,n=3)
Table 2. Insect resistance of rice by different identification methods(mean± SD, n=3).

%
同一行数据后带相同字母者表示品种间差异未达显著水平(P>0.05)。
Within a row, data followed by the same letter show no significant difference(P>0.05).
3.3转基因材料抗虫性鉴定
目前水稻品种抗性筛选中最常用的为标准苗期集团筛选法,该法仅能反应出水稻品种幼苗阶段的抗性水平,可能使得一些具有成株期抗性的品种得不到利用[24],且水稻生产过程中苗期飞虱数量极少,通常要到成株期才能表现出大量飞虱的侵害,大田抗性鉴定因其与水稻生产安全紧密相关而越来越受到重视[25];同时,汪秀峰等[26]研究表明,不同生育期Bt蛋白的表达量不同,在水稻生长旺盛的时期表达量相对较高,故这个时候检测的准确性更高。本研究采用3种不同抗虫性鉴定方法的目的在于探究转基因水稻株系真实的抗虫性。研究表明,通过单株试管鉴定法说明转基因株系有一定的杀稻褐飞虱效果。虽然标准苗期集团筛选法结果显示苗期材料均不抗褐飞虱,但转基因材料的死苗率较亲本材料出现了明显改善;田间水稻抗虫性鉴定结果说明转基因材料129达到中抗水平,材料103和131达到了抗的水平。以上结论表明水稻成株期与苗期的抗性存在不同的情况,这与前人的研究结果有相似的地方,说明水稻抗性鉴定需要苗期和大田相结合。
单株鉴定结果表明转基因材料存在一定杀虫效果,但是杀虫效果并没有达到较高的水平。以上现象我们推测可能是由于在水稻苗期Bt蛋白表达有限或者苗期水稻生命力弱而不足以抵抗褐飞虱侵害;同时在单株抗虫鉴定中出现非转基因材料中褐飞虱死亡情况,分析可能是由于褐飞虱比较弱小掉落在固体培养基上不能移动造成饥饿致死或者可能由于前期死亡的水稻单株里褐飞虱不能长期取食以致死亡。这有待进一步研究证实。
于志晶等[26]的研究表明,Bt蛋白含量与其抗虫性表现基本成正比。束春娥等[27]的研究表明,残虫量达到防治指标时, 必须及时辅以化学防治。本研究通过对田间抗虫结果分析,发现与预期抗虫性有所差异,分析原因有可能是这3份转基因材料Bt蛋白表达量较少,造成杀虫效果欠佳;当然也有可能是由于加盖透气网在褐飞虱危害后期虫口压力过大,未及时辅以化学防治以致出现抗虫数据偏差。
为了获得转基因抗稻褐飞虱的优良恢复系材料,我们通过农杆菌介导法转入抗稻褐飞虱Bt基因并对基因进行分子水平检测,同时也采取了两种苗期抗虫性鉴定和田间抗虫性鉴定。综上所述,本研究已经实现了一个新的抗虫基因(Cry30Fa1基因)的优化及成功转化,筛选出了多个具有抗虫性的转基因纯合株系,为以后培育更多的抗稻褐飞虱水稻创造了新的材料。
谢辞:特别感谢中国科学院遗传与发育生物学研究所朱祯实验室提供pCDMAR-Hyg载体;感谢福建省农业科学院生物技术研究所王锋实验室提供转基因技术帮助。
在线辅助信息:表S1放在中国水稻科学网站,网址为(http://www.ricesci.cn/CN/articl/showSupportInfo.do?id=2597)。
参考文献:
[1]Dinh H D, Cuong N D, Tai N D, et al. Analysis of rice pest constraints based on survey data at Tan Phu Thanh village, Cantho Province.Omonrice, 2001, 9: 102 -106.
[2]Settle W H, Ariawan H, Astuti E T, et al. Managing tropical rice pests through conservation of generalist natural enemies and alternative prey.Ecology,1996, 77(7): 1975-1988.
[3]杨瑞芳, 白建江, 朴钟泽, 等. 转cry1Ac1基因抗虫水稻的培育. 分子植物育种, 2014, 12(6): 1103-1111.
Yang R F, Bai J J, Piao Z Z, et al. Development of insect-resistant transgenic rice withcry1Ac1 gene.MolPlantBreeding, 2014, 12(6): 1103-1111.(in Chinese with English abstract)
[4]胡巍, 李艳芳, 胡侃, 等. 分子标记辅助选择抗褐飞虱基因改良桂农占的BPH抗性. 分子植物育种, 2015, 13(5): 951-960.
Hu W, Li Y F, Hu K, et al. Improving BPH-resistance of rice cultivar Guinongzhan by marker-assisted selection for BPH-resistant genes.MolPlantBreeding, 2015, 13(5): 951-960.
[5]Swaminathan M S. The Hindu Survey of Indian Agriculture. The Hindu Group of Publications, 1999: 9-16.
[6]吴振映, 柳絮, 王文英, 等. 利用农杆菌介导法获得转cry2A抗虫基因水稻的研究. 山东农业科学, 2011(5): 1-37.
Wu Z Y, Liu X, Wang W Y, et al. Development of japonica rice with insect-resistant geneCry2A* byagrobacterium-mediated transformation.ShandongAgricSci,2011(5): 1-37.(in Chinese with English abstract)
[7]祁永斌, 叶胜海, 陆艳婷, 等. 转Cry1A(b)基因抗虫水稻的获得及鉴定. 浙江农业学报, 2007, 19(4): 264-267.
Qi Y B, Ye H S, Lu Y T, et al. Development and identification of insect resistant transgenic rice withCry1A(b) gene.ActaAgricZhejiang, 2007, 19(4): 264-267.(in Chinese with English abstract)
[8]于志晶, 刘丽, 李淑芳, 等. 转Cry1C*基因抗虫水稻的培育. 分子植物育种, 2011, 9(6): 702-708.
Yu Z J, Liu L, Li S F, et al. Development of transgenic insect-resistant japonica rice withCry1C* gene.MolPlantBreeding, 2011, 9(6): 702-708.(in Chinese with English abstract)
[9]Rao K V, Rathore K S, Hodges T K, et al. Expression of snowdrop lectin( GNA) in transgenic rice plants confers resistance to rice brown planthopper.PlantJ, 1998, 15(4): 469-477.
[10]左示敏, 张平, 祝树德, 等. 水稻转GNA基因后代对褐飞虱的抗性研究. 作物学报, 2004, 30(4): 371-375.
Zuo S M, Zhang P, Zhu S D, et al. Resistance to brown plant hopper in progenies of GNA transgenic rice.ActaAgronSin,2004, 30(4): 371-375.(in Chinese with English abstract)
[11]邹良平, 起登凤, 李平, 等. 利用农杆菌介导法将PTA基因导入水稻的研究. 西南农业学报, 2005, 18(3): 229-233.
Zuo L P, Qi D F, Li P, et al. Studies on transformation of the pinellia tenata agglutinin (pta) gene into rice mediated by agrobacterium.SouthwestChinaJAgricSci,2005, 18(3): 229-233.(in Chinese with English abstract)
[12]康俊梅, 熊恒硕, 杨青川, 等. 植物抗虫转基因工程研究进展. 生物技术通报, 2008, 1: 14-19.
Kang J M, Xiong H S, Yang Q C, et al. Progress on genetic engineering of plant for insect resistance.BiotechnolBull,2008, 1: 14-19.(in Chinese with English abstract)
[13]Zhu J, Zheng A P, Wang S Q, et al. Characterization and expression ofcry4Cb1 andcry30Ga1 fromBacillusthuringiensisstrain HS18-1.JInvertPathol,2009, 103(3): 200-202.
[14]Guan P, Dai X J, Zhu J, et al. Characterization of thecry54Ab1 operon ofBacillusthuringiensissubsp.sichuansisstrain MC28.BiocontSciTechnol,2014, 24(1): 80-89.
[15]Tan F R, Zhu J, Tang J, et al. Cloning and characterization of two novel crystal protein genes,cry54Ab1 andCry30Fa1, fromBacillusthuringiensisStrain BtMC28.CurrMicrobiol,2009, 58(6): 654-659.
[16]周宗梁, 林智敏, 耿丽丽, 等. 水稻中cry1Ah1基因密码子优化方案的比较. 生物工程学报, 2012, 28(10):1184-1194.
Zhou Z L, Lin Z M, Geng L L, et al. Comparison of codon optimizations ofcry1Ah1 gene in rice.ChinJBiotechnol,2012, 28(10):1184-1194.(in Chinese with English abstract)
[17]李双成, 王世全, 尹福强, 等. 提高农杆菌介导转化水稻效率的因素. 中国水稻科学, 2005, 19(3): 231-237.
Li S C, Wang S Q, Yin F Q, et al. Some factors affectingagrobacterium-mediated transformation frequency in rice.ChinJRiceSci,2005, 19(3): 231-237.(in Chinese with English abstract)
[18]Heinrichs E A, Medrano E G, Rapusas H R. Genetic evaluation for insect resistance in rice. Manila: IRRI,1985, 72-177.
[19]刘光杰, 付志红, 沈君辉, 等. 水稻品种对稻飞虱抗性鉴定方法的比较研究. 中国水稻科学, 2002, 16(1): 52-56.
Liu G J, Fu Z H, Shen Q H, et al. Comparative study on evaluation methods for resistance to rice planthoppers (Homoptera: Delphacidae) in rice.ChinJRiceSci,2002, 16(1): 52-56.(in Chinese with English abstract)
[20]程海鹏, 朱睦元, 金伟, 等. 植物转基因沉默研究进展. 生物工程进展, 2001, 21 (6): 47-49.
Cheng H P, Zhu M Y, Jin W, et al. Advances of researches on the plant transgene silencing.ProgBiotechnol,2001, 21(6): 47-49.(in Chinese with English abstract)
[21]唐微. 转基因拷贝数对农艺性状的影响. 安徽农业科学, 2008, 36(32):13991-13992.
Tang W. Effects of trans gene copy number on agronomic characters of transformed plants.JAnhuiAgricSci,2008, 36(32): 13991-13992.(in Chinese with English abstract)
[22]Hiwasa-Tanase K, Nyarubona M, Hirai T, et al. High-level accumulation of recombinant miraculin protein in transgenic tomatoes expressing a synthetic miraculin gene with optimized codon usage terminated by the native miraculin terminator.PlantCellRep, 2011, 30(1): 113-124.
[23]王育花, 赵森, 陈芬, 等. 利用实时荧光定量PCR法检测转基因水稻外源基因拷贝数的研究. 生命科学研究, 2007, 11(4): 301-305.
Wang Y H, Zhao S, Chen F, et al. Estimation of the copy number of exogenous gene in transgenic rice by real-time fluorescence quantitative PCR.LifeSciRes, 2007, 11(4): 301-305.(in Chinese with English abstract)
[24]陈峰, 傅强, 罗举, 等. 苗期抗性不同的水稻品种成株期对褐飞虱的抗性. 中国水稻科学, 2009, 23(2): 201-206.
Chen F, Fu Q, Luo J, et al. Adult stage resistances to brown planthopper,Nilaparvatalugensof rice varieties with different seedling resistances.ChinJRiceSci, 2009, 23(2): 201-206.(in Chinese with English abstract)
[25]胡杰, 杨长举, 张庆路, 等. 基因聚合改良杂交稻组合的稻飞虱田间抗性表现. 应用昆虫学报, 2011, 48(5): 1341-1347.
Hu J, Yang C J, Zhang Q L, et al. Resistance of pyramided rice hybrids to brown planthoppers.ChinJApplEntomol,2011, 48(5): 1341-1347.(in Chinese with English abstract)
[26]汪秀峰, 叶芬, 李莉, 等. 转基因水稻恢复性及其F1代Bt蛋白的时空表达分析. 分子植物育种, 2014, 12(6): 1077-1081.
Wang X F, Ye F, Li L, et al. Temporal and spatial expression of Bt toxin in transgenic restorer line and its F1hybrids.MolPlantBreeding, 2014, 12(6): 1077-1081.(in Chinese with English abstract)
[27]于志晶, 蔡勤安, 林秀峰, 等. 转基因抗虫水稻中 Bt 蛋白表达量的研究. 安徽农业科学, 2012, 40(6): 3251-3252.
Yu Z J, Cai Q A, Lin X F, et al. Expression of Bt protein in transgenic insect-resistant rice.JAnhuiAgricSci,2012, 40(6): 3251-3252.(in Chinese with English abstract)
[28]束春娥, 孙以文, 孙洪武. 转基因抗虫棉承受棉铃虫风险压力研究初报. 江苏农业科学, 2000(4): 38-41.
Su C E, Sun Y W, Sun H W. Primary report on studying transgenic insect resistant cotton under risk pressure fromHelicoverpaarmigera.JiangsuAgricSci,2000(4): 38-41.(in Chinese with English abstract)
Development and Identification of Insect Resistant Transgenic Rice withCry30Fa1 Gene
WANG Hai-peng, HUANG Xiao-xi, LIANG Yue-yang, ZHU Jun, ZHANG Cui-xia, WANG Xiu-mei, GONG Chang-wei, ZHENG Ai-ping, DENG Qi-ming, LI Shuang-cheng, WANG Ling-xia, LI Ping, WANG Shi-quan*
(RiceResearchInstitute,SichuanAgriculturalUniversity,Wenjiang611130,China;*Corresponding author, E-mail: sqwangscau@163.com)
WANG Haipeng, HUANG Xiaoxi, LIANG Yueyang, et al. Development and identification of insect resistant transgenic rice withCry30Fa1 gene. Chin J Rice Sci, 2016, 30(3): 256-264.
Abstract:Modified Cry30Fa1, a Bacillus thuringiensis (Bt) gene encoding a high-efficiency insecticidal protein to the brown planthopper(BPH),was introduced into Shuhui 818(R818) by Agrobacterium-mediated genetic transformation and 46 transgene lines were obtained. We confirmed the valid transformation by RT-qRCR and Western blot at transcriptional level and translational level, and fixed the stable expression Cry30Fa1 in homozygosis. The classical pedigree breeding methods were also used to select the important agronomic traits in transgenic lines. Furthermore, we evaluated the resistance to BPH of different lines in growth chamber and field, and found that the R818-Cry30Fal displayed higher resistance than untransformed R818 in seedling stage. We also observed the reduced population of BPH feeding the transgenic lines, suggesting that the transformed Cry30Fa1 enhanced resistibility to BPH in rice. We cultivated new BT protein transgenic rice restorer line R818-Cry30Fal, which may provide new BPH resistance material to three line hybrid rice breeding and enrich BPH resistance germplasm resources in rice.
Key words:brown planthopper; Agrobacterium-mediated method; insect resistance; Cry30Fa1
DOI:10.16819/j.1001-7216.2016.5190
收稿日期:2015-12-25; 修改稿收到日期: 2016-01-15。
基金项目:国家转基因生物新品种培育科技重大专项(2011ZX08001001)。
中图分类号:Q786;S435.112+.3
文献标识码:A
文章编号:1001-7216(2016)03-0256-09
中国水稻科学(Chin J Rice Sci),2016,30(3):256-264
http://www.ricesci.cn
