水稻类病斑突变体wy3的鉴定和基因定位
2016-06-16张宏根王茂宇张丽佳胡雅马佳琦张翼帆汤述翥梁国华顾铭洪
张宏根 王茂宇 张丽佳 胡雅 马佳琦 张翼帆 汤述翥 梁国华 顾铭洪
(扬州大学 江苏省作物遗传生理重点实验室/教育部植物功能基因组学重点实验室,江苏 扬州225009; #共同第一作者;*通讯联系人, E-mail:sztang@yzu.edu.cn)
水稻类病斑突变体wy3的鉴定和基因定位
张宏根#王茂宇#张丽佳胡雅马佳琦张翼帆汤述翥*梁国华顾铭洪
(扬州大学 江苏省作物遗传生理重点实验室/教育部植物功能基因组学重点实验室,江苏 扬州225009;#共同第一作者;*通讯联系人, E-mail:sztang@yzu.edu.cn)
张宏根,王茂宇,张丽佳,等. 水稻类病斑突变体wy3的鉴定和基因定位. 中国水稻科学, 2016, 30(3): 239-246.
摘要:在粳稻品种武育粳3号栽培群体中获得一个类病斑突变体wy3。该突变体类病斑出现于苗期,分蘖期扩散至整张叶片,属于扩散型类病斑突变体。相比野生型,突变体wy3的株高明显降低,有效分蘖数减少,穗长、每穗粒数、结实率均显著降低。遮光处理表明,突变体wy3类病斑的产生受自然光诱导。台盼蓝染色结果表明,类病斑部位有大量的死亡细胞。突变体wy3的光合色素含量和净光合速率较野生型显著降低,SOD、POD、CAT活性和MDA含量均显著高于野生型。遗传分析表明突变体表型受单隐性核基因控制,采用BSA将该基因初步定位在第2染色体短臂端粒附近。采用F2群体中1099株类病斑单株将基因定位在标记W2-17和W2-18之间28kb的物理距离内。测序结果表明,突变体wy3中的LOC_Os02g02000编码区(CDS)第375位碱基C缺失,导致翻译提前终止,突变体中该候选基因为OsHPL3的一个新等位基因。
关键词:水稻; 类病斑突变体; 基因定位
植物斑点叶(spotted leaf)突变体是指植物在没有遭受病原物侵染或明显逆境条件下在叶片或叶鞘上自发形成斑点的一类突变体,由于这些斑点与病原物侵染后产生的病斑非常相似,又被称为类病变突变体(lesion simulating disease mutant,lsd)或类病斑突变体(lesion mimic mutant,lmm)[1]。类病斑突变体广泛存在于水稻、拟南芥、玉米、大麦和大豆等植物中[2-7]。根据突变体的表型,类病斑突变体可分为起始型和扩散型[8-10],起始型突变 体的病斑有相对稳定的分布位置和大小,而扩散型突变体的病斑形成以后会很快扩散到叶片的其他部位,甚至包括叶鞘和茎秆。已有研究表明,植物类病斑的发生主要与过敏性反应(hypersensitive response, HR)导致的细胞程序性死亡以及细胞死亡途径中自由基非正常产生有关[11-13]。此外,许多类病斑突变体对某些植物病原物表现出了一定的抗性[14-16],能激发病程相关蛋白的表达[17-18],可以提高植株的持久、广谱抗病性。因此,这类突变体对植物过敏反应激活机制和植物抗病反应机制的研究具有重要意义。
目前,水稻中已经发现了80多个类病斑突变[19]。其中,绝大部分呈单隐性核基因遗传规律,也有部分表现为双隐性核基因或显性核基因遗传规律。在这些类病斑基因中,spl5[20]、spl7[21]、spl11[22]、spl18[23]、spl28[16]、Ttml[24]等18个基因已被克隆,这些基因编码许多不同类型的蛋白,如第一个被克隆的水稻类病变突变基因spl7编码一个热激转录因子蛋白 (heat stress transcription factor protein, HSF)[21],spl11编码一个 U-box/Armadillo 重复蛋白[22],spl18编码一个酰基转移酶[23]。类病斑基因的克隆与功能研究表明类病变过程非常复杂,这些基因的作用机制以及性状表现各不相同,涉及到许多生化代谢过程,但突变体性状大多与细胞程序性死亡相关[22]。
本课题组在粳稻品种武育粳3号栽培群体中获得一个稳定遗传的类病斑突变体wy3,该类病斑突变是自然诱变产生。本研究中以wy3为材料,描述了该突变体的形态特征、生理学特性,并对该突变基因进行了精细定位与克隆,以期为该基因的功能研究及应用提供理论依据。
1材料与方法
1.1实验材料
2013年扬州正季,在粳稻品种武育粳3号栽培群体中获得一个类病斑突变体wy3,经过多代连续种植,突变体类病斑表型稳定遗传。2014年正季扬州,以籼稻品种Kasalath为父本与wy3杂交获得F1,2014年冬季在海南种植F1及相关亲本,成熟期收获F1植株自交种子。2015年正季,种植突变体wy3、野生型武育粳3号及组合wy3/ Kasalath F2群体。
1.2表型鉴定
2015年正季,将突变体wy3和对照武育粳3号种植于扬州大学农学院实验基地,小区种植,3次重复,管理与一般大田相同。全生育期观察田间突变体的表型,包括突变体斑点出现的时期、颜色及分布情况等。成熟后随机从小区中央选取10株考查株高、单株穗重、每株有效穗数、每穗粒数、每穗实粒数、结实率和千粒重等性状。
1.3光照处理实验
通过遮光试验了解光照对斑点发生的影响。大田条件下,在苗期用宽度约为1 cm 的锡箔纸对突变体wy3 叶片已有斑点和无斑点部位进行遮光处理,各重复3次。分别观察遮光15 d及恢复光照7 d后斑点的发生及变化情况,并拍照。
1.4突变体死亡细胞鉴定
苗期,分别取野生型正常叶片与突变体wy3发生类病斑的叶片,剪成1 cm×1 cm大小。加入台盼蓝染液(染液配方参照Yin等[25]的方法),真空抽滤使染液进入细胞间隙,沸水蒸沸5~8 min。室温下静置6~8 h后用2.5 g/mL的水合氯醛溶液脱色,直到组织完全透明为止。脱色好的叶片在体视显微镜下观察、拍照。
1.5叶绿素含量测定
分蘖期,分别取野生型正常叶片与突变体wy3发生类病斑的叶片,按Lichtenthaler等[26]修正的Arnon法进行叶绿素和类胡萝卜素含量测定,具体操作如下:将鲜叶去掉叶脉,截取叶片中段(叶片最宽处),擦净组织表面污物,并吸干叶片表面附着水;准确剪成2 mm条状并称取0.2 g鲜样3份,分别置于3个20 mL带盖的玻璃管中;吸取10 mL提取液(96%乙醇)置于玻璃管中,密封并置于30℃~50℃水浴锅中萃取3 h,此过程中需轻摇几次。当叶片完全变白时即可比色。比色时,以提取液为空白,在波长663 nm、646 nm和470 nm下测定吸光度。每样重复测定2次。
1.6光合作用相关指标的鉴定
始穗期,使用Li-6400型便携式光合测定仪于晴天上午9:00-11:00分别测定wy3及其野生型剑叶叶片的净光合速率(net photosynthetic,Pn)、气孔导度(leaf conductance,Gs)、蒸腾速率(transpiration rate,Tr)和胞间CO2浓度(intercellular CO2concentration,Ci),各测定3片具有代表性的剑叶。光合测定仪使用红蓝光源,光强恒定为1200 μmol/(m2·s),温度为30℃,CO2浓度为空气中的浓度,湿度为大气中的湿度。取3次重复的平均值进行分析。
1.7抗氧化酶活性测定
分蘖期,测定突变体wy3 和对照相同部位叶片中超氧化物歧化酶(superoxide dismutase, SOD)、过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)活性和丙二醛(malonaldehyde, MDA)的含量。所有测定重复3次,取平均值进行分析。SOD活性采用SOD测试盒(南京建成生物工程研究所生产)测定,该试剂盒采用黄嘌呤氧化酶法;POD活性采用愈创木酚法[27]测定,以每1 min内OD470变化0.01 为一个过氧化物酶活性单位(U);CAT活性采用高锰酸钾滴定法测定;MDA含量采用硫代巴比妥酸(thiobarbituric acid, TBA)法测定。
1.8图谱构建与数据分析
采用隐性分离群体进行遗传分析和基因定位。在F2群体中,根据分子标记检测的结果,具有wy3突变亲本带型的个体赋值1,具有Kasalath带型的个体赋值3,具有双亲带型(杂合带)的个体赋值2,利用MapMaker 3.0作图软件进行基因位点与标记间连锁分析,用Kosambi函数将重组率转化为遗传距离(centiMorgan, cM)。其他数据在Excel 2013中处理。
1.9候选基因分析
根据基因精细定位结果,查阅在水稻基因组注释数据库(Rice Genome Annotation Project)中相应区间内的所有开放阅读框(ORF),并分析可能的候选基因。根据候选基因全长基因组DNA序列,设计测序引物,分别对野生型和突变体的基因组进行扩增并测序。测序结果用ContigExpress软件拼接完整再通过DNASTAR软件进行比对,确定突变位点。
2结果与分析
2.1突变体表型鉴定
在大田自然条件下,突变体wy3从苗期开始叶片表面出现类病斑,分蘖期比较明显。叶片上斑点出现的位置并无特殊规律,但最终都会扩散到整张叶片,表现为扩散型突变体。考查突变体与野生型的农艺性状,突变体的长势较差,株高、穗长、每穗粒数、结实率等农艺性状也显著低于对照(表1,图1)。造成突变体株高等性状显著降低的原因可能是由于突变叶片过早枯死,光合作用能力减退。
2.2光照对突变体的影响
对突变体wy3只出现少量类病斑的叶片未产生类病斑部位用锡箔纸遮光15 d后发现,整张叶片其他部位都产生类病斑,但是遮光部位没有产生类病斑; 恢复光照,跟踪观察原遮光部位变化,一周后,原本没有类病斑的遮光处产生了明显的类病斑(图2)。该结果表明,类病斑的发生受自然光照的诱导,适当的遮光可以阻止或者减轻类病斑的发生或者扩散。

A-苗期植株表型;B-分蘖初期野生型(左)和突变体wy3(右)植株表型;C-成熟期野生型(左)和突变体wy3(右)植株表型;D-野生型(左)和突变体wy3(右) 穗部表型;E-分蘖期野生型(左)和突变体wy3(右)叶片表型。
A, Phenotypes ofwy3 during seedling stage; B, Phenotypes of WT (left) andwy3(right) during the early tillering stage; C, Phenotypes of WT (left) andwy3(right) during the mature stage; D, Panicle traits of WT (left) andwy3(right); E, Leaves of WT (left) andwy3 (right) during the early tillering stage.
图1突变体wy3及其野生型表型
Fig.1. Phenotypes of wy3 and wild type(WT).
表1突变体和野生型的农艺与产量性状
Table 1. Performance of agronomic and yield traits of the mutant wy3 and the wild type(WT).

材料Material株高Plantheight/cm分蘖数No.oftillers穗长Paniclelength/cm结实率Seed-settingrate/%每穗粒数Grainnumberperpanicle粒长Grainlength/mm粒宽Grainwidth/mm千粒重1000-grainweight/gwy356.9±0.6**3.5±0.6**14.8±1.2**79.0±0.1**89.6±6.8**7.5±2.23.4±1.426.54±0.56WT87.5±0.510.0±1.716.6±0.898.3±0.1123.6±11.07.3±2.83.3±0.926.85±0.62
**表示在0.01水平差异显著。下同。
**denote significant difference at 0.01 level. The same as below.
表2突变体wy3和野生型叶片光合色素含量
Table 2. Pigment contents in leaves of wy3 and wild type(WT).

材料Material叶绿素a含量Chlorophyllacontent/(mg·g-1)叶绿素b含量Chlorophyllbcontent/(mg·g-1)叶绿素a/bChlorophylla/b类胡萝卜素含量Carotenoidcontent/(mg·g-1)wy31.28±0.09**0.27±0.11**4.68±0.13**0.15±0.11**WT2.28±0.030.99±0.082.31±0.070.59±0.04

A-遮光前wy3; B-未发生斑点部位遮光15 d后; C-遮光部位恢复光照7 d后; D-野生型。
A, Leaf ofwy3 before shading; B, Leaf without lesion after shading for 15 days; C, Leaf shaded for 7 days then under normal light for 7 days; D, Wild type.
图2遮光对突变体wy3叶片的影响
Fig. 2. Effects of shading on wy3 leaves.
2.3叶绿素含量变化
分蘖期,通过对突变体和野生型叶片叶绿素含量的测定结果可以看出,突变体的叶绿素a、叶绿素b和类胡萝卜素含量均显著低于野生型,但叶绿素a/b比值显著高于其野生型,说明突变体wy3是一个叶绿素缺陷突变体(表2)。
2.4突变对光合作用的影响
始穗期,测定突变体wy3和野生型剑叶的光合参数,包括净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)。由于在该时期突变体叶片类病斑明显,突变体wy3所测得的Pn、Gs、Tr和Ci4个参数均显著低于野生型(表3),说明类病斑的发生导致突变体光合能力的降低。
2.5突变体叶片细胞死亡鉴定
利用台盼蓝染色方法对突变体及野生型叶片中死亡细胞进行检测。经台盼蓝染色后,野生型叶片整体呈淡蓝色,没有深蓝色染色,说明野生型叶片基本上没有细胞死亡。与野生型叶片不同的是,突变体类病斑发生处对应着严重的深蓝色小点,说明斑点部位有大量的死亡细胞,而在大块深蓝色染色间隙也出现了深蓝色的小点,说明类病斑正在扩散中(图3)。
2.6抗氧化酶活性的变化
植物细胞程序性死亡时常产生活性氧的沉积,因此测定了突变体wy3和野生型相同部位叶片中一系列的活性氧代谢生理指标。结果显示,突变体wy3中CAT、POD、T-SOD以及MDA含量均显著高于野生型(图4),说明在突变体叶片产生类病斑后,活性氧大量积累,活性氧的积累诱发了植物细胞合成大量的超氧化物歧化酶,超氧化物歧化酶将自由基状态的氧负离子以及单线态氧歧化为过氧化氢,过氧化氢在细胞中的积累诱发过氧化物酶(过氧化氢酶)的大量表达。同时,在突变的叶片中活性氧大量积累导致叶片细胞中的生物膜的磷脂分子的不饱和脂肪酸链大量过氧化,生成大量丙二醛。
表3突变体wy3和野生型武育粳3号分蘖期叶片光合特性
Table 3. Photosynthetic parameters of wy3 and wild type(WT) at the initial tillering stage.

材料Material净光合速率Pn/(mmol·m-2s-1)蒸腾速率Tr/(mmol·m-2s-1)气孔导度Gs/(mol·m-2s-1)胞间CO2浓度Ci/(mmol·mol-1)wy314.16±0.27**193.27±10.10**0.13±0.02**2.76±0.23**WT22.46±0.29276.96±6.300.66±0.088.93±0.43

图3武育粳 3号和wy3叶片的台盼蓝染色检测
Fig. 3. Trypan blue staining of leaves of the mutant wy3 and wild type(WT).
2.7wy3的遗传控制与基因定位
2014年海南, Kasalath与突变体wy3配置的F1植株叶片表型正常,2015年F2群体中出现明显的分离,分别表现双亲性状,其中正常株3000株,类病斑单株1099株。经卡方测验,正常株与突变株符合3∶1分离比(2=3.84)。表明突变体wy3类病斑性状受一对隐性核基因控制。

**P<0.01.
图4突变体wy3与野生型(WT)对照在分蘖期的生理学特性比较
Fig. 4. Physiological characteristics of the wild type(WT) and the wy3 mutant during the tillering stage.
表4 本研究开发的多态性STS标记
Table 4. Polymorphic STS markers developed in this study.
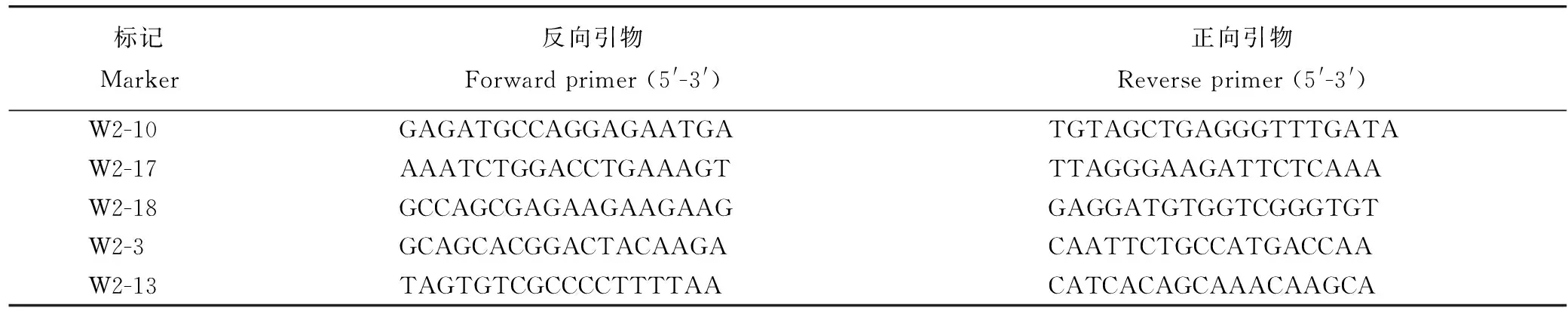
标记Marker反向引物Forwardprimer(5'-3')正向引物Reverseprimer(5'-3')W2-10GAGATGCCAGGAGAATGATGTAGCTGAGGGTTTGATAW2-17AAATCTGGACCTGAAAGTTTAGGGAAGATTCTCAAAW2-18GCCAGCGAGAAGAAGAAGGAGGATGTGGTCGGGTGTW2-3GCAGCACGGACTACAAGACAATTCTGCCATGACCAAW2-13TAGTGTCGCCCCTTTTAACATCACAGCAAACAAGCA
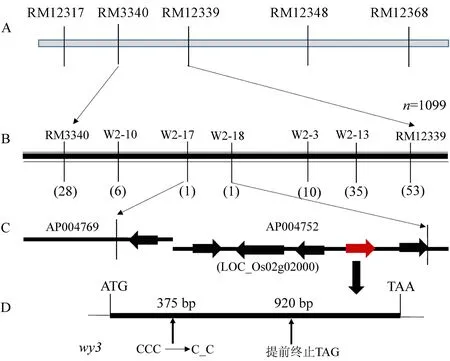
A-基因的初步定位; B-基因的精细定位; C-覆盖基因物理图谱; D-基因内变异位点。
A, Primarily mapping of target gene; B, Fine mapping of target gene; C, Physical map of genes; D, The mutation locus of target gene.
图5水稻类病斑突变体基因定位
Fig. 5. Mapping of the target gene in wy3.
为定位该类病斑基因,在均匀分布于水稻12条染色体的380对SSR标记中,筛选出120对在Kasalath双亲间显示多态性的标记。分别取15株正常株和15株突变株构建正常基因池和突变基因池,利用上述多态标记对这两个基因池进行检测。在所用检测的120对标记中,第2染色体的标记RM3340和RM12368在两个混池间表现出差异,初步推测这两个标记与基因连锁。进一步选取30株正常株和30株类病斑植株,利用RM3340、RM12368进行检测,正常株表现为Kasalath或F1条带,类病斑植株表现为突变体wy3条带,说明标记RM3340、RM12368与基因连锁(图5)。结合本实验室已有的SSR标记和Gramene(http://www.gramene.org)网站上提供的SSR信息,在标记RM3340、RM12368附近筛选了14对SSR标记,其中RM12317、RM12339和RM12348在双亲之间具有多态。利用这些标记对F2群体中1099株类病斑单株进行检测,结果在标记RM3340处找到28个交换株,在标记RM12339处找到53对交换株,根据交换株信息,初步将基因定位在RM3340和RM12339之间。为了进一步精细定位基因,结合已经公布的水稻品种9311和日本晴全基因组序列,利用Primer Premier 5.0软件,在水稻第2染色体上发展了13对新的STS标记,其中5对标记表现出多态性(部分引物序列如表4所示)。利用5对多态标记和81株交换株,最终把基因定位在W2-17和W2-18之间,两标记间物理距离约为28 kb。
2.8候选基因测序分析
根据水稻基因组注释数据库(Rice Genome Annotation Project)中的数据,在定位区间共有6个开放阅读框(LOC_Os02g01960-LOC_Os02g02010)。 对这6个ORF进行基因组测序。结果发现,与野生型武育粳3号相比,突变体wy3中的LOC_Os02g02000编码区(CDS)第375位碱基C缺失,编码序列在920 bp处出现终止子TGA,使得翻译提前终止 (图5),并且野生型武育粳3和日本晴在这个ORF上的序列完全相同。
3讨论
在植物中已经发现的大量斑点叶或类病斑突变体中,斑点或者类病斑的出现往往伴随着其他农艺性状的改变,但不同突变体表现并不一致。例如hm197[19]、lms1[28]、lmm4[29]等植株株高降低,而突变体spl32[30]株高未有显著变化; 在分蘖数上,hm197[28]、g340[31]、spl32[30]等均未发生显著变化;在结实率上,lmm4[29]、spl31[32]、spl32[30]等突变体均显著下降,但g340[31]突变体结实率没有显著变化。本研究中,wy3株高、分蘖数、结实率均显著低于其野生型,植株光合作用能力的下降是造成这些农艺、产量性状降低的主要原因。类病斑突变体叶绿素各组分含量显著低于野生型,叶绿素含量降低这一结果也与突变体植株叶片表型相符合,这也导致突变体中叶片光合作用能力的下降。
已有研究发现,类病斑形成部位通常伴随自由基和活性氧的积累。在植物细胞中,无法及时清除的活性氧积累是诱导细胞进行程序性死亡的重要信号因子。Samuilov等[33]研究表明活性氧的积累与植物细胞凋亡的起始与调节有重要关系。在水稻中已经被克隆的类病斑突变体基因中,OsLSD1[34]、spl11[22]、spl28[16]等突变体基因与细胞的凋亡有关。本研究中,台盼蓝染色后发现类病斑叶片出现大量死亡细胞,进一步测得突变体wy3类病斑叶片中的SOD、POD、CAT和MDA均极显著高于对照叶片,这一结果说明在突变体wy3叶片产生类病斑后,叶片细胞中存在大量的活性氧自由基,进而调控细胞非程序性死亡,造成了突变体叶片最终枯死。
本研究中,利用组合Kasalath/wy3衍生F2群体中的1099株隐性单株,将突变体中控制类病斑基因定位在第2染色体短臂标记W2-17和W2-18之间28 kb的物理区间内。根据已有的报道,在此区间内已经报到了3个类病斑基因spl2[35],cea62[36]和OsHPL3[37],其中spl2未进行精细定位,cea62与OsHPL3已克隆。通过对定位区间内候选ORF进行测序发现,与野生型相比,突变体wy3中的LOC_Os02g02000编码区(CDS)第375位碱基C缺失,编码序列在920 bp处出现终止子TGA,使得翻译提前终止。不同的是,突变体cea62是在LOC_Os02g02000编码区第1146bp处发生单碱基替换(TAC→TAG)从而使得翻译过程提前终止,OsHPL3突变体中的LOC_Os02g02000编码区518 bp和519 bp之间插入了一个大约700 bp大小的转座子,使得该基因功能丧失,从而发生类病斑突变。由此可以看出,本研究中定位到的类病斑基因和cea62、OsHPL3为变异位点不同的复等位基因。尽管spl2没有被精细定位,但比较已有的定位结果及突变体表型,可以推断cea62、OsHPL3及本研究中克隆的基因与已报到的spl2均为等位基因。
从表型来看,突变体wy3与已报道的cea62和OsHPL3基本一致,但也有所差异。突变体wy3在发生突变时期、病斑扩散形式、病斑颜色以及植株株高和分蘖等性状上都与cea62、OsHPL3表现一致,但是wy3在千粒重上与野生型并没有发生显著变化,这与OsHPL3的千粒重较野生型显著下降有所不同[36];突变体wy3在结实率上的表现与cea62有所不同,cea62结实率极显著低于野生型,这种极显著降低是由于花粉育性降低造成的[37],而本研究中wy3花粉育性与野生型并无显著差异(数据未列出),突变体wy3结实率下降是由于植株后期叶片枯死,籽粒灌浆不充实而出现大量瘪粒造成的。另外,OsHPL3突变体来源于粳稻品种中花11,cea62背景源于日本晴,结合性状上的差异,我们推测差异的原因可能是突变位点的不同或核背景不同。鉴于此,我们将该突变基因导入日本晴背景,以期在不同背景下研究该基因的差异。由于实验进度限制,结果仍在进一步研究中。
参考文献:
[1]王忠华. 植物类病变突变体的诱发与突变机制. 细胞生物学杂志, 2006, 27(5): 530-534.
Wang Z H. Induction and mutation mechanism of plant lesion mimic mutants.ChinJCellBiol, 2005, 27: 530-534 (in Chinese with English abstract)
[2]Dietrich R A, Delaney T P, Uknes S J, et al.Arabidopsismutants simulating disease resistance response.Cell, 1994, 77(4): 565-577.
[3]Büschges R, Hollricher K, Panstruga R, et al. The barleyMlogene: A novel control element of plant pathogen resistance.Cell, 1997, 88(5): 695-705.
[4]Gray J, Close P S, Briggs S P, et al. A novel suppressor of cell death in plants encoded by the Lls1 gene of maize.Cell, 1997, 89(1): 25-31.
[5]Badigannavar A M, Kale D M, Eapen S, et al. Inheritance of disease lesion mimic leaf trait in groundnut.JHered, 2002, 93(1): 50-52.
[6]Malamy J, Carr J P, Klessig D F, et al. Salicylic acid: A likely endogenous signal in the resistance response of tobacco to viral infection.Science, 1990, 250(4983): 1002-1004.
[7]Takahashi A, Kawasaki T, Henmi K, et al. Lesion mimic mutants of rice with alterations in early signaling events of defense.PlantJ, 1999, 17(5): 535-545.
[8]Dangl J L, Dietrich R A, Richberg M H. Death don’t have no mercy: Cell death programs in plant-microbe interactions.PlantCell, 1996, 8(10): 1793.
[9]Neuffer M G, Calvert O H. Dominant disease lesion mimics in maize.JHered, 1975, 66(5): 265-270.
[10]Shirasu K, Schulze-Lefert P. Regulators of cell death in disease resistance.PlantMolBiol, 2000, 44(3): 371-385.
[11]Dietrich R A, Richberg M H, Schmidt R, et al. A novel zinc finger protein is encoded by theArabidopsisLSD1 gene and functions as a negative regulator of plant cell death.Cell, 1997, 88(5): 685-694.
[12]Ryerson D E, Heath M C. Cleavage of nuclear DNA into oligonucleosomal fragments during cell death induced by fungal infection or by abiotic treatments.PlantCell, 1996, 8(3): 393-402.
[13]Lamb C, Dixon R A. The oxidative burst in plant disease resistance.AnnuRevPlantBiol, 1997, 48(1): 251-275.
[14]王建军, 朱旭东, 王林友, 等. 水稻类病变突变体lrd40 的抗病性与细胞学分析. 中国水稻科学, 2005, 19(2): 111-116.
Wang J J, Zhu X D, Wang L Y, et al. Disease resistance and cytological analyses on lesion resembling disease mutantlrd40 inOryzasativa.ChinJRiceSci, 2005, 19: 111-116. (in Chinese with English abstract)
[15]陈析丰, 金杨, 马伯军. 水稻类病变突变体及抗病性的研究进展. 植物病理学报, 2011, 41(1): 1-9.
Chen X F, Jin Y, Ma B J. Progress on the studies of rice lesion mimics and their resistant mechanism to the pathogens.ActaPhytopatholSin, 2011, 41: 1-9. (in Chinese with English abstract)
[16]Qiao Y, Jiang W, Lee J H, et al.SPL28 encodes a clathrin-associated adaptor protein complex 1, medium subunit μ1 (AP1M1) and is responsible for spotted leaf and early senescence in rice (Oryzasativa).NewPhytol, 2010, 185(1): 258-274.
[17]Wu C, Bordeos A, Madamba M R S, et al. Rice lesion mimic mutants with enhanced resistance to diseases.MolGenetGenom, 2008, 279(6): 605-619.
[18]Yin Z, Chen J, Zeng L, et al. Characterizing rice lesion mimic mutants and identifying a mutant with broad-spectrum resistance to rice blast and bacterial blight.MolPlant-MicrobeInterac, 2000, 13(8): 869-876.
[19]李小红, 施勇烽, 张晓波, 等. 水稻斑点叶突变体hm197 的鉴定及其基因定位. 中国水稻科学, 2015, 29(5): 447-456.
Li X H, Shi Y F, Zhang X B,et al. Identification and gene mapping of a spotted-leaf mutanthm197 in rice.ChinJRiceSci, 2015, 29(5): 447-456. (in Chinese with English abstract)
[20]Chen X, Hao L, Pan J, et al.spl5, a cell death and defense-related gene, encodes a putative splicing factor 3b subunit 3 (SF3b3) in rice.MolBreeding, 2012, 30(2): 939-949.
[21]Yamanouchi U, Yano M, Lin H, et al. A rice spotted leaf gene,spl7, encodes a heat stress transcription factor protein.PNAS, 2002, 99(11): 7530-7535.
[22]Zeng L R, Qu S, Bordeos A, et al.Spottedleaf11, a negative regulator of plant cell death and defense, encodes a U-box/armadillo repeat protein endowed with E3 ubiquitin ligase activity.PlantCell, 2004, 16(10): 2795-2808.
[23]Mori M, Tomita C, Sugimoto K, et al. Isolation and molecular characterization of a spotted leaf 18 mutant by modified activation-tagging in rice.PlantMolBiol, 2007, 63(6): 847-860.
[24]Takahashi A, Agrawal G K, Yamazaki M, et al. Rice Pti1a negatively regulates RAR1-dependent defense responses.PlantCell, 2007, 19(9): 2940-2951.
[25]Yin Z, Chen J, Zeng L, et al. Characterizing rice lesion mimic mutants and identifying a mutant with broad-spectrum resistance to rice blast and bacterial blight.MolPlant-MicrobeInterac, 2000, 13(8): 869-876.
[26]Lichtenthaler H K. Chlorophylls and carotenoids: Pigments of photosynthetic bio membranes.MethodsEnzymol, 1987 (148C): 350-382.
[27]张志良,瞿伟菁. 植物生理学实验指导. 北京: 高等教育出版社, 1990.
Zhang Z L, Qu W J. Plant Physiology Experimental Guidance. 3rd edn. Beijing: Higher Education Press, 2003. (in Chinese)
[28]王丹. 水稻分蘖调控基因TE的功能分析和类病变突变体lms1的图位克隆. 北京:中国农业科学院, 2012.
Wang D. Functional analysis of a key tillering regulator TE and map-based cloning of genelms1 in rice (OrzyasativaL.). Beijing: CAAS, 2012. (in Chinese with English abstract)
[29]邱结华, 马宁, 蒋汉伟, 等. 水稻类病斑突变体lmm4 的鉴定及其基因定位. 中国水稻科学, 2014, 28(4): 367-376.
Qiu J H, Ma N, Jiang H W, et al. Identification and gene mapping of a lesion mimic mutantlmm4 in rice.ChinJRiceSci, 2014, 28(4):367-376. (in Chinese with English abstract)
[30]钟振泉, 罗文龙, 刘永柱, 等. 一份新的水稻斑点叶突变体spl32 的鉴定和基因定位. 作物学报, 2015, 41(6): 861-871.
Zhong Z Q, Luo W L, Liu Y Z, et al. Characterization of a novel spotted leaf mutantspl32 and mapping ofspl32(t) gene in rice (Oryzasativa).ActaAgronSin, 2015, 41(6): 861-871. (in Chinese with English abstract)
[31]刘林.水稻类病变突变体g340的鉴定和基因定位.北京:中国农业科学院, 2014.
Liu L. Identification and gene mapping of a rice lesion mimic mutantg340. Beijing: CAAS, 2014 (in Chinese with English abstract)
[32]代高猛, 朱小燕, 李云峰, 等. 水稻类病斑突变体spl31的遗传分析与基因定位. 作物学报, 2013, 39(7): 1223-1230.
Dai G M, Zhu X Y, Li Y F, et al. Genetic analysis and fine mapping of a lesion mimic mutantspl31 in rice.ActaAgronSin, 2013, 39(7): 1223-1230. (in Chinese with English abstract)
[33]Samuilov V D, Kiselevsky D B, Sinitsyn S V, et al. H2O2intensifies CN--induced apoptosis in pea leaves.Biochem(Moscow), 2006, 71(4): 384-394.
[34]Wang L, Pei Z Y, He C.OsLSD1, a rice zinc finger protein, regulates programmed cell death and callus differentiation.MolPlant-MicrobeInterac, 2005, 18(5):375-384.
[35]Kojo K, Yaeno T, Kusumi K, et al. Regulatory mechanisms of ROI generation are affected by ricesplmutations.PlantCellPhysiol, 2006, 47(8): 1035-1044.
[36]Liu X, Li F, Tang J, et al. Activation of the jasmonic acid pathway by depletion of the hydro peroxide lyaseOsHPL3 reveals crosstalk between the HPL and AOS branches of the oxylipin pathway in rice.PLoSONE,2012,7(11):1-14.
[37]Tong X, Qi J, Zhu X, et al. The rice hydro peroxide lyaseOsHPL3 functions in defense responses by modulating the oxylipin pathway.PlantJ, 2012, 71(5): 763-775.
Characterization and Gene Mapping of Lesion Mimic Mutantwy3 in Rice
ZHANG Hong-Gen#, WANG Mao-yu#, ZHANG Li-jia, HU Ya, MA Jia-qi, ZHANG Yi-fan, TANG Shu-zhu*,LIANG Guo-hua, GU Ming-hong
(KeyLaboratoryofCropGeneticsandPhysiologyofJiangsuProvince/KeyLaboratoryofPlantFunctionalGenomics,MinistryofEducation,YangzhouUniversity,Yangzhou225009,China;#These authors contributed equally to this work;*Corresponding author, E-mail:sztang@yzu.edu.cn)
ZHANG Honggen, WANG Maoyu, ZHANG Lijia,et al. Characterization and gene mapping of lesion mimic mutantwy3 in rice. Chin J Rice Sci, 2016, 30(3): 239-246.
Abstract:A lesion mimic mutant wy3 was obtained from the progeny of a japonica variety Wuyujing 3 by natural mutation. The lesions were first observed on the leaves at the seedling stage, then spread gradually to the whole leaf at the initial tillering stage. Compared with the wild type(WT), the plant height, the number of effective tiller, panicle length, grain number per panicle and seed setting rate of wy3 were reduced significantly. The shading assay showed that the lesions on leaves of wy3 were induced by natural light. Compared with the wild type, the photosynthetic pigment and the net photosynthetic rate of wy3 were significantly reduced, but the SOD activity, POD activity, CAT activity and MDA content of wy3 were significantly higher than those of WT. Trypan blue staining experiments showed that there were a large number of dead cells in the mutant lesion. Genetic analysis suggested that the phenotype of wy3 was controlled by a single recessive nuclear locus, and the target gene was mapped between markers W2-17 and W2-18 with the physical distance of 28 kb on chromosome 2. Sequence analysis revealed that the mutated gene in wy3 had a single nucleotide deletion at the 375th in CDS of LOC_Os02g02000, resulting in a premature termination of translation of the target gene, which is an new allele of OsHPL3.
Key words:rice; lesion mimic mutant; gene mapping
DOI:10.16819/j.1001-7216.2016.5176
收稿日期:2015-11-30; 修改稿收到日期: 2015-12-24。
基金项目:国家自然科学基金资助项目(31071384,31000533); 江苏省科技支撑计划资助项目(BE2013301);江苏高校优势学科建设工程资助项目。
中图分类号:Q343.5;Q754
文献标识码:A
文章编号:1001-7216(2016)03-0239-08
中国水稻科学(Chin J Rice Sci),2016,30(3):239-246
http://www.ricesci.cn
