不同温光条件下水稻抽穗期QTL的定位与分析
2016-06-16王军朱金燕周勇杨杰范方军李文奇王芳权仲维功梁国华
王军 朱金燕 周勇 杨杰 范方军 李文奇 王芳权 仲维功 梁国华,*
(1扬州大学 江苏省粮食作物现代产业技术协同创新中心/教育部植物功能基因组学重点实验室, 江苏 扬州 225009;2江苏省农业科学院 粮食作物研究所/国家水稻改良中心南京分中心, 南京 210014;*通讯联系人, E-mail: ricegb@yzu.edu.cn)
不同温光条件下水稻抽穗期QTL的定位与分析
王军1,2朱金燕2周勇1杨杰2范方军2李文奇2王芳权2仲维功2梁国华1,*
(1扬州大学 江苏省粮食作物现代产业技术协同创新中心/教育部植物功能基因组学重点实验室, 江苏 扬州 225009;2江苏省农业科学院 粮食作物研究所/国家水稻改良中心南京分中心, 南京 210014;*通讯联系人, E-mail: ricegb@yzu.edu.cn)
王军, 朱金燕, 周勇, 等. 不同温光条件下水稻抽穗期QTL的定位与分析. 中国水稻科学, 2016, 30(3): 247-255.
摘要:以广陆矮4号为受体,日本晴为供体的85个染色体单片段代换系群体为试验材料,通过单因素方差分析和Dunnett多重比较,测验单片段代换系与广陆矮4号之间抽穗期的差异,对代换片段上抽穗期相关的QTL进行了定位。以P≤0.001为阈值,在南京和海南不同温光条件下共定位到40个抽穗期相关的QTL。其中,21个QTL在2个环境中均被检测到;15个QTL只在南京环境中被检测到;4个QTL只在海南环境中被检测到。南京环境中定位到的36个抽穗期相关QTL,其加性效应值变化范围为2.8 d~15.7 d,加性效应百分率变化范围为3.8%~21.1%;海南环境中定位到的25个抽穗期相关QTL,加性效应值变化范围为1.8 d~12.1 d,加性效应百分率变化范围为1.7%~11.3%。这些QTL的定位,为进一步精细定位并克隆相应主效QTL和优异品种特定环境下的生育期改良奠定了基础。
关键词:水稻; 染色体单片段代换系; 数量性状基因座; 抽穗期; 代换作图
抽穗期是决定水稻品种对地域与季节适应性的重要农艺性状。水稻品种的抽穗期主要由品种的感光性、感温性和基本营养生长性所决定,感光性、感温性和基本营养生长性的强弱及其组合不同,导致了水稻抽穗期的多样性及其遗传表现的复杂性[1,2]。水稻抽穗期的遗传方式既有数量性状的遗传特点也有质量性状的遗传特点,不同品种表现出不同的遗传特点,即使同一品种的抽穗期也会由于温光条件的不同而表现出不同的遗传方式[3]。水稻品种的抽穗期的长短是 由其内在的遗传发育机制和外在的环境因素(光照和温度)共同决定的,这使得水稻抽穗期的遗传机制非常复杂。国内外的研究者通过不断研究,发现了许多抽穗期相关的位点,Gramene (http://www.gramene.org/)网站已公布的抽穗期相关QTL达到618个,分布于水稻全部12条染色体上,其中只有Hd1[4]、Hd3a[5]、Hd6[6]、Hd16[7]、Hd17[8]、Ehd1[9]、Ehd2[10]、Ehd3[11]、Ehd4[12]、Se5[13]、Ghd7[14]、Ghd7.1[15]、DTH2[16]、DTH8[17]等20多个抽穗期相关的基因(QTL)被克隆。主要原因是传统的定位群体(如F2/F3、BCl、DHs和RILs)内QTL之间存在较复杂的互作和个体间遗传背景的干扰,使对QTL的估计不准确,基因的精细定位和克隆就更困难。
染色体单片段代换系是利用分子标记辅助选择技术建立起来的一套近等基因系,与其受体亲本之间除代换片段存在差异外,其余部分均相同。通过比较染色体单片段代换系与其受体亲本之间以及不同株系之间的性状差异,就可以定位到置换片段上的QTL。染色体单片段代换系可以消除群体内遗传背景的干扰,将复杂性状分解为简单性状,已经成为复杂性状QTL精细定位与克隆的最主要群体。本研究以1套广陆矮4号为受体、日本晴为供体的染色体单片段代换系为材料,在南京和海南2个不同温光条件下对抽穗期相关QTL进行定位和分析,结果可为进一步精细定位并克隆相应的主效QTL和优异品种特定环境下的生育期改良提供理论依据。
1材料与方法
1.1供试材料
本实验室以粳稻品种日本晴为供体亲本,籼稻品种广陆矮4号为轮回亲本,在回交和自交过程中通过覆盖水稻全基因组的亲本间有多态性的260个分子标记检测(图2),筛选出一套染色体片段代换系(175个株系)。本研究利用其中85个染色体单片段代换系(CSSSLs)进行水稻抽穗期QTL的定位,这些代换片段分布于水稻的12条染色体上,覆盖了水稻全基因组的68.8%。结合各株系表型值及片段所在位置,采用代换作图法对相应抽穗期QTL进行定位。
1.2试验方法
2013年5月11日在江苏省农业科学院实验基地(南京,32oN)种植85个CSSSLs系及2个亲本,水稻生长季节平均日长约14 h/d,属于自然高温长日照;2013年12月25日在海南南繁基地(三亚,18o15′N),水稻生长季节平均日长约11.6 h/d,属于自然低温短日照。分别于2013年6月11日和2014年1月25日进行移栽,每个系栽4行,每行15株,行、株距分别为26.7 cm 和13.3 cm。2个环境下均种植对照,对照在田间均匀分布,每隔20个CSSSLs种植一个轮回亲本广陆矮4号作为对照小区,间比法顺序排列。选取每个小区中间2行的10株作为调查对象。在水稻刚开始抽穗的时候,调查每一株最早穗的见穗日期,每2d调查一次。抽穗期为从播种期到抽出第一个穗的天数。
1.3QTL分析
利用SPSS软件对各CSSSL和亲本抽穗期进行单因素方差分析,检测CSSSLs与受体亲本广陆矮4号之间差异的显著性,以α=0.001为阈值,即P≤0.001时认为代换片段上有相关QTL存在;当P>0.001时认为在该代换片段上没有相关QTL的存在[18]。
QTL 加性效应值的计算,参照Eshed 等[19]的方法估算各个QTL 的加性效应值及加性效应贡献率。
加性效应值=(CSSSL的表型值-广陆矮4号的表型值)/2;
加性效应百分率=(加性效应值/广陆矮4号的表型值)×100%。
QTL的命名依照McCouch[20]制定的原则。
1.4QTL代换作图
QTL作图方法参照Paterson等[21]的方法:如果在含有重叠代换片段的不同CSSSLs中同时定位到抽穗期的QTL,且遗传效应方向一致,则认为该QTL存在于代换片段的重叠区段上;如果在一个CSSSL中定位到QTL的存在,而在代换片段具有重叠关系的另一个CSSSL中未被定位到,则认为该QTL位于这两个CSSSLs代换片段的非重叠区段上。

图1染色体单片段代换系在不同环境中的抽穗期表型值分布
Fig. 1. Distribution of heading date of the Chromosome single segment substitution lines CSSSLs in the environments E1 and E2.
1.5代换片段长度的计算
按照Young等[22]的方法来确定代换片段的位置以及计算代换片段的长度,当CSSSL相邻标记的基因型表现都为供体亲本基因型时认为这两个相邻标记之间的区段为代换片段;当相邻标记的基因型分别为供体亲本和受体亲本时,认为两标记之间的一半区段来源于供体亲本,另一半则为受体亲本。本研究中不考虑相邻标记之间的双交换事件。
2结果与分析
2.1亲本及85个染色体单片段置换系的抽穗期
85个染色体单片段代换系在南京自然高温长日照(E1)和三亚自然低温短日照(E2)环境下的抽穗期分别为66.0~105.5 d、82.4~117.2 d;E1和E2环境中受体亲本广陆矮4号的抽穗期分别为75.8 d、105.0 d;E1和E2环境中供体亲本日本晴的抽穗期分别为91.3 d和90.8 d(图1-A、图1-B)。广陆矮4号的抽穗期在2个环境中的差异达到极显著水平(P=0.00);日本晴的抽穗期在2个环境中的差异未达显著水平(P=0.36)。
2.2抽穗期QTL分析
SPSS数据分析结果表明,2013年南京自然高温长日照(E1)和海南自然低温短日照(E2)环境下,85个染色体单片段代换系中,有53个系的抽穗期与受体亲本广陆矮4号存在极显著差异,共定位到40个抽穗期QTL,分布于水稻全部12条染色体上,其中,第6、11染色体上定位到的抽穗期QTL最多,均为5个。这些QTL中,21个QTL在2个环境中都被定位到;15个QTL只能在E1环境中被定位到;4个QTL只能在E2环境中被定位到。
在E1环境中能够被定位到的36个QTL中,与广陆矮4号相比13个QTL的加性效应表现为减效作用,加性效应值为2.8 d~6.0 d,加性效应百分率为3.8%~7.9%;23个QTL的加性效应表现为增效作用,其加性效应值的变化范围为3.8 d~15.7 d,加性效应百分率的变化范围为4.9%~21.1%(表1)。
在E2环境中能够被定位到的25个QTL中,与广陆矮4号相比22个QTL的加性效应表现为减效作用,加性效应值为1.8 d~12.1 d,加性效应百分率为1.7%~11.3%;3个QTL的加性效应表现为增效作用,其加性效应值的变化范围为3.1 d~7.0 d,加性效应百分率的变化范围为3.0%~6.8%(表1)。
2.3抽穗期QTL的代换作图
表1不同环境中染色体单片段代换系抽穗期QTL及其效应
Table 1. Detection of the QTL and their additive effects for heading date in various CSSSLs in various environments.
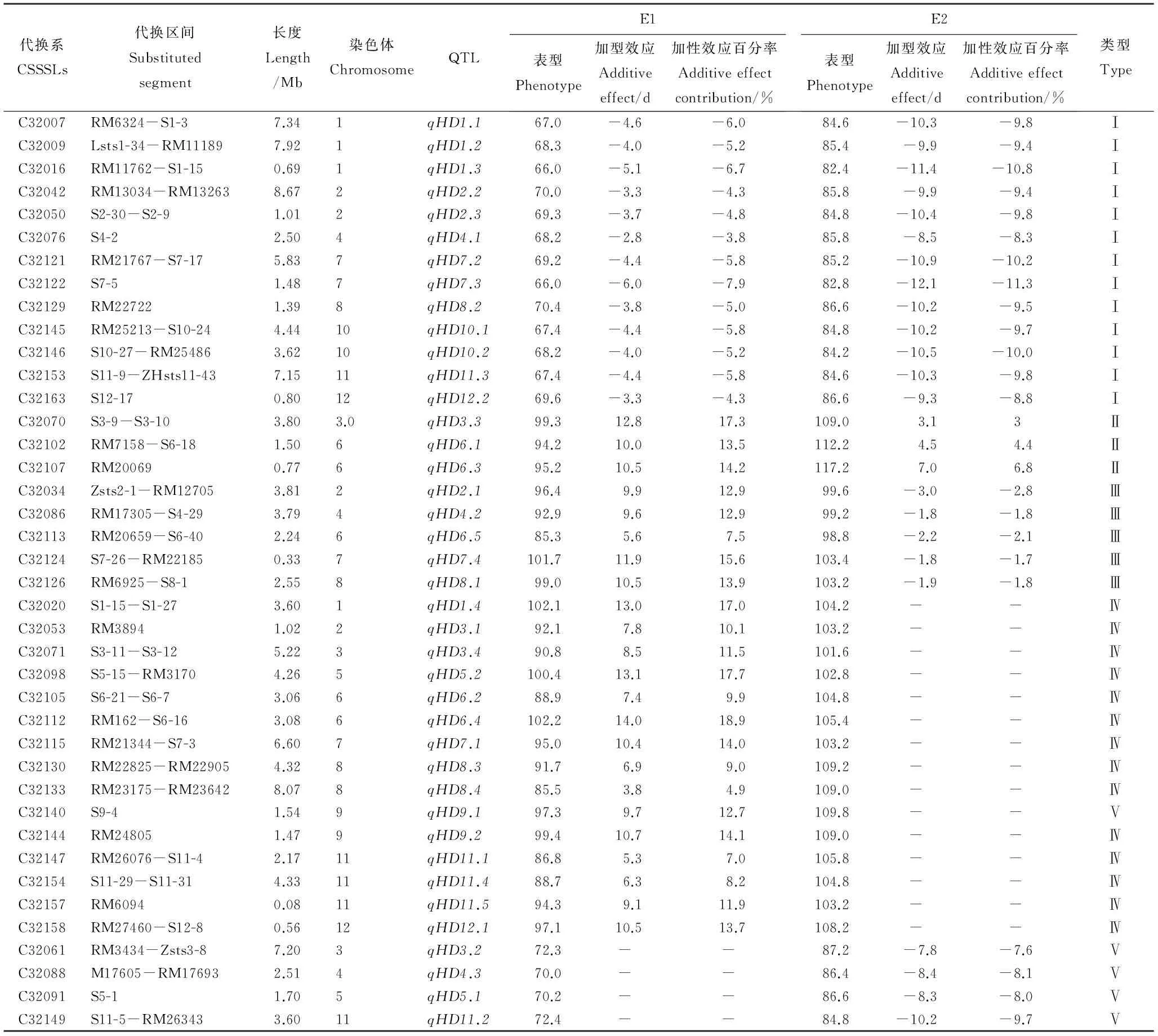
代换系CSSSLs代换区间Substitutedsegment长度Length/Mb染色体ChromosomeQTLE1表型Phenotype加型效应Additiveeffect/d加性效应百分率Additiveeffectcontribution/%E2表型Phenotype加型效应Additiveeffect/d加性效应百分率Additiveeffectcontribution/%类型TypeC32007RM6324-S1-37.341qHD1.167.0-4.6-6.084.6-10.3-9.8ⅠC32009Lsts1-34-RM111897.921qHD1.268.3-4.0-5.285.4-9.9-9.4ⅠC32016RM11762-S1-150.691qHD1.366.0-5.1-6.782.4-11.4-10.8ⅠC32042RM13034-RM132638.672qHD2.270.0-3.3-4.385.8-9.9-9.4ⅠC32050S2-30-S2-91.012qHD2.369.3-3.7-4.884.8-10.4-9.8ⅠC32076S4-22.504qHD4.168.2-2.8-3.885.8-8.5-8.3ⅠC32121RM21767-S7-175.837qHD7.269.2-4.4-5.885.2-10.9-10.2ⅠC32122S7-51.487qHD7.366.0-6.0-7.982.8-12.1-11.3ⅠC32129RM227221.398qHD8.270.4-3.8-5.086.6-10.2-9.5ⅠC32145RM25213-S10-244.4410qHD10.167.4-4.4-5.884.8-10.2-9.7ⅠC32146S10-27-RM254863.6210qHD10.268.2-4.0-5.284.2-10.5-10.0ⅠC32153S11-9-ZHsts11-437.1511qHD11.367.4-4.4-5.884.6-10.3-9.8ⅠC32163S12-170.8012qHD12.269.6-3.3-4.386.6-9.3-8.8ⅠC32070S3-9-S3-103.803.0qHD3.399.312.817.3109.03.13ⅡC32102RM7158-S6-181.506qHD6.194.210.013.5112.24.54.4ⅡC32107RM200690.776qHD6.395.210.514.2117.27.06.8ⅡC32034Zsts2-1-RM127053.812qHD2.196.49.912.999.6-3.0-2.8ⅢC32086RM17305-S4-293.794qHD4.292.99.612.999.2-1.8-1.8ⅢC32113RM20659-S6-402.246qHD6.585.35.67.598.8-2.2-2.1ⅢC32124S7-26-RM221850.337qHD7.4101.711.915.6103.4-1.8-1.7ⅢC32126RM6925-S8-12.558qHD8.199.010.513.9103.2-1.9-1.8ⅢC32020S1-15-S1-273.601qHD1.4102.113.017.0104.2--ⅣC32053RM38941.022qHD3.192.17.810.1103.2--ⅣC32071S3-11-S3-125.223qHD3.490.88.511.5101.6--ⅣC32098S5-15-RM31704.265qHD5.2100.413.117.7102.8--ⅣC32105S6-21-S6-73.066qHD6.288.97.49.9104.8--ⅣC32112RM162-S6-163.086qHD6.4102.214.018.9105.4--ⅣC32115RM21344-S7-36.607qHD7.195.010.414.0103.2--ⅣC32130RM22825-RM229054.328qHD8.391.76.99.0109.2--ⅣC32133RM23175-RM236428.078qHD8.485.53.84.9109.0--ⅣC32140S9-41.549qHD9.197.39.712.7109.8--ⅤC32144RM248051.479qHD9.299.410.714.1109.0--ⅣC32147RM26076-S11-42.1711qHD11.186.85.37.0105.8--ⅣC32154S11-29-S11-314.3311qHD11.488.76.38.2104.8--ⅣC32157RM60940.0811qHD11.594.39.111.9103.2--ⅣC32158RM27460-S12-80.5612qHD12.197.110.513.7108.2--ⅣC32061RM3434-Zsts3-87.203qHD3.272.3--87.2-7.8-7.6ⅤC32088M17605-RM176932.514qHD4.370.0--86.4-8.4-8.1ⅤC32091S5-11.705qHD5.170.2--86.6-8.3-8.0ⅤC32149S11-5-RM263433.6011qHD11.272.4--84.8-10.2-9.7Ⅴ
E1, 南京; E2, 三亚。下同。
E1, Nanjing; E2, Sanya. The same as below.
对本研究中定位到的的40个抽穗期QTL进行重叠片段分析,其中有13个QTL在2个染色体单片段代换系中同时定位到,另外27个QTL均在1个染色体单片段代换系中定位到。qHD1.3在C32015、C32016中同时被定位到,而在具有重叠片段的C32014中未被定位到,因此,qHD1.3被定位于C32015、C32016的重叠区段S1-9上,长度约为0.69 Mb(图2-A);qHD2.1在C32034、C32038中被同时定位到,因此qHD2.1被定位在区段RM12521-RM12705上,长度约为3.81 Mb(图2-B);qHD2.3在C32045、C32050中被同时定位到,因此,qHD2.3被定位在区段S2-30-S2-32上,长度约为1.01 Mb(图2-B);qHD3.1在C32053、C32057中被同时定位到,因此qHD3.1被定位在RM3894上,长度约为1.02 Mb(图2-C);qHD4.2在C32086、C32087中被同时定位到,因此qHD4.2被定位在区段RM17305-S4-29上,长度约为3.79 Mb(图2-D);qHD5.1在C32091、C32092中被同时定位到,因此qHD5.1被定位在S5-1上,长度约为1.7 Mb(图2-E);qHD5.2在C32098、C32099中被同时定位到,因此qHD5.2被定位在区段S5-15-RM3170上,长度约为4.26 Mb(图2-E);qHD6.4在C32105中定位到,而在具有重叠片段的C32110中未定位到,因此qHD6.4被定位于非重叠区段S6-37-S6-16上,长度约为3.08 Mb(图2-F);qHD7.1在C32115、C32118中被同时定位到,因此qHD7.1被定位在区段RM21334-S7-3上,长度约为6.60 Mb(图2-G);qHD7.4在C32124、C32125中被同时定位到,因此,qHD7.4被定位在RM22185上,长度约为0.33 Mb(图2-G);qHD8.1

粗黑线段为供体的代换片段,QTLs位于两条竖线之间。
The substituted segments are represented by horizontal dark bars. The regions to which the substituted segments best map QTLs are shown by two vertical dotted lines.
图2水稻抽穗期QTL的代换作图
Fig. 2. Substitution mapping of QTLs for the heading date in rice.
在C32126中定位到,而在具有重叠片段的C32128中未定位到,因此qHD8.1被定位于非重叠区段RM6925-S8-40上,长度约为2.55 Mb(图2-H);qHD9.2在C32142、C32144中被同时定位到,因此qHD9.2被定位在RM24805上,长度约为1.47 Mb(图2-I);qHD11.2在C32148、C32149中被同时定位到,因此qHD11.2被定位在区段S11-5-RM26343上,长度约为3.60 Mb(图2-J);qHD11.5在C32155、C32157中被同时定位到,因此qHD11.5被定位在RM6094上,长度约为0.08 Mb(图2-J);qHD12.1在C32158、C32159中被同时定位到,因此qHD12.1被定位在S12-8上,长度约为0.56 Mb(图2-K)。
3讨论
染色体单片段代换系是指与受体亲本相比,只含有1个供体亲本代换片段的近等基因系。染色体单片段代换系不仅消除了遗传背景的干扰,同时可以把复杂的数量性状分解为单一的孟德尔因子,已被广泛用于QTL的定位与克隆中[23-25]。在利用染色体片段代换系进行抽穗期QTL定位研究方面,Shen等[26]利用1套Zhenshan 97为受体,Minghui 63为供体的染色体片段代换系定位了12个抽穗期相关的QTL,分布在除了第5、10染色体外的其余10条染色体上。何凤华等[27]以华粳籼74为受体,6个水稻品种为供体的52个单片段代换系鉴定出20个抽穗期QTL,这些 QTL分布于水稻除第5、第6染色体外的10条染色体上。杨德卫等[28]利用9311为受体,日本晴为供体构建的94个染色体片段置换系定位了4个控制水稻抽穗期的QTL, 分别位于第3、第4、第5和第8染色体。周勇等[29]利用染色体单片段代换系及其衍生群体将qHd8.1精细定位在第8染色体上的S8111和S849之间约59.9 kb的物理区间内。
本研究以广陆矮4号为受体,日本晴为供体的85个染色体单片段代换系在南京和三亚2个不同温光环境下进行抽穗期相关QTL的定位,共检测到40个抽穗期相关的主效QTL,其单个QTL对表型的加性效应百分率变异范围为1.7%~21.1%。与前人已经报道的抽穗期QTL在染色体上的位置进行比较,部分QTL与前人研究结果相同或相近。qHD1.1与何凤华等[27]定位的抽穗期QTLqHD-1-1、张永生等[30]定位的抽穗期QTLqHd-1-1在相同的染色体区段上;qHD1.3与何凤华等[27]定位的抽穗期QTLqHd-1-2、Shen等[26]定位的抽穗期QTLQHD1在相同的染色体区段上;qHD2.1与何凤华等[27]定位的抽穗期QTLqHd-2-2在相同的染色体区段上;qHD2.2与Cheng等[31]定位的抽穗期QTLqHd2在相同的染色体区段上;qHD2.3与何凤华等[27]定位的抽穗期QTLqHd-2-3在相同的染色体区段上;qHD3.1与Lee等[32]定位的抽穗期QTLqHD3.1在相同的染色体区段上;qHD3.2与张永生等[30]定位的抽穗期QTLqHd-3在相同的染色体区段上;qHD3.4与何凤华等[27]定位的抽穗期QTLqHD-3-3、杨德卫等[28]定位的抽穗期QTLqHd-3、曾晶等[33]定位的抽穗期QTLqhd3a、邵迪等[34]定位的抽穗期QTLqHd-3在相同的染色体区段上;qHD4.1与冯跃等[35]定位的抽穗期QTLqHD-4a在相同的染色体区段上;qHD4.2与何凤华等[27]定位的抽穗期QTLqHD-4、Cheng等[31]定位的抽穗期QTLqHD4b在相同的染色体区段上;qHD4.3与杨德卫等[28]定位的抽穗期QTLqHD-4、Wang等[36]定位的抽穗期QTLqHD4.1在相同的染色体区段上;qHD6.1与张永生等[30]定位的抽穗期QTL qHd-6-2、曾晶等[33]定位的抽穗期QTLqhd6、冯跃等[35]定位的抽穗期QTLqHD-6b在相同的染色体区段上;qHD6.2与Shen等[26]定位的抽穗期QTLQHD6、Cheng等[31]定位的抽穗期QTLQHd6a、冯跃等[35]定位的抽穗期QTLqHD-6a在相同的染色体区段上;qHD7.1与Shen等[26]定位的抽穗期QTLqHD7.2、张永生等[30]定位的抽穗期QTLqHd-7-3、Cheng等[31]定位的抽穗期QTLqHD7、Lee等[32]定位的抽穗期QTLqHD7.1在相同的染色体区段上;qHD7.2与Shen等[26]定位的抽穗期QTL qHD7.3、何凤华等[27]定位的抽穗期QTLqHD-7、曾晶等[33]定位的抽穗期QTLqhd7a在相同的染色体区段上;qHD7.4与Lee等[32]定位的抽穗期QTLqHD7.2、曾晶等[33]定位的抽穗期QTLqhd7b在相同的染色体区段上;qHD8.1与何凤华等[27]定位的抽穗期QTLqHD-8-1、张永生等[30]定位的抽穗期QTLqHd-8、Pei等[37]定位的抽穗期QTLqHD8.1在相同或位置相近的染色体区段上;qHD8.4与Shen等[26]定位的抽穗期QTLqHD8、何凤华等[27]定位的抽穗期QTLqHD-8-2、Lee等[32]定位的抽穗期QTLqHD8.2在相同的染色体区段上;qHD9.2与何凤华等[27]定位的抽穗期QTLqHD-9-2、曾晶等[33]定位的抽穗期QTLqhd9在相同的染色体区段上;qHD10.2与张永生等[30]定位的抽穗期QTLqHd-10、Lee等[32]定位的抽穗期QTLqHD10.1在相同或位置相近的染色体区段上;qHD11.1与Shen等[26]定位的抽穗期QTLqHD11在染色体上位置相近。

染色体右侧为分子标记名称, 左侧数字代表物理位置(单位Mb)。黑色区段显示19个新抽穗期相关QTL所在的位置范围, 灰色区段显示与前人研究具有相同区段的21个抽穗期相关QTL所在的位置。
The molecular markers are indicated in the right side, and the physical locations (Mb) of each marker are indicated in the left side. The regions of 19 newly detected QTLs for heading date are shown in black, and the regions of the other 21 QTLs which share the same regions with the previously detected QTLs are shown in gray.
图3多态性标记的物理位置及40个抽穗期QTL在水稻12条染色体上的分布
Fig. 3. Physical locations of polymorphic markers and the distribution of 40 QTLs for heading date on 12 rice chromosomes.
与已经克隆的抽穗期QTL进行比较发现,qHD3.1定位区段内含有抽穗期QTLDTH3;qHD3.4定位区段内含有抽穗期QTLHd6、Hd16;qHD6.1定位区段内含有抽穗期QTLHd3a;qHD7.4定位区段内含有抽穗期QTLGhd7.1;qHD10.2定位区段内含有抽穗期QTLEhd2。本研究中定位出的其他的抽穗期相关的QTL尚未见报道(图3)。本研究定位的40个抽穗期QTL中有13个QTL在3个以上的不同群体中都被定位到,其中qHD3.4和qHD7.1在5个不同群体中被定位;4个QTL定位区间内含有5个已经克隆的抽穗期QTL。这一方面说明这些QTL的稳定性,同时也进一步证明染色体单片段代换系是定位和克隆复杂性状QTL的理想材料。
本研究中定位到的40个抽穗期相关的QTL可以分为5种类型(表1):Ⅰ类包括13个QTL,这些QTL在南京自然高温长日照环境(E1)下促进广陆矮4号提早抽穗,在三亚自然低温短日照环境(E2)下也促进广陆矮4号提早抽穗;Ⅱ类包括3个QTL,这些QTL在E1环境下抑制广陆矮4号延迟抽穗,在E2环境下也抑制广陆矮4号延迟抽穗;Ⅲ类包括5个QTL,这些QTL在E1环境下抑制广陆矮4号延迟抽穗,在E2环境下促进广陆矮4号提早抽穗;Ⅳ类包括15个QTL,这些QTL只在E1环境中被定位到,表现为抑制广陆矮4号延迟抽穗;Ⅴ类包括4个QTL,这些QTL只在E2环境中被定位到,表现为促进广陆矮4号提早抽穗。这为进一步研究这些QTL的功能以及利用这些QTL选育适宜生育期的水稻新品种提供理论依据。
参考文献:
[1] Chang T T, Li C C, Vergara B S. Component analysis of duration from seeding to heading in rice by the basic vegetative phase and the photoperiod-sensitive phase.Euphytica, 1969, 18(1): 79-91.
[2] Tsai K H.Gene loci and alleles controlling the duration of basic vegetative growth of rice.RiceGenet, 1986, 5(6): 339-349.
[3] 胡时开, 苏岩, 叶卫军, 等. 水稻抽穗期遗传与分子调控机理研究进展. 中国水稻科学, 2012, 26(3): 373-382.
Hu S K, Su Y, Ye W J, et al. Advances in genetic analysis and molecular regulation mechanism of heading date in rice (OryzasativaL.).ChinJRiceSci, 2012, 26(3): 189-196. (in Chinese with English abstract)
[4] Yano M, Katayose Y, Ashikari M, et al.Hd1, a major photoperiod sensitivity quantitative trait locus in rice, is closely related to the arabidopsis flowering time gene constans.PlantCell, 2000, 12(12): 2473-2483.
[5] Itoh H, Nonoue Y, Yano M, et al. A pair of floral regulators sets critical day length forHd3aflorigen expression in rice.NatGenet, 2010, 42(7): 635-638.
[6] Takahashi Y, Shomura A, Sasaki T, et al.Hd6, a rice quantitative trait locus involved in photoperiod sensitivity, encodes the a subunit of protein kinase CK2.ProcNatlAcadSciUSA, 2001, 98(14): 7922-7927.
[7] Hori K, Ogiso-Tanaka E, Matsubara K, et al.Hd16, a gene for casein kinase I, is involved in the control of rice flowering time by modulating the day-length response.PlantJ, 2013, 76(1): 36-46.
[8] Matsubara K, Ogiso-Tanaka E, Hori K, et al. Natural variation inHd17, a homolog of arabidopsis ELF3 that is involved in rice photoperiodic flowering.PlantCellPhysiol, 2012, 53(4): 709-716.
[9] Doi K, Izawa T, Fuse T, et al.Ehd1, a B-type response regulator in rice, confers short-day promotion of flowering and controls FT-like gene expression independently ofHd.GenesDev, 2004, 18(8): 926-936.
[10]Matsubara K, Yamanouchi U, Wang Z X, et al.Ehd2, a rice ortholog of the maizeINDETERMINATE1 gene, promotes flowering by up-regulatingEhd.PlantPhysiol, 2008, 148(3): 1425-1435.
[11]Matsubara K, Yamanouchi U, Nonoue Y, et al.Ehd3, encoding a plant homeodomain finger-containing protein, is a critical promoter of rice flowering.PlantJ, 2011, 66(4): 603-612.
[12]Gao H, Zheng X M, Fei G , et al.Ehd4 encodes a novel and Oryza-genus-specific regulator of hotoperiodic flowering in rice.PLoSGenet, 2013, 9(2): e1003281.
[13]Andrés F, Galbraith D W, Talón M, et al. Analysis of photoperiod sensitivity sheds light on the role of phytochromes in photoperiodic flowering in rice.PlantPhysiol, 2009, 151(2): 681-690.
[14]Xue W Y, Xing Y Z, Weng X Y, et al. Natural variation inGhd7 is an important regulator of heading date and yield potential in rice.NatGenet, 2008, 40(6): 761-767.
[15]Yan W H, Liu H Y, Zhou X C, et al. Natural variation inGhd7.1 plays an important role in grain yield and adaptation in rice.CellRes, 2013, 23(7): 969-971.
[16]Wu W X, Zheng X M, Lu G W, et al. Association of functional nucleotide polymorphisms atDTH2 with the northward expansion of rice cultivation in Asia.ProcNatlAcadSciUSA, 2013, 110(8): 2775-2780.
[17]Wei X J, Xu J F, Guo H N, et al.DTH8 Suppresses flowering in rice, influencing plant height and yield potential simultaneously.PlantPhysiol, 2010, 153(4): 1747-1758.
[18]刘冠明, 李文涛, 曾瑞珍, 等. 水稻单片段代换系代换片段的QTL鉴定. 遗传学报, 2004, 31(12): 1395-1400.
Liu G M, Li W T, Zeng R Z, et al. Identification of QTLs on substituted segments in single segment substitution lines of rice.JGenetGenom, 2004, 31(12): 1395-1400. (in Chinese with English abstract)
[19]Eshed Y, Zamir D. An introgression line population of Lycopersicon pennellii in the cultivated tomato enables the identification and fine mapping of yield-associated QTL.Genetics, 1995, 141(3): 1147-1162.
[20]McCouch S R,CGSNL.Gene nomenclature system for rice.Rice,2008,1(1): 72-84.
[21]Paterson A H, Deverna J W, Lanini B, et al. Fine mapping of quantitative trait loci using selected overlapping recombinant chromosomes in an interspecies cross of tomato.Genetics, 1990, 124(3): 735-742.
[22]Young N D, Tanksley S D. Restriction fragment length polymorphism maps and the concept of graphical genotypes.TheorApplGenet, 1989, 77(1): 95-101.
[23]Xu J J, Zhao Q, Du P N, et al. Developing high throughput genotyped chromosome segment substitution lines based on population whole-genome re-sequencing in rice (OryzasativaL.).BMCGenom, 2010, 24(11): 656-669.
[24]Shomura A, Izawa T, Ebana K, et al. Deletion in a gene associated with grain size increased yields during rice domestication.NatGenet, 2008, 40(8): 1023-1028.
[25]Li Y B, Fan C C, Xing Y Z, et al. Natural variation inGS5 plays an important role in regulating grain size and yield in rice.NatGenet, 2011, 43(12): 1266-1269.
[26]Shen G J, Xing Y Z. Two novel QTLs for heading date are identified using a set of chromosome segment substitution lines in rice (OryzasativaL.).JGenetGenom, 2014, 41(12): 659-662.
[27]何风华, 席章营, 曾瑞珍, 等. 利用单片段代换系定位水稻抽穗期QTL. 中国农业科学, 2005, 38(8): 1505-1513.
He F H, Xi Z Y, Zeng R Z, et al. Mapping of heading date QTLs in rice (OryzasativaL.) using single segment substitution lines.SciAgricSin, 2005, 38(8): 1505-1513. (in Chinese with English abstract)
[28]杨德卫, 张亚东, 朱镇, 等. 基于CSSL的水稻抽穗期QTL定位及遗传分析. 植物学报, 2010, 45 (2): 189-197.
Yang D W, Zhang Y D, Zhu Z, et al. Mapping and genetic analysis of quantitative trait loci for heading date with chromosome segment substitution lines inOryzasativa.ChinBullBot, 2010, 45(2): 189-197. (in Chinese with English abstract)
[29]周勇, 崔国昆, 张言周, 等. 水稻抽穗期主效QTLqHd8.1的精细定位. 中国水稻科学, 2012, 26(1): 43-48.
Zhou Y, Cui G K, Zhang Y Z, et al. Fine mapping of a major QTLqHd8.1 for heading date in rice.ChinJRiceSci, 2012, 26(1): 43-48. (in Chinese with English abstract)
[30]张永生, 江玲, 刘喜, 等. 控制水稻品种Koshihikari 抽穗期的数量性状位点. 作物学报, 2008, 34(11): 1869-1876.
Zhang Y S, Jiang L, Liu X, et al. Quantitative trait loci for rice heading time in Koshihikari.ActaAgronSin, 2008, 34(11): 1869-1876. (in Chinese with English abstract)
[31]Cheng L R, Wang J M, Ye G Y, et al. Identification of stably expressed QTL for heading date using eciprocal introgression line and recombinant inbred line populations in rice.GenetRes(Camb), 2012, 94(5): 245-253.
[32]Lee S, Jia M H, Jia Y L, et al. Tagging quantitative trait loci for heading date and plant height in important breeding parents of rice (Oryzasativa).Euphytica, 2014, 197(2): 191-200.
[33]曾晶, 姜恭好, 何予卿, 等. 利用籼粳交探讨水稻株高和抽穗期的遗传基础. 分子植物育种, 2006, 4(4): 527-534.
Zeng J, Jiang G H, He Y Q, et al. The genetic bases analysis of plant height and heading date in Indica/Japonica hybrids.MolPlantBreeding, 2006, 4(4): 527-534. (in Chinese with English abstract)
[34]邵迪, 李秋萍, 吴比, 等. 利用染色体片段代换系定位水稻主效抽穗期QTL. 湖南农业大学学报: 自然科学版: 2009, 35(4): 344-347.
Shao D, Li Q P, Wu B, et al. Mapping of a major QTL for heading date in rice using chromosome segment substitution lines.JHunanAgricUniv:NatSci, 2009, 35(4): 344-347. (in Chinese with English abstract)
[35]冯跃, 翟荣荣, 曹立勇, 等. 不同施氮水平下水稻株高与抽穗期的QTL比较分析. 作物学报, 2011, 37(9): 1525-1532.
Feng Y, Zhai R R, Cao L Y, et al. QTL analysis for plant height and heading date in rice under two nitrogen levels.ActaAgronSin, 2011, 37(9): 1525-1532. (in Chinese with English abstract)
[36]Wang B B, Zhu C X, Liu X, et al. Fine mapping ofqHD4-1, a QTL controlling the heading date, to a 20.7-kb DNA fragment in rice (OryzasativaL.).PlantMolBiolRep, 2011, 29(3): 702-713.
[37]Pei C G, Liu X, Wang W Y, et al. Fine mapping ofqHD8-1, a QTL controlling the heading date, to a 26-kb DNA fragment in rice (OryzasativaL.).JPlantBiol, 2011, 54(3): 190-198.
QTL Analysis for Heading Date in Rice (OryzasativaL.) Under Different Temperatures and Light Intensities
WANG Jun1,2, ZHU Jin-yan2, ZHOU Yong1, YANG Jie2, FAN Fang-jun2, LI Wen-qi2, WANG Fang-quan2,ZHONG Wei-gong2, LIANG Guo-hua1,*
(1Key Laboratory of Plant Function Genomics, Ministry of Education, Yangzhou University/Jiangsu Co-Innovation Center for Modern Production Technology of Grain Crops, Yangzhou 225009, China;2Institute of Food Crops, Jiangsu Academy of Agricultural Sciences/Nanjing Branch of Chinese National Center for Rice Improvement, Nanjing 210014, China;*Corresponding author, E-mail: ricegb@yzu.edu.cn)
WANG Jun, ZHU Jinyan, ZHOU Yong, et al. QTL analysis for heading date in rice (OryzasativaL.) under different temperatures and light intensities. Chin J Rice Sci, 2016, 30(3): 247-255.
Abstract:QTLs for heading date were identified with 85 rice chromosome single segment substitution lines (CSSSLs) derived from Nipponbare as donor parent in the background of Guanglu’ai 4, for means comparisons between CSSSLs and the recipient parent Guanglu’ai 4 by one-way analysis of variance and Dunnett’s test. A total of 40 QTLs for heading date were identified on all 12 chromosomes under two different temperatures and light intensities with a significance of P≤0.001. Twenty-one QTLs for heading date were mapped in the two environments, 15 QTLs only in Nanjing, and four only in Sanya. Thirty-six QTLs were mapped in Nanjing, the additive effects of which ranged from 2.8 d to 15.7 d, the additive effect percentages from 3.8% to 21.1%; 25 QTLs were mapped in Sanya, the additive effect of which ranged from 1.8 to 12.1 d, the additive effect percentages from 1.7% to 11.3%. The results are important for the QTLs cloning and breeding of new high-quality rice variety in different environments.
Key words:rice; chromosome single segment substitution lines; quantitative trait loci; heading date; substitution mapping
DOI:10.16819/j.1001-7216.2016.5172
收稿日期:2015-11-18; 修改稿收到日期: 2016-01-07。
基金项目:国家973计划资助项目(2013CBA01405); 国家科技支撑计划重大项目(2011BAD16B03); 江苏省农业自主创新资金资助项目[CX(12)1003]; 江苏省科技厅重点研发计划资助项目(BE2015341); 研究生科研创新计划资助项目(CXZZ12-0906)。
中图分类号:Q343.1+5;S511.01
文献标识码:A
文章编号:1001-7216(2016)03-0247-09
中国水稻科学(Chin J Rice Sci),2016,30(3):247-255
http://www.ricesci.cn
