氮肥对水稻节间和叶鞘非结构性碳水化合物积累转运特征的影响
2016-06-16潘俊峰王博崔克辉黄见良聂立孝
潘俊峰 王博 崔克辉 黄见良 聂立孝
(1广东省农业科学院 水稻研究所, 广州 510640; 2主要粮食作物产业化湖北省协同创新中心,湖北 荆州 434025;3作物遗传改良国家重点实验室/农业部长江中游作物生理生态与耕作重点实验室/华中农业大学 植物科技学院, 武汉 430070;#共同第一作者;*通讯联系人, E-mail: cuikehui@mail.hzau.edu.cn)
氮肥对水稻节间和叶鞘非结构性碳水化合物积累转运特征的影响
潘俊峰1,3,#王博3,#崔克辉2,3,*黄见良2,3聂立孝2,3
(1广东省农业科学院 水稻研究所, 广州 510640;2主要粮食作物产业化湖北省协同创新中心,湖北 荆州 434025;3作物遗传改良国家重点实验室/农业部长江中游作物生理生态与耕作重点实验室/华中农业大学 植物科技学院, 武汉 430070;#共同第一作者;*通讯联系人, E-mail: cuikehui@mail.hzau.edu.cn)
潘俊峰, 王博, 崔克辉, 等. 氮肥对水稻节间和叶鞘非结构性碳水化合物积累转运特征的影响. 中国水稻科学, 2016, 30(3): 273-282.
摘要:以两优培九和扬稻6号为材料进行盆栽试验,研究低氮(N1)和高氮(N2)处理下水稻主茎上部3个节间和叶鞘非结构性碳水化合物(NSC)的积累转运特征及对氮肥用量的响应。结果表明:1)与N2处理相比,N1处理总体上显著促进灌浆早期两优培九倒2、倒3节间和叶鞘NSC的转运,对扬稻6号的影响差异不明显;N1处理显著增加了扬稻6号上部3个节间及叶鞘和两优培九倒3节间及叶鞘NSC表观转运量,也增加了两品种上部3个节间及叶鞘的NSC(总)表观贡献率。2) 两个氮肥处理下,供试品种的叶鞘(两优培九倒3叶鞘除外)NSC转运量和表观贡献率大于节间。3)两优培九倒2、倒3节间及叶鞘NSC表观转运量和贡献率、上部3节间及叶鞘的NSC总转运量与总表观贡献率在两个氮肥处理下均高于扬稻6号。4)N1处理下,两优培九和扬稻6号倒2、倒3节间及叶鞘的转运量分别占总转运量的92%和75%,贡献率分别占91%和76%;而N2处理下两优培九倒2、倒3节间及叶鞘的转运量占90%,扬稻6号倒2、倒3节间则无输出。本研究表明水稻上部3个节间和叶鞘的NSC (总)转运量品种间存在差异,并受施氮量和节/叶位的影响。在水稻高产和减氮栽培中,通过选用适宜品种和优化氮肥管理,增加花前茎鞘NSC积累和花后NSC再分配,对提高水稻产量潜力和氮效率,特别是对花后逆境和减氮条件下产量稳定具有重要意义。
关键词:水稻; 氮肥; 节间和叶鞘; 非结构性碳水化合物; 产量形成
水稻籽粒的灌浆物质主要来源于抽穗后的光合产物和抽穗前积累在茎鞘中的非结构性碳水化合物(non-structural carbohydrate, NSC)。研究发现,随着水稻库容量的增加,抽穗前茎鞘临时储藏的NSC对产量的表观贡献随之增加,其对最终籽粒产量的贡献最高可达30%[1-3]。另外,水稻抽穗期和灌浆期茎鞘NSC对促进库活性和增加水稻的抗倒伏能力密切相关[4-6]。
水稻茎鞘NSC主要包括淀粉、蔗糖和己糖等[7,8]。不同节间和叶鞘NSC含量存在明显差异,剑叶鞘中蔗糖和己糖含量较高,而倒2叶鞘中淀粉含量较高,倒2叶鞘从叶枕至叶鞘基部淀粉的含量呈增加趋势[9];Isopp等[10]认为黑麦草(Loliumperenne)剑叶鞘蔗糖和己糖含量较高,可能作为短期贮存物质;小麦倒2叶鞘中贮存较多淀粉,可能作为较长期的贮藏物质[11];水稻倒3叶鞘贮藏较多淀粉,并且大多数淀粉分布于叶鞘基部[8]。前人的研究多关注节间和叶鞘NSC储藏类型和积累特征,而灌浆结实期间不同节间NSC的转运特征还少有研究。
氮素作为植物生长发育所必需的营养元素,对水稻主要农艺性状、茎鞘NSC积累转运特征的影响已有报道。Pan 等在水稻重组自交系中发现正常供氮下茎鞘NSC对籽粒产量形成的贡献率为1%~15%,在低氮条件下为1%~28%,且茎鞘NSC表观转运量比正常供氮下提高31%[2]。最近研究发现,水稻抽穗后叶鞘淀粉的降解存在显著的品种间差异[12]。可见,茎鞘NSC的转运表现出基因型变化,同时也受到氮肥用量的影响。前人的研究主要关注地上部茎鞘NSC积累转运及其对产量的贡献、与植株抗倒伏能力的关系等方面[6,13]。关于水稻不同节间和叶鞘NSC积累转运对产量贡献大小,目前仍未见报道。本研究以两优培九和扬稻 6 号为材料,在两个施氮量下研究抽穗灌浆期上部3个节间和叶鞘中NSC含量的变化动态及其对产量贡献,旨在为水稻高产栽培、氮肥减施稳产、高产高效品种选育提供理论依据。
1材料与方法
1.1材料与设计
试验于2009-2010年在华中农业大学盆栽场大棚中进行。供试水稻品种为两系高产杂交籼稻两优培九(LYP9)和常规籼稻扬稻6号(YD6)。试验所用土壤取自华中农业大学农场贫瘠土,土壤主要特征如下:pH 5.95,全氮0.64 g/kg,速效磷3.34 mg/kg,速效钾60.95 mg/kg,有机质4.63 g/kg。盆栽时每钵装风干土12.5 kg。试验设两个氮肥处理,每钵分别施用尿素0.724 g(低氮,N1)与2.898 g(高氮,N2),分别相当于50和200 kg/hm2(以纯N计)的大田施肥量[14]。氮肥分3次施用,其中40%为基肥,分蘖期追肥占30%,幼穗分化期追肥占30%。每钵过磷酸钙4.241 g,氯化钾1.116 g,硫酸锌0.123 g,均作为基肥施入。秧田常规湿润育秧,每钵移栽同一品种幼苗3株,重复3次(每个重复12钵)。移栽后土壤表面保持3~5 cm水层,成熟收获前3d停止灌水。施肥后3d内遇阴雨天气提前关闭大棚,防止肥料流失;精细管理并全程防治病虫害,成熟期挂防鸟网避免产量损失。
1.2取样
标记所有生育进程一致的主茎。主茎见穗当天进行第一次取样,以后每隔7d取一次样,每次取3个主茎(分别从3钵中选取),直至成熟。两优培九共取样5次,扬稻6号共取样4次。取样时将主茎从基部剪下,在茎节点处将各节间与叶鞘剥离(共6部分,倒1、倒2、倒3叶鞘及倒1、倒2、倒3节间),并在各取样时期取样测定主茎顶部3片叶的绿叶面积(Li-COR3100,USA)。沿枯黄与绿叶边缘将枯黄部分剪掉,仅测定绿色部分叶片面积(cm2/茎)。节间和叶鞘于100℃下杀青30min,80℃下烘72h,称重并粉碎过100目筛,样品用于非结构性碳水化合物含量测定。
成熟时取样进行穗部性状考查。每处理取9个抽穗期标记的主茎穗,调查一次枝梗数后手工脱粒并调查每穗实粒数和每穗空秕粒数。测定千粒重时用清水漂浮,下沉谷粒置于75℃烘箱烘干至恒重,千粒重(g)和每穗籽粒重(g)均用烘干质量表示。
1.3非结构性碳水化合物含量的测定
采用Pan 等[2]所述方法提取可溶性糖和淀粉并测定其含量。称取0.100 g烘干粉碎样品并置于10 mL试管中,加入5 mL 的80%乙醇,在80℃水浴中提取30min,取出后转入离心管离心(3000r/min)5min,并收集上清夜。重复提取2次后,合并3次上清液并以80%乙醇定容至25 mL,用于可溶性糖含量测定。然后,向沉淀中加蒸馏水2 mL,搅拌均匀,置于80℃水浴中使残留的乙醇蒸发,再放入沸水浴中糊化15min。冷却后,将离心管放在冰水浴中,加入2 mL 预冷9.2 mol/L高氯酸,不断搅拌,提取15min后加水4 mL,混匀后离心10min,上清液倒入50 mL容量瓶中。再向沉淀中加入4.6 mol/L高氯酸2 mL,搅拌提取15min后加水6 mL,混匀离心10min,收集上清液于容量瓶中,然后用水洗沉淀2次并离心,合并离心液于50 mL 容量瓶用蒸馏水定容,用于淀粉含量测定。
1.4数据分析
各指标以平均数±标准误表示。用STATISTICA (StatSoft Inc. Statistica. Tulsa OK. 1991)软件中的GLM模型(General ANOVA)进行平均值差异显著性检验。用SigmaPlot 10.0进行作图。非结构性碳水化合物的含量(mg/g)为可溶性糖含量与淀粉含量之和,每个节间(叶鞘)NSC的表观转运量(mg)(ATMNSC)用抽穗期与成熟期同一节间(叶鞘)NSC量的差值表示;每个节间(叶鞘)NSC对籽粒产量的表观贡献率(%)=ATMNSC/每穗产量×100%;叶面积消减率(%)=抽穗期与抽穗后n天上3叶绿叶面积的差值/抽穗期上三叶绿叶面积×100%;每穗库容量为每穗颖花数与饱粒重的乘积。
2结果与分析
2.1氮肥处理对产量性状的影响
N2处理下,扬稻6号和两优培九的产量分别比N1处理高59.0%和60.8%(图1);N2处理下两品种的颖花数、结实率、千粒重均显著大于N1处理,分别比N1处理增加53.9%、16.9%和10.7%,说明低氮处理减少了颖花分化和产量形成。然而,两个氮水平下两个品种每穗库容量无显著差异。

图中数据均为3次重复的平均值±标准误。不同字母表示差异达到P<0.05显著水平。N1和N2表示低氮和高氮处理。YD6-扬稻6号;LYP9-两优培九。下同。
Values are means of three replicates±SE. Different letter represents significant difference atP<0.05 level. N1and N2refer to low and high nitrogen application rates. YD6,Yangdao 6; LYD9,Liangyoupeijiu. The same as below.
图1氮肥处理对水稻主茎产量及构成因子的影响
Fig. 1. Effects of nitrogen application rate on grain yield and its components of main stems.

图中数据均为3次重复的平均值±标准误。*和**分别表示氮处理间在0.05、0.01水平上差异显著。下图同。
Values are means of three replicates±SE.*,**indicate significance between the two N treatments atP< 0.05 and 0.01 levels, respectively. The same as in figures below.
图2不同氮肥处理下主茎顶3叶绿叶面积动态变化
Fig. 2. Dynamic changes in areas of the top three leaves of main stem during grain filling under two nitrogen treatments.
2.2氮肥处理对顶3叶绿叶面积的影响
图2表明,N1处理下抽穗当日扬稻6号和两优培九主茎上3叶绿叶面积分别为80.3 cm2和81.6 cm2,N2处理下分别为125.1 cm2和137.7 cm2,同一氮处理下两品种间上3叶绿叶面积无显著差异;N2处理显著增加了绿叶面积,扬稻6号上3叶总叶面积比N1处理高55.2%,两优培九则高68.7%。
抽穗当日至抽穗后14d,扬稻6号绿叶面积消减率分别为29.5%(N1)和3.4%(N2),至抽穗后40d叶面积消减率分别为38.6%(N1)和41.1%(N2);两优培九抽穗当日至抽穗后14d的绿叶面积消减率为29.5%(N1)和5.7%(N2),至抽穗后40d绿叶面积消减率分别为77.7%(N1)和69.8%(N2)。扬稻6号抽穗后叶面积消减幅度小于两优培九,其功能叶片持绿期较长。
2.3氮肥处理对不同节间NSC含量变化的影响
抽穗当日,扬稻6号倒1节间NSC含量在N1、N2处理下分别为141 mg/g和138 mg/g(图3),抽穗后开始降低直至成熟期,氮肥处理对NSC积累和转运无显著影响。抽穗当日N1处理下倒2节间NSC含量是N2处理的1.6倍(N1,333.9 mg/g;N2,204.8 mg/g);抽穗当日倒3节间NSC含量(N1, 264.1 mg/g;N2, 280.6 mg/g)较高,然后随着灌浆逐渐降低,受氮肥处理影响较小。与抽穗期相比,N1处理下成熟期倒1、倒2和倒3节间的降幅分别为53.2%、58.1%和20.9%,N2处理下分别为56.5%、8.8%和45.6%。
由图3可知,在N1处理下,抽穗当日两优培九倒1、倒2和倒3节间NSC含量分别为154.8 mg/g、317.2 mg/g和514.0 mg/g,N2处理下分别为172.4 mg/g、316.1 mg/g和438.0 mg/g。倒2、倒3节间的NSC含量均高于倒1节间,其中,倒3节间最高。N1和N2处理下,两优培九倒1、倒2节间NSC含量分别在抽穗后7d和14d有一个峰值。与抽穗期相比,N1处理下成熟期时3个节间的NSC降幅分别为74.0%、58.1%和73.6%,N2处理下分别为81.6%、80.7 %和88.6%。
总体上看,抽穗当日两优培九上部三个节间的NSC含量均高于扬稻6号相应节间,并且成熟期NSC含量降幅也高于扬稻6号。
2.4氮处理对不同部位叶鞘NSC含量变化的影响
扬稻6号抽穗至成熟剑叶叶鞘NSC含量缓慢降低,氮处理对其变化无显著影响(图4);抽穗当日倒2叶鞘N1处理下NSC含量为233.9 mg/g,比N2处理高40%;在N1和N2处理下扬稻6号倒3叶鞘NSC含量和转运趋势无显著差异。总体上看,氮处理对3个叶鞘NSC含量的降幅没有显著影响。
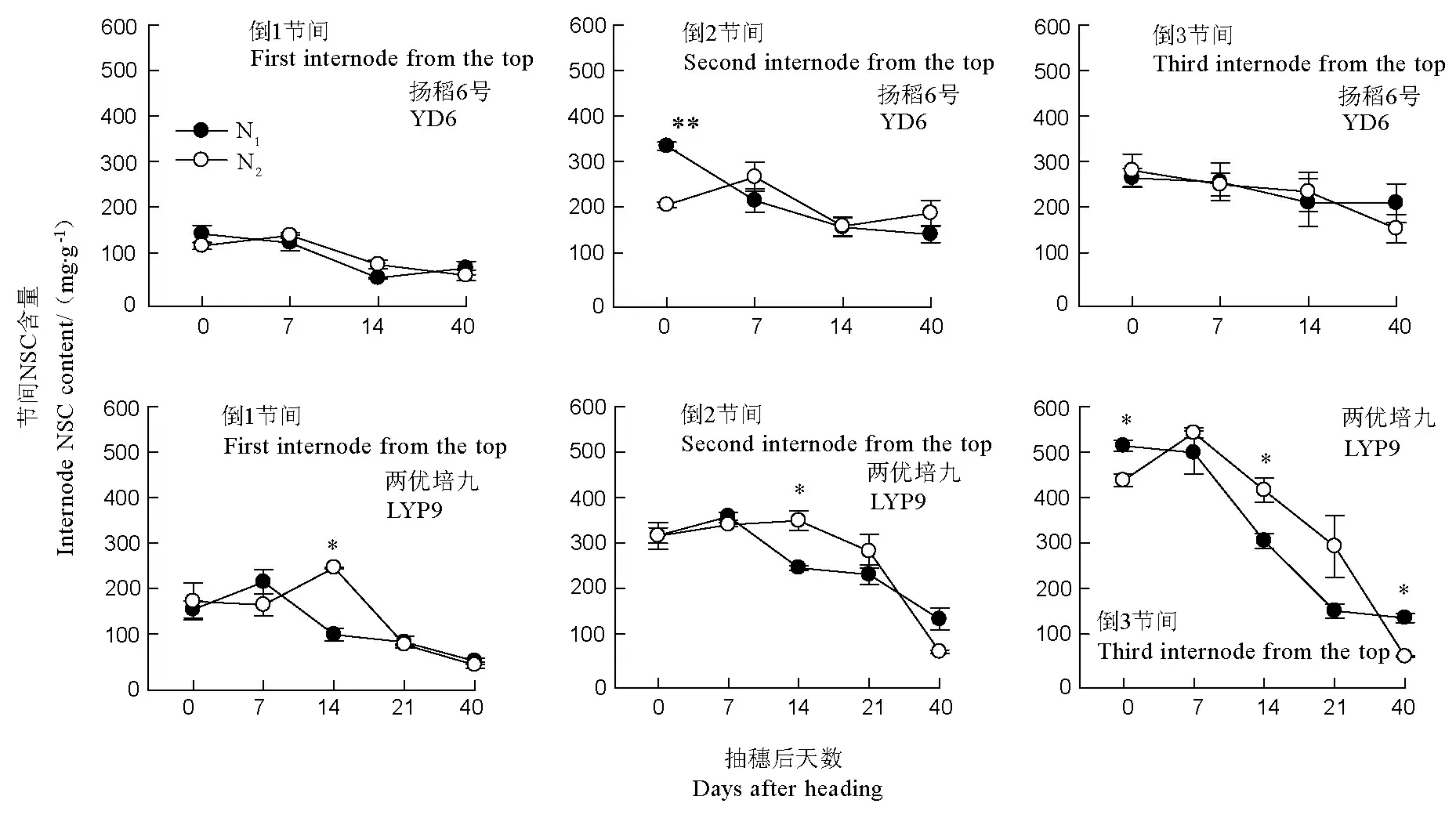
图3灌浆期不同节间NSC含量的变化动态
Fig. 3. Changes in non-structual carbohydrates(NSC) contents of the top three internodes during grain filling under two nitrogen treatments.
与倒2、倒3叶鞘相比,两个氮处理下两优培九剑叶叶鞘NSC含量较低(<120.0 mg/g),并随着灌浆进程缓慢下降(图4);抽穗当日倒2叶鞘(N1,312.2 mg/g;N2,269.0 mg/g)和倒3叶鞘(N1,362.0 mg/g;N2,341.0 mg/g)的NSC含量均表现为N1处理下高于N2(图4);抽穗后14d,倒2、倒3叶鞘NSC含量在N1处理下分别下降了54.0%和50.2%,在N2处理下为6.6%和22.4%。总体上,N1处理下倒2、3叶鞘NSC含量降幅明显大于N2处理。
2.5氮对节间与叶鞘NSC表观转运量的影响
由表1可知,扬稻6号上部3个叶鞘的NSC总转运量分别为118.3 mg(N1)和96.4 mg(N2),其中倒2、倒3叶鞘的转运量在两个氮处理下均占3个叶鞘总转运量的80%;上部3个节间总NSC转运量分别为69.2 mg(N1)和14.1 mg(N2),其中N1处理下倒2、倒3节间NSC转运量分别占3个节间总转运量的77%,而N2处理下,倒2、倒3节间的NSC转运量为负值,即无NSC净输出。总体上看,扬稻6号在N1处理下倒2、倒3节间及叶鞘的转运量占总转运量比75%,N2处理下倒2、倒3叶鞘转运量占总转运量的70%。
两优培九上部3个叶鞘的总NSC转运量分别为219 mg(N1)和241 mg(N2),倒2、倒3叶鞘的转运量占到3个叶鞘总转运量的90%(N1)和89%(N2);上部3个节间的总NSC转运量分别为169 mg(N1)和183 mg(N2),倒2、倒3节间的转运量分别占节间总转运量的95%(N1)和91%(N2);两个氮水平下两优培九倒2、倒3节间及叶鞘的转运量分别占总转运量的90%(N2)和92%(N1)。
根据倒1、倒2、倒3节间和叶鞘的NSC转运量和上部3节间和3叶鞘NSC转运总量来看,与N2处理相比,N1处理显著地促进了扬稻6号NSC转运(N1处理下总量为196.8 mg, N2处理下为110.5 mg)。N1促进了两优培九NSC倒3节间和倒3叶鞘的NSC转运量(差异不显著),然而对倒1、倒2节间和叶鞘的NSC转运量和上部3节间和叶鞘的NSC转运总量(N1处理下为387.9 mg,N2处理下为423.9mg)没有明显促进作用。两优培九的倒1、倒2、倒3节间和相应叶鞘总NSC转运量分别是扬稻6号的1.9倍(N1)和4.5倍(N2)。
2.6氮对节间与叶鞘NSC对产量表观贡献率的影响
由表2可知,扬稻6号上部3个节间转运的NSC对单穗产量表观贡献率分别为3.3%(N1)和0.0%(N2),3个叶鞘的表观贡献率分别为5.5%(N1)和2.3%(N2)。类似地,两优培九上部3个节间转运的NSC对单穗产量表观贡献率分别为8.9%(N1)和5.1%(N2),3个叶鞘的表观贡献率分别为11.7%(N1)和6.8%(N2)。

图4灌浆期不同叶鞘NSC含量的变化动态
Fig. 4. Changes in non-structual carbohydrates(NSC) contents of the top three leaf sheathes during grain filling under two nitrogen treatments.
总体上,扬稻6号上部3叶鞘和两优培九倒1、倒2叶鞘NSC转运对产量的表观贡献率大于相应节间,而两优培九倒3叶鞘NSC对产量的表观贡献率小于节间;与N2处理相比,N1处理下两品种均表现出较高的NSC表观贡献率,两优培九上部3个节间和相应叶鞘中NSC对产量的贡献明显高于扬稻6号。扬稻6号倒2、倒3节间和叶鞘的贡献率占倒3节间和叶鞘总贡献率的76.0%(N1)和77.0%(N2),两优培九则为91.0%(N1)和91.0%(N2)。
2.7节间叶鞘NSC表观转运量和NSC表观贡献率与库容、结实期叶面积消减率、一次枝梗数的关系
表3表明,倒1节间NSC表观转运量、表观贡献率在N1处理下分别与库容呈正相关,而在N2处理下为负相关。倒2节间NSC表观转运量、表现贡献率在N1处理下与库容为正相关,在N2处理下无明显相关。总体上,倒2、倒3节间及其相应叶鞘的NSC表观转运量、表观贡献率分别与成熟期绿叶面积消减率、一次枝梗数呈显著正相关(表3)。结果表明,抽穗后顶3叶绿叶面积下降越快,或穗部一次枝梗越多均可促进倒2、倒3节间及其相应叶鞘中NSC的转运及其对产量的贡献。
表1不同氮肥水平下节间与叶鞘的NSC表观转运量
Table 1. Apparent transferred mass of non-structual carbohydrates(NSC) from stems to grains in the top three internodes and leaf sheathes under two nitrogen treatments.

部位PlantpartNSC表观转运量(YD6)ApparenttransferredmassofNSC/mgN1N2NSC表观转运量(LYP9)ApparenttransferredmassofNSC/mgN1N2倒1节间Firstinternodefromthetop24.3a*14.1b8.6a17.1a倒1叶鞘Flagleafsheath23.4a19.2a22.9a27.4a倒2节间Secondinternodefromthetop39.5a-0.8b25.6a37.6a倒2叶鞘Secondleafsheathfromthetop49.9a46.8a95.3a119.8a倒3节间Thirdinternodefromthetop13.9a-16.2b134.5a128.3a倒3叶鞘Thirdleafsheathfromthetop45.0a30.4a101.0a93.7a总表观转运量ApparenttransferredmassofNSC196.8a93.5b387.9a423.9a
*平均值后不同小写字母表示在0.05水平上同一品种两个氮处理间差异显著(一般方差分析)。下表同。
*Different lowercase letters indicate significant difference between two nitrogen treatments atP< 0.05 level. The same as tables below.
表2不同氮肥水平下节间与叶鞘的NSC表观贡献率
Table 2. Apparent contribution rates of transferred non-structual carbohydrates(NSC) to grain yield in the top three internodes and leaf sheathes under two nitrogen treatments.
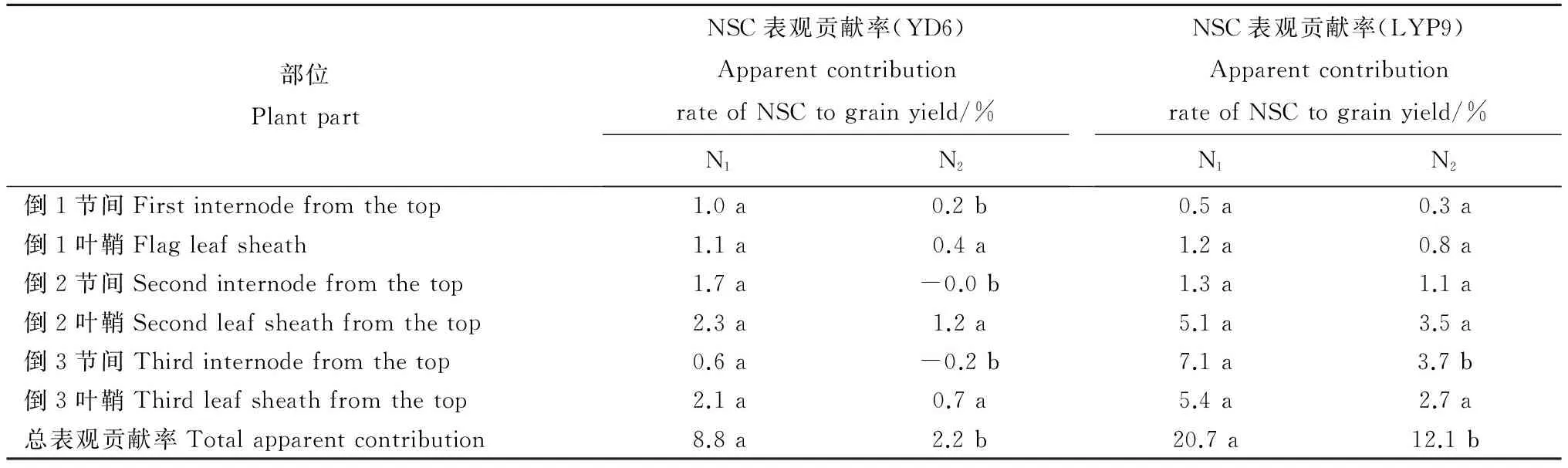
部位PlantpartNSC表观贡献率(YD6)ApparentcontributionrateofNSCtograinyield/%N1N2NSC表观贡献率(LYP9)ApparentcontributionrateofNSCtograinyield/%N1N2倒1节间Firstinternodefromthetop1.0a0.2b0.5a0.3a倒1叶鞘Flagleafsheath1.1a0.4a1.2a0.8a倒2节间Secondinternodefromthetop1.7a-0.0b1.3a1.1a倒2叶鞘Secondleafsheathfromthetop2.3a1.2a5.1a3.5a倒3节间Thirdinternodefromthetop0.6a-0.2b7.1a3.7b倒3叶鞘Thirdleafsheathfromthetop2.1a0.7a5.4a2.7a总表观贡献率Totalapparentcontribution8.8a2.2b20.7a12.1b
表3不同氮肥水平下节间叶鞘NSC表观转运量和NSC表观贡献率与库容、绿叶面积消减率、一次枝梗数的相关性
Table 3. Correlations between the reduced rate of leaf area(top three leaves), sink-capacity per panicle, number of primary rachis branch and non-structual carbohydrates(NSC) translocation traits under two nitrogen treatments.
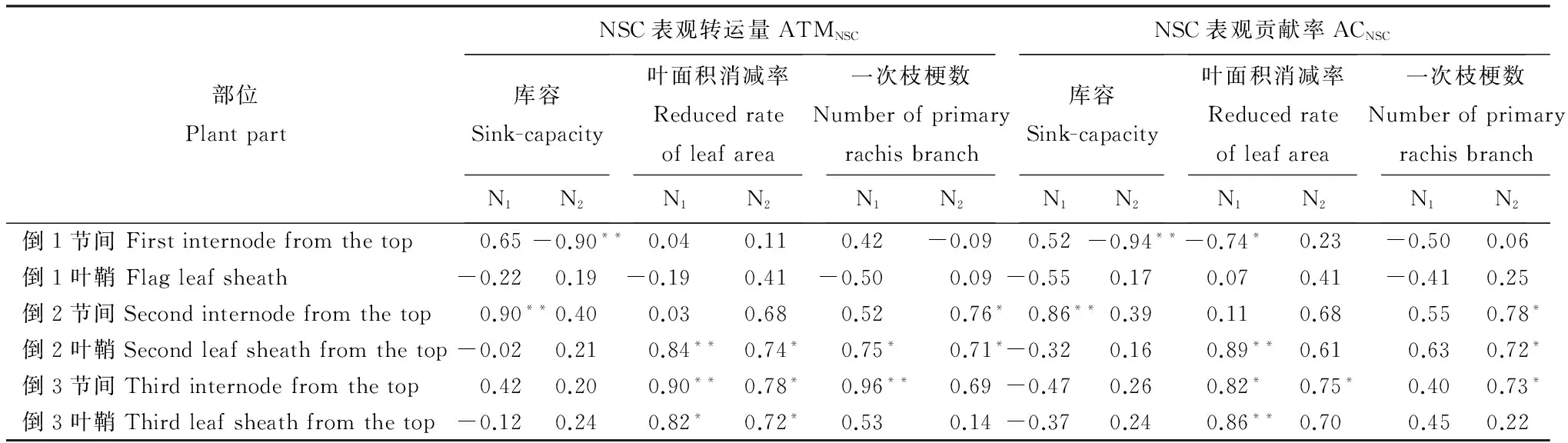
部位PlantpartNSC表观转运量ATMNSC库容Sink-capacityN1N2叶面积消减率ReducedrateofleafareaN1N2一次枝梗数NumberofprimaryrachisbranchN1N2NSC表观贡献率ACNSC库容Sink-capacityN1N2叶面积消减率ReducedrateofleafareaN1N2一次枝梗数NumberofprimaryrachisbranchN1N2倒1节间Firstinternodefromthetop0.65-0.90**0.040.110.42-0.090.52-0.94**-0.74*0.23-0.500.06倒1叶鞘Flagleafsheath-0.220.19-0.190.41-0.500.09-0.550.170.070.41-0.410.25倒2节间Secondinternodefromthetop0.90**0.400.030.680.520.76*0.86**0.390.110.680.550.78*倒2叶鞘Secondleafsheathfromthetop-0.020.210.84**0.74*0.75*0.71*-0.320.160.89**0.610.630.72*倒3节间Thirdinternodefromthetop0.420.200.90**0.78*0.96**0.69-0.470.260.82*0.75*0.400.73*倒3叶鞘Thirdleafsheathfromthetop-0.120.240.82*0.72*0.530.14-0.370.240.86**0.700.450.22
*,**分别表示在0.05和0.01水平上相关性显著(n=6)。
*,**indicate significant difference atP< 0.05 and 0.01 levels, respectively (n=6).
3讨论
3.1不同节间和叶鞘NSC积累转运特征
本研究表明倒1节间NSC含量最低,NSC的转运量以及对产量的表观贡献率也较小,可能与倒1节间的功能有关。从发育角度看,Scofield等[15]发现倒1节间在抽穗前10d至抽穗时才发育完成,供应给倒1节间的光合产物主要用于其伸长过程中结构性物质合成,因此,抽穗前积累NSC较少。从器官结构和功能来看,籼稻和粳稻倒1节间大维管束均直接与穗部一次枝梗直接相连,籼稻还有一部分维管束直接与二次枝梗相连[16],因此,倒1节间主要发挥物质运输通道的功能[17]。本研究发现倒1节间和叶鞘表现为较小的NSC表观转运量,并且倒2、倒3节间及其相应叶鞘NSC表观转运量与表观贡献率与一次枝梗数呈显著正相关(图3和图4,表3),也从流(运输通道)的角度证明了这一点。另外,两优培九倒1节间在抽穗后7d(N1)和14d(N2)NSC含量有明显的峰值,可能与倒3节间和叶鞘NSC含量在抽穗后NSC向穗部转运有关。Ruuska等[18]认为,茎鞘基部节间和叶鞘中积累较多的NSC,抽穗后13~15 d NSC开始降解并转运,这会引起上部节间NSC含量的增加。可见,倒1节间NSC含量较低可能与其发育较晚,并主要发挥物质运输通道功能有关。
本研究发现,两优培九倒2、倒3叶鞘抽穗期NSC含量明显高于扬稻6号,表现出品种差异,这与Pan等[2]的研究结果一致。虽然抽穗期扬稻6号上部3片功能叶的绿叶面积显著高于两优培九,但郭兆武等[17]研究发现,两优培九与其父本扬稻6号相比,其叶鞘光合能力表现出显著的平均优势或超亲优势。这可能是两优培九抽穗期时倒2、倒3叶鞘NSC含量较高的主要原因之一。
本研究观察到低氮处理明显增加了倒2、倒3叶鞘NSC含量。在水稻和小麦中,均有低氮促进茎鞘中NSC积累的报道[2,15,18,20-22]。低氮条件下,叶鞘中淀粉分支酶的mRNA表达量和酶活性显著增加,从而促进淀粉合成,这可能是叶鞘中NSC含量增加的主要原因[21]。此外,体内的无机氮同化为有机氮时需要碳架,高氮供应时氮同化可能需更多碳水化合物[23]。本研究发现,总体上N1处理下茎、鞘NSC含量降幅高于N2处理(图3和图4),表明低氮不但增加了茎鞘NSC的含量,且加速倒2、3叶鞘中NSC向外转运。
3.2节间、叶鞘NSC表观转运量和表观贡献率
为了满足籽粒灌浆需求,水稻会动用抽穗前茎鞘积累的NSC作为灌浆物质[1-5]。本研究结果显示,两个品种在两个氮处理下,倒2、倒3叶鞘NSC表观转运量均占三个叶鞘总表观转运量的八成以上,特别是两优培九中可达九成,表明水稻倒2、倒3叶鞘中储藏NSC在灌浆期间NSC总转运量中起着重要作用。另外,在两个氮处理下倒2、倒3叶鞘NSC表观贡献率均占3个叶鞘总表观贡献率的50%以上,对产量形成的表观贡献率平均为3.7%(N1,2.1%~5.4%)和2.0%(N2,0.7%~3.5%)(表2),表明倒2、倒3叶鞘NSC对产量形成具有重要作用。前人研究也发现,倒2、倒3叶鞘基部会贮存较多NSC,可能作为较长期的贮藏物质[8,11]。
与高氮处理相比,低氮处理时上部3节间和3叶鞘NSC的转运量以及对产量的表观贡献率明显增加(表1、表2)。Pan等[2]在大田条件下研究发现,低氮处理下茎鞘NSC表观转运量以及其对产量的表观贡献率分别比正常供氮处理平均高31%和4.4%。本研究中,扬稻6号和两优培九在N1处理下3个节间及叶鞘对籽粒产量的表观贡献率分别比N2处理高6.5%和8.6%(表2),与Pan等[2]的研究结果相似。N1处理下扬稻6号和两优培九的株高分别比N2处理降低了23 cm和16 cm,分蘖数仅为N2处理的1/3(数据未显示)。植株在低氮条件下生长会受到明显抑制,表现在分蘖数少、植株矮、库容小等方面,用于生长发育的同化物减少,部分同化物以NSC形式储藏在茎鞘韧皮部薄壁细胞,从而能够维持蔗糖在源端(功能叶)与临时库端(茎鞘)的浓度梯度,维持光合作用的持续进行[18]。灌浆启动后茎鞘中储藏的NSC会大量转运至籽粒,从而补偿光合作用减弱造成的灌浆同化物积累不足,提高了低氮条件下对产量的表观贡献率。另外,N2处理下扬稻6号倒2、倒3节间无NSC的表观输出(表观转运量为-17 mg),而两优培九倒2、倒3节间的转运量占上部3个节间总转运量的90%,表明两品种节间NSC对产量形成的贡献存在明显不同,表现出基因型差异。
扬稻6号和两优培九每穗籽粒产量和库容量并没有显著差异,但两优培九的上部3个节间和叶鞘的NSC表观转运量和对产量的表观贡献率显著高于扬稻6号(表1和表2)。究其原因,一是抽穗后为籽粒灌浆提供同化物的主要部位是顶部3片叶,扬稻6号抽穗后绿叶面积消减较两优培九慢且幅度小,抽穗后30d绿色叶面积的保有率也高于两优培九。因此,扬稻6号通过较长的持绿期增加叶源同化物的供应,从而有可能减少茎鞘同化物的转运。本研究发现倒2、倒3节间及其相应叶鞘NSC表观转运量与表观贡献率与叶面积消减率呈显著正相关(表3)也表明了这一点。二是扬稻6号抽穗后绿叶面积的变幅要显著低于两优培九,表明扬稻6号的功能叶片在灌浆后期可能还具有较高的光合能力。薛艳凤等[24]研究也发现,扬稻6号抽穗后30d绿叶面积的保有率和后期叶绿素含量均显著高于两优培九。三是两优培九叶鞘的光合能力要显著高于扬稻6号[19],从而可能在叶鞘和相应节间中积累较多的NSC(图3和图4),用于花后籽粒灌浆。此外,最近研究发现,水稻灌浆期上部叶鞘中α-淀粉酶基因(RAmy2A)表达量高、α-淀粉酶活力强的品种,其叶鞘中淀粉的降解和再转运也多[12]。本研究中叶鞘和节间α-淀粉酶的活力是否存在基因型差异以及受到氮处理的影响仍需要进一步研究。
现代高产水稻品种具有库容优势,优化栽培技术可以增加花前上部3个节间和叶鞘NSC积累和花后NSC再分配,对进一步提高水稻产量潜力具有重要意义。然而,值得注意的是,本研究中减施氮肥条件下增加了水稻上部3节间和叶鞘NSC的表观转运量和表现贡献率,但产量及其构成因子也大幅降低。如何找到既能稳定水稻产量、不倒伏又有利于增强茎鞘NSC转运的施氮量和优化施肥模式,尚需进一步研究。
4结论
本研究表明水稻上部3个节间和叶鞘的NSC(总)转运量和对产量的贡献率在品种间存在差异,并受施氮量和节/叶位的影响。低氮增加了扬稻6号上部3节间及上部3叶鞘总转运量和两优培九倒3节间及倒3叶鞘NSC的表观转运量,而对两优培九总表观转运量没有显著影响。低氮条件下水稻叶鞘及节间NSC(总)转运量与品种和节/叶位有关;低氮增加了水稻上部3个节间和叶鞘NSC对产量形成的表现贡献率;两品种叶鞘NSC转运量和表观贡献率(两优培九倒3叶鞘除外)大于节间;倒2、倒3节间及相应叶鞘NSC转运量及其表观贡献率与上3叶绿叶面积的消减率、一次枝梗数呈显著正相关,源叶同化物供应能力、库容大小对茎鞘NSC再分配具有调节作用。在水稻高产和减氮栽培中,合理调控氮肥供应和选用适当品种,促进抽穗前茎鞘NSC积累和抽穗后NSC转运,对花后逆境和减氮条件下产量稳定有重要作用。
谢辞:华中农业大学植物科技学院刘美仑与玛勒克•热思哈力等同学参加了本研究农艺性状和非结构性碳水化合物的测定工作,在此表示感谢!
参考文献:
[1]Cook J H, Yoshida S. Accumulation of14C-labelled carbohydrate before flowering and its subsequent redistribution and respiration in the rice plant.ProcCropSciSocJpn, 1972, 41(2): 226-234.
[2]Pan J F, Cui K H, Wei D, et al. Relationships of non-structural carbohydrates accumulation and translocation with yield formation in rice recombinant inbred lines under two nitrogen levels.PhysiolPlant, 2011, 141(4): 321-331.
[3]潘俊峰, 崔克辉, 向镜, 等. 不同库容量类型基因型水稻茎鞘非结构性碳水化合物积累转运特征.华中农业大学学报, 2015, 34(1): 9-15.
Pan J F, Cui K H, Xiang J, et al. Characteristics of non-structural carbohydrate accumulation and translocation in rice genotypes with various sink-capacity.JHuazhongAgricUniv, 2015, 34(1): 9-15.(in Chinese with English abstract)
[4]王志琴, 杨建昌, 朱庆森, 等. 水稻抽穗期茎鞘中储存的可用性糖与籽粒充实的关系. 江苏农学院学报, 1997, 18(4): 13-17.
Wang Z Q, Yang J C, Zhu Q S, et al. Relation of the usable carbohydrate reserved in stems and sheaths at heading stage with grain filling in rice plants.JJiangsuAgricColl, 1997, 18(4): 13-17.(in Chinese with English abstract)
[5]Fu J, Huang Z H, Wang Z Q, et al. Pre-anthesis non-structural carbohydrate reserve in the stem enhances the sink strength of inferior spikelets during grain filling of rice.FieldCropsRes, 2011, 123(2): 170-182
[6]Kashiwagi T, Ishimaru K. Identification and functional analysis of a locus for improvement of lodging resistance in rice.PlantPhysiol, 2004, 134(2): 676-683.
[7]Perez C M, Palmiano E, Baun L C, et al. Starch metabolism in the leaf sheaths and culm of rice.PlantPhysiol, 1971, 47(3): 404-408.
[8]He H Y, Koike M, Ishimaru T, et al.Temporal and spatial variations of carbohydrate content in rice leaf sheath and their varietal differences.PlantProdSci, 2005, 8(5): 546-552.
[9]Ishimaru K, Kosone M, Sasaki H, et al. Leaf contents differ depending on the position in a rice leaf sheath during sink-source transition.PlantPhysiolBiochem, 2004, 42(11): 855-860.
[10]Isopp H, Frehner M, Almeida J P F, et al. Nitrogen plays a major role in leaves when source-sink relations change: C and N metabolism inLoliumperennegrowing under free air CO2enrichment.AustJPlantPhysiol, 2000, 27(9): 851-858.
[11]Takahashi T, Chevalier P M, Rupp R A. Storage and remobilization of soluble carbohydrates after heading in different plant parts of a winter wheat cultivar.PlantProdSci, 2001, 4(3):160-165.
[12]Sugimura Y, Michiyama H, Hirano T. Involvement of α-amylase genes in starch degradation in rice leaf sheaths at the post-heading stage.PlantProdSci, 2015, 18(3): 277-283.
[13]李国辉, 钟旭华, 田卡, 等. 施氮对水稻茎秆抗倒伏能力的影响及其形态和力学机理. 中国农业科学, 2013, 46(7): 1323-1334.
Li G H, Zhong X H, Tian K, et al. Effect of nitrogen application on stem lodging resistance of rice and its morphological and mechanical mechanisms.SciAgricSin, 2013, 46(7): 1323-1334.(in Chinese with English abstract)
[14]曾建敏, 崔克辉, 黄见良, 等. 水稻生理生化特性对氮肥的反应及与氮利用效率的关系. 作物学报, 2007, 33(7):1168-1176.
Zeng J M, Cui K H, Huang J L, et al. Responses of physio-biochemical properties to n-fertilizer application and its relationship with nitrogen use efficiency in rice (OryzasativaL.).ActaAgronSin, 2007, 33(7): 1168-1176.(in Chinese with English abstract)
[15]Scofield G N, Ruuska S A, Aoki N, et al. Starch storage in the stems of wheat plants: Localization and temporal changes.AnnBot(Lond), 2009, 103(6): 859-868.
[16]Fukushima A, Akita S. Varietal differences of the course and differentiation time of large vascular bundles in the rachis of rice.JpnJCropSci, 1997, 66(1): 24-28.
[17]Liu G L, Mei H W, Yu X Q, et al. QTL analysis of panicle neck diameter, a trait highly correlated with panicle size, under well-watered and drought conditions in rice (OryzasativaL.).PlantSci, 2008, 174(1): 71-77.
[18]Ruuska S A, Lewis D C, Kennedy G, et al. Large-scale transcriptome analysis of the effects of nitrogen nutrition on accumulation of stem carbohydrate in reproductive-stage wheat.PlantMolBiol, 2008, 66(1-2): 15-32.
[19]郭兆武, 萧浪涛, 罗孝和, 等. 超级杂交稻“两优培九”剑叶叶鞘的光合功能. 作物学报, 2007, 33(9): 1508-1515.
Guo Z W, Xiao L T, Luo X H, et al. Photosynthetic function of the flag leaf sheath for super hybrid rice Liangyoupeijiu.ActaAgronSin, 2007, 33(9): 1508-1515.(in Chinese with English abstract)
[20]Nagata K, Yoshinaga S, Takanashi J, et al. Effects of dry matter production, translocation of nonstructural carbohydrates and nitrogen application on grain filling in rice cultivarTakanari, a cultivar bearing a large number of spikelets.PlantProdSci, 2001, 4(3): 173-183.
[21]Hirano T, Saito Y, Ushimaru H, et al. The effect of the amount of nitrogen fertilizer on starch metabolism in leaf sheath ofjaponicaandindicarice varieties during the heading period.PlantProdSci, 2005, 8(2): 122-130.
[22]潘俊峰,李国辉,崔克辉. 水稻茎鞘非结构性碳水化合物再分配及其在稳产和抗逆中的作用. 中国水稻科学, 2014, 28(4): 335-342.
Pan J F, Li G H, Cui K H. Re-partitioning of non-structural carbohydrates in rice stems and their roles in increasing yield stability and stress tolerance.ChinJRiceSci, 2014, 28(4): 335-342. (in Chinese with English abstract)
[23]Gebbing T, Schnyder H. Pre-anthesis reserve utilization for protein and carbohydrate synthesis in grains of wheat.PlantPhysiol, 1999, 121(3): 871-878.
[24]薛艳凤, 郎有忠, 吕川根, 等. 两优培九及其父本扬稻6号抽穗后叶片与根系衰老特点的研究. 扬州大学学报:农业与生命科学版, 2009, 29(3): 7-11.
Xue Y F, Lang Y Z, Lv C G, et al.Study on leaf and root senescence of Liangyoupeijiu and it′s male parent Yangdao 6 after heading.JYangzhouUniv, 2009, 29(3): 7-11.(in Chinese with English abstract)
Effects of Nitrogen Application on Accumulation and Translocation of Non-structural Carbohydrates in Internodes and Sheaths of Rice
PAN Jun-feng1,3,#, WANG Bo3,#, CUI Ke-hui2,3,*, HUANG Jian-liang2,3, NIE Li-xiao2,3
(1RiceResearchInstitute,GuangdongAcademyofAgriculturalSciences,Guangzhou510640,China;2HubeiCollaborativeInnovationcenterforGrainIndustry,Jingzhou434025,China;3NationalKeyLaboratoryofCropGeneticImprovement/MOAKeyLaboratoryofHuazhongCropPhysiology,EcologyandProduction/CollegeofPlantScienceandTechnology,HuazhongAgriculturalUniversity,Wuhan430070,China;#Theseauthorscontributedequallytothiswork;*Correspondingauthor,E-mail:cuikehui@mail.hzau.edu.cn)
PAN Junfeng, WANG Bo, CUI Kehui, et al. Effects of nitrogen application on accumulation and translocation of non-structural carbohydrates in internodes and sheaths of rice. Chin J Rice Sci, 2016, 30(3): 273-282.
Abstract:Two indica rice varieties, Liangyoupeijiu (LYP9) and Yangdao 6 (YD6), were grown in pots under low (N1) and high (N2) nitrogen application rates. The accumulation and translocation of non-structural carbohydrates (NSC) in the top-most three internodes and leaf sheaths of main stems and its contributions to grain yield were investigated. 1) Compared with N2 treatment, N1 treatment enhanced NSC translocation of the second and third internodes and sheaths in LYP9 during the early grain filling stage, and also increased the apparent transferred mass of NSC (ATMNSC) of the three internodes from the top and sheaths in YD6 and the third internode from the top and sheath in LYP9, respectively. However, N1 treatment had no obvious effect on ATMNSCof the top first and second internodes and sheaths in LYP9. Noticeably, N1 treatment increased the apparent contributions of NSC to grain yield (ACNSC) of the three internodes and sheaths in both two varieties. 2) Except the top-most third sheath in LYP9, the ATMNSCand ACNSCof sheaths were higher than those of internodes in both two varieties under N1 and N2 treatments. 3) Under N1 and N2 treatments, ATMNSCand ACNSCof the top-most second and third internodes and sheaths, and total ATMNSCand ACNSCof the three internodes and sheaths in LYP9 were higher than those in YD6, respectively. 4) Under N1 treatment, the top-most second and third internodes and sheaths totally contributed 92% and 91% of total ATMNSCand ACNSCof the three internodes and sheaths in LYP9, and 75% and 76% in YD6. Under N2 treatment,the top-most second and third internodes and sheaths totally contributed 90% and 91% in LYP9, and no NSC translocation from the top-most second and third internodes and totally accounted for 77% of total ACNSC. Our results indicated that ATMNSCof the three internodes and sheaths showed genotypic variation and depended on internode/sheath, and was affected by N application rate. Optimizing N fertilizer application and selecting suitable rice variety might enhance pre-anthesis NSC accumulation and post-anthesis NSC translocation, which could further increase rice yield potential and nitrogen use efficiency, especially stability of grain yield under adverse environments and nitrogen fertilizer-reducing practice.
Key words:rice; nitrogen application; internode and sheath; non-structural carbohydrates(NSC); yield formation
DOI:10.16819/j.1001-7216.2016.5128
收稿日期:2015-08-19; 修改稿收到日期: 2015-12-29。
基金项目:国家自然科学基金资助项目(31371548); 国家科技支撑计划资助项目(2013BAD07B10)。
中图分类号:Q945.11;S511.062
文献标识码:A
文章编号:1001-7216(2016)03-0273-10
中国水稻科学(Chin J Rice Sci),2016,30(3):273-282
http://www.ricesci.cn
