ARD1在鼻咽癌中的表达及临床意义研究
2016-06-14贾培荣杨国军
贾培荣,曾 妍,郑 军,杨国军,徐 江△
(1.石河子大学医学院第一附属医院口腔科,新疆石河子 832000;2.石河子大学医学院生化教研室,新疆石河子 832000)
ARD1在鼻咽癌中的表达及临床意义研究
贾培荣1,曾妍2,郑军1,杨国军1,徐江1△
(1.石河子大学医学院第一附属医院口腔科,新疆石河子 832000;2.石河子大学医学院生化教研室,新疆石河子 832000)
[摘要]目的检测ARD1在鼻咽部炎性组织、鼻咽癌组织及其各亚组之间的表达情况并探讨其临床意义。方法应用免疫组织化学SP法检测鼻咽癌组织(56例)、鼻咽部炎性组织(20例)中ARD1的表达情况,并分析ARD1的表达与年龄、性别、分化程度、临床分期、肿瘤转移等临床参数的相关性。结果ARD1在鼻咽部炎性组织、鼻咽癌组织中的阳性率分别为10.00%(2/20)、55.35%(31/56),ARD1在鼻咽癌组织中的表达水平明显高于其在鼻咽部炎性组织中的表达,差异有统计学意义(P<0.05);ARD1的表达与鼻咽癌组织的分化程度相关(P<0.05),在分化差的组织中表达上调;但与患者年龄、性别、临床分期、肿瘤转移差异无统计学意义(P>0.05)。结论ARD1在鼻咽癌组织中高表达,且与肿瘤分化程度密切相关,提示ARD1可能与鼻咽癌的发生发展有关,但具体如何发挥作用仍需做进一步的深入研究。
[关键词]鼻咽肿瘤;ARD1;细胞分化;免疫组织化学
鼻咽癌(nasopharyngeal carcinoma)是威胁全球人类健康的常见头颈部恶性肿瘤之一。据统计,世界上80.00%的鼻咽癌发生在中国[1]。流行病学相关数据显示其发病具有明显的地域聚集性,高发区主要集中在我国南方5省(广东、广西、湖南、福建、江西),有“广东癌”之称。其有起病隐匿,早期临床不易发现,恶性程度高,低分化鳞癌最多见,生长快,易向颈部淋巴结转移和远处转移等临床特点。目前,放射治疗是鼻咽癌的首选治疗手段,但放射治疗后局部复发和远处转移率仍很高,Ⅰ期病例综合治疗后5年生存率达95.00%,Ⅳ期病例仅为35.00%[2],可见目前鼻咽癌的治疗效果仍不理想。因此,为了进一步提高鼻咽癌患者的诊疗水平,迫切需要寻找鼻咽癌发生、发展和预后相关的分子标志物及新的靶点。据相关文献报道,ARD1与人类多种肿瘤具有相关性,如乳腺癌、肺癌、肝癌、直结肠癌等[3-6],且其在不同肿瘤组织及肿瘤的不同发展阶段发挥不同作用,成为近年研究的热点,但ARD1与鼻咽癌的相关性研究尚未见报道。本课题初步探讨ARD1在鼻咽癌中的表达情况及其与组织分化、肿瘤转移、临床分期等临床参数的相关性,以期为鼻咽癌的早期诊断、早期治疗及预后评估的后续研究提供一定的帮助。
1资料与方法
1.1一般资料收集经新疆维吾尔自治区石河子大学医学院第一附属医院耳鼻喉科和石河子人民医院耳鼻喉科2000~2005年病理诊断确诊为鼻咽癌患者的临床病例56例并有相应蜡块标本、鼻咽部炎性组织20例。并对鼻咽癌病例根据临床参数性别、年龄、分化程度、临床分期、是否淋巴结转移进行分组。鼻咽癌病例中,男39例,女17例;年龄小于40岁的13例,年龄大于或等于40岁43例;高分化3例,中分化5例,低分化48例;按照鼻咽癌TNM分期标准进行临床分期:Ⅰ期14例,Ⅱ期13例,Ⅲ期20例,Ⅳ期9例;有淋巴结转移42例,无淋巴结转移14例,以上鼻咽癌病例均未进行放射、化学治疗。本课题试验通过医学伦理审批,审批号为2014LL15。
1.2方法
1.2.1主要试剂单克隆鼠抗人ARD1抗体[4],由北京大学临床肿瘤医院寿成超教授馈赠。免疫组织化学试剂盒购自北京中杉金桥生物技术有限公司。
1.2.2试验方法采用免疫组织化学SP法。常规将石蜡包埋的组织块连续切片、烤片、脱蜡、脱二甲苯、水化,3%甲醇过氧化氢中封闭10 min,微波修复抗原,PBS振洗,滴加一抗,放入4 ℃冰箱24 h。PBS再次振洗后滴加二抗,37 ℃恒温箱孵育30 min。第3次PBS振洗后滴加三抗,在恒温箱中孵育30 min,DAB显色,苏木素复染,蒸馏水洗涤,显微镜下观察结果。用PBS代替一抗作阴性对照。
1.2.3结果判定ARD1主要定位于细胞质中,间质无染色。染色评分标准[7]以镜下组织细胞质中出现棕黄色染色为阳性指标,综合染色强度和阳性细胞数两个方面考虑,用半定量法进行结果判定。按染色阳性强度评分:无着色、浅、中、深染的棕黄色分别为0分、1分、2分、3分。按阳性细胞比例评分,在高倍镜下(×400)选取5个阳性细胞数多的视野进行计数,计数阳性细胞及总细胞数,求出阳性细胞占总细胞数的百分比,取其平均值,并进行计分:无细胞染色为0分,阳性细胞1.00%~24.00%为1分,阳性细胞25.00%~49.00%为2分,阳性细胞50.00%~74.00%为3分,阳性细胞75.00%~100.00%为4分。最后着色强度及阳性细胞百分比相乘为所得分数:小于或等于3分为(-),4~5分为(+),6~8分为 (++),9~12分为 (+++)。(-)为阴性表达。(+)、(++)、(+++)为阳性表达。免疫组织化学结果由石河子大学医学院第一附属医院病理学专家根据病理学判断标准进行赋值。
1.3统计学处理采用SPSS17.0统计软件进行统计分析,采用χ2检验或Fisher精确概率法分别比较ARD1在鼻咽癌组织和鼻咽部炎性组织,以及鼻咽癌各亚组(包括组织分化、临床分型、有无淋巴转移及年龄、性别)之间的差异,以P<0.05为差异有统计学意义。
2结果
2.1ARD1在鼻咽部炎性组织、鼻咽癌组织中的表达20例鼻咽部炎性组织中有2例(+),阳性率10.00%;56例鼻咽癌组织中有9例(+),11例(++),11例(+++),阳性率为55.35%(31/56),ARD1在鼻咽部炎性组织和鼻咽癌组织中表达差异有统计学意义(P<0.05)。见表1和图1。 ARD1在鼻咽癌组织中的染色明显,ARD1在鼻咽部炎性组织中染色不明显。

表1 ARD1在鼻咽癌组织和鼻咽部炎性组织中的表达(n)
2.2ARD1的表达强度与临床参数之间的关系见表2。
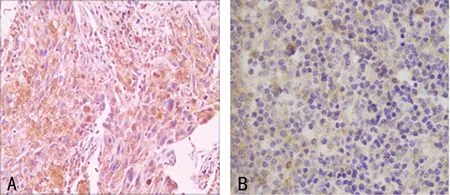
A、B:ARD1在鼻咽癌组织和鼻咽部炎性组织中的染色程度(棕色为阳性指标)。
图1免疫组织化学SP法(×400)
2.2.1ARD1的表达与性别的关系ARD1在男性和女性中的阳性率分别为56.41%(22/39)、52.94%(9/17),差异无统计学意义(P>0.05)。
2.2.2ARD1的表达与年龄的关系ARD1在小于40岁和大于或等于40岁中的阳性率分别为61.54%(8/13)、53.49%(23/43),差异无统计学意义(P>0.05)。
2.2.3ARD1的表达与分化程度的关系由于临床上鼻咽癌高分化和中分化的病例非常少见,其病理类型大部分为低分化鳞癌,本文未发现高分化癌,进而合并高、中分化组,再与低分化组比较,差异有统计学意义(χ2=5.061,P=0.024)。
2.2.4ARD1的表达与临床分期的关系ARD1在Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期的阳性率分别为57.14%(8/14)、69.23%(9/13)、55.00%(11/20)、33.33%(3/9),差异无统计学意义(P>0.05)。
2.2.5ARD1的表达与淋巴结转移的关系ARD1在淋巴结转移组和无淋巴结转移组的阳性率分别为54.76%(23/42),57.14%(8/14),差异无统计学意义(P>0.05)。

表2 ARD1的表达与鼻咽癌临床参数的关系[n(%)]
χ2,P为不同分组阳性率比较所得。
3讨论
ARD1基因最初在酵母细胞中发现,具有乙酰转移酶的活性,催化真核细胞内多种蛋白质乙酰化。ARD1广泛表达于人体多种组织,包括脑、心肝、骨骼肌、肠、脾、肾等[8]。ARD1定位于细胞质及细胞核,以细胞质定位占优势[9]。依据目前的文献报道,一方面,ARD1在人类细胞中可能主要起解除细胞周期阻滞,促进细胞增殖的作用[10-11],而在肿瘤细胞的凋亡过程中起双重作用,即促进或抑制肿瘤细胞凋亡[12-13],并且还能够促进细胞自噬[14]。另一方面,ARD1还能抑制肿瘤的侵袭和转移。Shin等[15]研究发现,ARD1通过乙酰化肌球蛋白的轻链激酶(MLCK)并激活Ca2+信号通道使MLCK失活,降低其磷酸化程度,从而降低细胞的运动能力,抑制肿瘤细胞的转移和侵袭。而Hua等[16]发现,ARD1通过与PAK蛋白交互互换因子β(β-PLX)的G蛋白耦联受体激酶相互作用蛋白(GIT)结合,从而阻断了GIT-PIX-Paxillin复合物的形成,导致内源性CDC42/Racl活性降低,细胞运动能力减弱,最终抑制肿瘤细胞的转移和侵袭。
文献报道,ARD1与人类多种肿瘤具有相关性。早在 2005 年,Arnesen等[17]就发现,在胸腺癌组织中 ARD1 蛋白水平高于癌旁组织。Ren等[4]也证明,在结直肠癌组织中,ARD1的表达显著高于对应的非癌组织和肠炎组织。2009 年,Yu等[18]检测了多种癌组织中的ARD1的表达率:膀胱癌75.00%(15/20),乳腺癌62.50%(30/48),宫颈癌57.14%(8/14)。综合可见ARD1在多种癌组织中高表达,但在鳞上皮中的阳性率比腺上皮高,表明ARD1的表达高低可能与肿瘤组织类型有关。除此之外,多篇文献报道ARD1在癌组织中的表达还与肿瘤的分化程度、淋巴结转移等临床参数相关。Midorikawa等[3]证明,肝癌组织中ARD1 的表达与鳞状上皮细胞分化呈正相关,细胞分化越成熟,ARD1表达越强。Wang等[5]发现,ARD1在前列腺癌及乳腺癌中[14,19]均呈高表达,且在乳腺癌患者中,淋巴结转移者表达高于无淋巴结转移者。Hua等[16]也发现,ARD1在肺癌、胃癌及乳腺癌中高表达,但ARD1的表达在淋巴结转移的肿瘤患者中低于无淋巴结转移的患者。另据报道,ARD1的高表达还与肿瘤的预后有关。大多数的文献表明,ARD1在癌组织中的高表达预示着预后良好,Shin等[15]发现,乳腺癌中ARD1高表达预示肿瘤预后良好,Hua等[16]也表明,ARD1在肺癌组织中的高表达预示预后良好,但Lee等[6]发现ARD1在肺癌中高表达与预后不良有关。可见目前对于ARD1的表达与淋巴结转移、预后的相关性具有争议性。
本研究通过免疫组织化学检测ARD1在鼻咽癌中的表达并探讨其临床意义。结果发现,ARD1在鼻咽癌组织和鼻咽部炎性组织的表达差异有统计学意义(P<0.05),说明ARD1在鼻咽癌组织中高表达,这一结论与上述Lee等[6]ARD1与乳腺癌、肺癌的相关性研究报道一致。结果提示ARD1可能参与了鼻咽癌的发生过程,但是其在鼻咽癌中表达增加的机制还有待进一步的研究阐明。分析ARD1在鼻咽癌组的临床参数中的表达发现,ARD1的表达与肿瘤的分化程度有关,且细胞分化越差,ARD1表达率越高。提示ARD1可能参与了鼻咽癌的发展过程。但这一结果与Midorikawa等[3]报道的肝癌组织中ARD1 的表达与鳞状上皮细胞分化呈正相关,细胞分化越成熟,ARD1表达越强的结论相反,作者分析可能有以下原因:一方面可能是因为ARD1的生物学功能具有双重性,在不同种类肿瘤组织及肿瘤的不同阶段发挥不同的生物学功能,具有不同的临床意义;另一方面也可能与鼻咽癌恶性程度高,大部分病例为低分化,且本课题组试验样本量不足有关。当然也可能与不同患者群体的异质性、各研究组使用不同的抗原表位的抗体、组化评分具有很强的主观性等原因有关。除此之外,ARD1在年龄、性别、临床分期、淋巴结是否转移中的差异无统计学意义(P>0.05),说明ARD1在鼻咽癌中的表达与年龄、性别、临床分期、淋巴结是否转移无相关性,但Wang等[5]报道,ARD1在乳腺癌患者中,淋巴结转移者表达高于无淋巴结转移者,Hua等[16]证实,ARD1在肺癌、胃癌及乳腺癌中,淋巴结转移者中表达低于无淋巴结转移者。可以看出ARD1在肿瘤组织中表达与肿瘤转移之间的关系具有争议性,猜测可能是因为即使是同一肿瘤的不同阶段,ARD1也可能发挥不同的作用,或者发挥其生物学功能的双重性。
综上所述,ARD1在鼻咽癌组织中高表达,且与鼻咽癌的的分化程度密切有关,在分化差的组织中表达上调,提示ARD1可能是通过影响鼻咽癌的组织学分型参与了鼻咽癌的发生发展过程。但是具体如何发挥作用仍需做进一步的深入研究。
参考文献
[1]肖雪.分泌蛋白FSTL1在鼻咽癌中的抑瘤作用及其机制的研究[D].南宁:广西医科大学,2013.
[2]蒋家澧.鼻咽癌相关分子机制的最新研究进展[J].中国医药导报,2007,14(29):5-9.
[3]Midorikawa Y,Tsutsumi S,Taniguchi H,et al.Identification of genes associated with dedifferentiation of hepatocellular carcinoma with expression profiling analysis[J].Jpn J Cancer Res,2002,93(6):636-643.
[4]Ren T,Jiang B,Jin G,et al.Generation of novel monoclonal antibodies and their application for detecting ARD1 expression in colorectal cancer[J].Cancer Lett,2008,264(1):83-92.
[5]Wang Z,Wang Z,Guo J,et al.Inactivation of androgen-induced regulator ARD1 inhibits androgen receptor acetylation and prostate tumorigenesis[J].Proc Natl Acad Sci U S A,2012,109(8):3053-3058.
[6]Lee CF,Ou DS,Lee SB,et al.hNaa10p contributes to tumorigenesis by facilitating DNMT1-mediated tumor suppressor gene silencing[J].J Clin Invest,2010,120(8):2920-2930.
[7]Cao YW,Li WQ,Wan GX,et al.Correlation and prognostic value of SIRT1 and Notch1 signaling in breast cancer.[J].J Exp Clin Cancer Res,2014,33(1):1-11.
[8]Jeong JW,Bae MK,Ahn MY,et al.Regulation and destabilization of HIF-1alpha by ARD1-mediated acetylation[J].Cell,2002,111(5):709-720.
[9]Arnesen T,Anderson D,Baldersheim C,et al.Identification and characterization of the human ARD1-NATH protein acetyltransferase complex[J].Biochem J,2005,386(Pt 3):433.
[10]ArnesenT,GromykoD,PendinoF,etal.InductionofapoptosisinhumancellsbyRNAi-mediatedknockdownofhARD1andNATH,componentsoftheproteinN-alpha-acetyltransferasecomplex[J].Oncogene,
2006,25(31):4350-4360.
[11]Fisher TS,Etages SD,Hayes L,et al.Analysis of ARD1 function in hypoxia response using retroviral RNA interference[J].J Biol Chem,2005,280(18):17749-17757.
[12]Park J,Kanayama A,Yamamoto K,et al.ARD1 binding to RIP1 mediates doxorubicin-induced NF-κB activation[J].Biochem Biophys Res Commun,2012,422(2):291-297.
[13]Arnesen T,Starheim KK,Van Damme P,et al.The chaperone-like protein HYPK acts together with NatA in cotranslational N-terminal acetylation and prevention of Huntingtin aggregation[J].Mol Cell Biol,2010,30(8):1898-1909.
[14]Wang ZH,Gong JL,Yu M,et al.Up-regulation of human arrest-defective 1 protein is correlated with metastatic phenotype and poor prognosis in breast cancer[J].Asian Pac J Cancer Prev,2011,12(8):1973-1977.
[15]Shin DH,Chun YS,Lee KH,et al.Arrest defective-1 controls tumor cell behavior by acetylating myosin light chain kinase[J].PLoS One,2009,4(10):e7451.
[16]Hua KT,Tan CT,Johansson G,et al.N-α-acetyltransferase 10 protein suppresses cancer cell metastasis by binding PIX proteins and inhibiting Cdc42/Rac1 activity[J].Cancer Cell,2011,19(2):218-231.
[17]Arnesen T,Gromyko D,Horvli O,et al.Expression of N-acetyl transferase human and human Arrest defective 1 proteins in thyroid neoplasms[J].Thyroid,2005,15(10):1131-1136.
[18]Yu M,Gong J,Ma M,et al.Immunohistochemical analysis of human arrest-defective-1 expressed in cancers in vivo[J].Oncol Rep,2009,21(4):909-915.
[19]Yu M,Ma M,Huang C,et al.Correlation of expression of human arrest-defective-1 (hARD1) protein with breast cancer[J].Cancer Invest,2009,27(10):978-983.
Study on expression and clinical significance of ARD1 in nasopharyngeal carcinoma*
JiaPeirong1,ZengYan2,ZhengJun1,YangGuojun1,XuJiang1△
(1.DepartmentofStomatology,theFirstAffiliatedHospital,MedicalCollegeofShiheziUniversity,Shihezi,Xinjiang832000,China;2.BiochemicalTeachingResearchSection,MedicalCollegeofShiheziUniversity,Shihezi,Xinjiang832000,China)
[Abstract]ObjectiveTo detect and explore the expression of ARD1 and its clinical significance in the nasopharyngeal inflammatory tissue,nasopharyngeal carcinoma group and its subgroups.MethodsExpression of ARD1 in nasopharyngeal carcinoma (56 cases) and nasopharyngeal inflammatory tissue (20 cases) were detected by immunohistochemical staining SP,the correlation between the expression of ARD1 and age,gender,histological grade,TNM clinical stage and tumor metastasis were analysed.ResultsThe positive expression rate of ARD1 were 10.00% (2/20),55.35% (31/56) in the nasopharyngeal inflammatory tissue and nasopharyngeal carcinoma,respectively.The expression level of ARD1 in nasopharyngeal carcinoma was significantly higher than in the nasopharyngeal inflammatory tissue,the difference was significant (P<0.05);expression of ARD1 in the nasopharyngeal carcinoma was correlated with the histological grade of nasopharyngeal carcinoma(P<0.05) and the expression was increased in poor differenciation tissue.But there was no statistical difference between the expression of ARD1 and the patient′s age,gender,TNM clinical stage,tumor metastasis(P>0.05).ConclusionThe expression of ARD1 is high in nasopharyngeal carcinoma,and has a closely correlation with diffferentiation level of tumor,which suggested that ARD1 may be involved in the the occurrence and development of nasopharyngeal carcinoma.However,further research needs to be done for its mechanism in the nasopharyngeal carcinoma.
[Key words]nasopharyngeal neoplasms;ARD1;cell differentiation;immunohistochemistry
doi:论著·临床研究10.3969/j.issn.1671-8348.2016.02.012
基金项目:国家自然科学基金资助项目(81560473);新疆建设兵团博士基金项目(2014BB021);高层次人才启动资金项目(RCZX201330)。
作者简介:贾培荣(1988-),在读硕士,主要从事头颈部疾病基础与临床研究。 △通讯作者,E-mail:1437759520@qq.com。
[中图分类号]R739.63
[文献标识码]A
[文章编号]1671-8348(2016)02-0183-03
(收稿日期:2015-09-18修回日期:2015-10-16)
