N,N-二甲基乙酰胺促进N-取代肉桂酰胺的合成
2016-06-12罗年华郑大贵祝显虹周安西
罗年华, 郑大贵, 祝显虹, 周安西, 王 勇
(上饶师范学院 江西省普通高校应用有机化学重点实验室,江西 上饶 334001)
·研究简报·
N,N-二甲基乙酰胺促进N-取代肉桂酰胺的合成
罗年华*, 郑大贵, 祝显虹, 周安西, 王勇
(上饶师范学院 江西省普通高校应用有机化学重点实验室,江西 上饶334001)
摘要:以肉桂酸为原料,N,N-二甲基乙酰胺(DMAc, 4 mL)为促进剂,先与SOCl2于0 ℃反应20 min,再与芳胺于25 ℃反应3 h,合成了10个N-取代肉桂酰胺(3a~3j),产率85.8%~96.5%,其结构经1H NMR,13C NMR, IR和EI-MS确证。提出了DMAc促进反应的可能机理。
关键词:DMAc; 肉桂酸; N-取代肉桂酰胺; 合成; 促进机理
肉桂酰胺类化合物是许多药物的中间体,具有独特的药理和生物活性[1]。如曲尼司特(A), 2-氟苯基肉桂酰胺(B),N-(3-卤代芳基)-4-羟基肉桂酰胺(C)和二-(3,4-二甲氧基肉桂酰氨基)-苯乙酮(D)。A是一种针对过敏性疾病的药物,具有抗氧化、抗遗传毒性、抗肝纤维化和抗炎等功效[2-6]。B对人体乳腺癌细胞株(MCF-7)有抗增殖活性,对表皮生长因子受体也有抑制活性,可作为潜在的表皮生长因子受体激酶抑制剂[7]。C可作为重组人体单胺氧化酶抑制剂[8]。D作为HIV-1IN的潜在抑制剂,研究较为深入[9]。
肉桂酰胺类化合物在药物合成中的重要价值,吸引了化学家们的广泛关注。其合成方法主要有:Vogel P小组[11]报道了一锅法合成肉桂酸苯胺的方法。苯胺先与丙烯基磺酰氯反应制得活化磺酰胺,再与肉桂酸反应,以中等至良好的收率

Scheme 1
合成了产物。Mohammed A小组[12]报道了咖啡酸与氨茴酸甲酯的酰胺化反应。该反应以甲苯为溶剂,咖啡酸先与PCl3反应制得酰氯,再与氨茴酸甲酯反应合成了具有抗炎和抗氧化活性的肉桂酸类化合物。Wise M L小组[13]报道了三-(二甲氨基)磷六氟磷酸盐促进的4-乙酰氧基肉桂酸与取代芳胺的酰胺化反应。但上述方法均存在产率较低、操作复杂和成本较高等缺点。近年来,学者们陆续发展了一些新方法。如Raymond小组[14]报道了N,N-二甲基乙酰胺(DMAc)促进一锅法合成丙烯酰胺。该方法无需中间分离过程,操作简便,产率较高。
基于此,本文继续研究了DMAc促进肉桂酰胺合成的反应。以肉桂酸(1)为原料,DMAc(4 mL)为促进剂,先与SOCl2于0 ℃反应20 min[15-16],再与芳胺(2a~2j)于25 ℃反应3 h,合成了10个N-取代肉桂酰胺(3a~3j, Scheme 1),产率85.8%~96.5%,其结构经1H NMR,13C NMR, IR和EI-MS确证。并提出了DMAc促进反应的可能机理。
1实验部分
1.1仪器与试剂
X-6型熔点仪(温度未校正);Bruker Avance 400型核磁共振仪(CDCl3或DMSO-d6为溶剂,TMS为内标);Bruker Tensor 27型红外光谱仪(KBr压片);Agilent Techologies 5975C型质谱仪。
1和2a~2j,阿拉丁试剂公司,纯度≥98%; SOCl2,工业品,使用前经重蒸纯化;其余所用试剂均为分析纯。
1.2合成(以3a为例)
在反应瓶中依次加入1 1.48 g(10 mmol), DMAc 4 mL和CH2Cl26 mL,于室温搅拌使其溶解;于0 ℃缓慢滴加SOCl2870 μL(12 mmol),滴毕,反应20 min。加入2a 973 μL(10 mmol),于25 ℃反应3 h。依次加入蒸馏水(40 mL)和乙酸乙酯(40 mL),分液,水层用乙酸乙酯(2×40 mL)萃取,合并有机层,依次用2.5%NaHCO3溶液(3×30 mL)和饱和食盐水(2×30 mL)洗涤,无水MgSO4干燥;过滤,滤液旋蒸除溶后经硅胶柱层析[洗脱剂:V(乙酸乙酯) ∶V(石油醚)=1 ∶3]纯化得白色固体3a。
以2b~2j替代2a,用类似的方法合成白色固体3b~3i和蓝色固体3j。
肉桂酰苯胺(3a): m.p.149.8~151.9 ℃;1H NMRδ: 8.04(s, 1H, NH), 7.73(d,J=15.6 Hz, 1H,β-H), 7.67~7.65(br, 2H, ArH), 7.44~7.42(br, 2H, ArH), 7.35~7.25(m, 5H, ArH), 7.11(t,J=7.2 Hz, 1H, ArH), 6.63(d,J=15.6 Hz, 1H,α-H);13C NMRδ: 164.3, 142.3, 138.1, 134.6, 129.9, 129.0, 128.8, 127.9, 124.4, 121.0, 120.1; IRν: 3 272(N—H), 3 053(=CH), 1 662(C=O), 1 626(C=C), 1 578(N—H) cm-1; EI-MSm/z: 223.1[M+], 131.1[C8H7CO+]。
N-(2-甲基苯基)-肉桂酰胺(3b): m.p.179.7~181.9 ℃;1H NMRδ: 9.52(s, 1H, NH), 7.66~7.60(m, 4H,β-H, ArH), 7.47~7.39(m, 3H, ArH), 7.25~7.19(m, 2H, ArH), 7.12~7.01(m, 2H,α-H, ArH), 2.27(s, 3H, CH3);13C NMRδ: 164.1, 140.5, 136.9, 135.3, 131.5, 130.8, 130.2, 129.5, 128.2, 126.5, 125.5, 124.9, 122.8, 18.5; IRν: 3 273(N—H), 3 055(=CH), 2 948(CH3), 1 653(C=O), 1 622(C=C), 1 526(N—H) cm-1; EI-MSm/z: 237.1[M+], 131.1[C8H7CO+]。
N-(3-甲基苯基)-肉桂酰胺(3c): m.p.117.5~119.8 ℃;1H NMRδ: 8.41(d,J= 10.8 Hz, 1H, NH), 7.72(d,J=15.6 Hz, 1H,β-H), 7.52~7.47(m, 2H, ArH), 7.38(d,J=7.6 Hz, 2H, ArH), 7.31~7.24(m, 3H, ArH), 7.17(t,J=8.0 Hz, 1H, ArH), 6.90(d,J=7.6 Hz, 1H, ArH), 6.70(d,J=15.6 Hz, 1H,α-H), 2.25(s, 3H, CH3);13C NMRδ: 164.6, 142.1, 139.0, 138.2, 134.7, 129.9, 128.9, 128.8, 128.0, 125.3, 121.2, 121.0, 117.4, 21.5; IRν: 3 257(N—H), 3 022(=CH), 2 946(CH3), 1 655(C=O), 1 624(C=C), 1 558(N—H) cm-1; EI-MSm/z: 237.1[M+], 131.1[C8H7CO+]。
N-(4-甲基苯基)-肉桂酰胺(3d): m.p.169.2~171.6 ℃;1H NMRδ: 8.45(s, 1H, NH), 7.70(d,J=15.6 Hz, 1H,β-H), 7.56(d,J=8.0 Hz, 2H, ArH), 7.36(d,J=7.2 Hz, 2H, ArH), 7.29~7.23(m, 3H, ArH), 7.07(d,J=8.0 Hz, 2H, ArH), 6.67(d,J=15.6 Hz, 1H,α-H), 2.27(s, 3H, CH3);13C NMRδ: 164.6, 141.9, 135.7, 134.7, 134.1, 129.8, 129.6, 128.8, 128.0, 121.3, 120.5, 21.0; IRν: 3 254(N—H), 3 058(=CH), 3 033(=CH), 1 661(C=O), 1 623(C=C), 1 597(C=C), 1 513(N—H) cm-1; EI-MSm/z: 237.1[M+], 131.1[C8H7CO+]。
N-(4-甲氧基苯基)-肉桂酰胺(3e): m.p.168.8~170.4 ℃;1H NMRδ: 7.89(s, 1H, NH), 7.72(d,J=15.5 Hz, 1H,β-H), 7.55(d,J=8.6 Hz, 2H, ArH), 7.45(dd,J=6.8 Hz, 2.8 Hz, 2H, ArH), 7.32(dd,J=5.2 Hz, 1.9 Hz, 3H, ArH), 6.92~6.77(m, 2H, ArH), 6.60(d,J=15.6 Hz, 1H,α-H), 3.76(s, 3H, CH3);13C NMRδ: 164.05, 156.41, 141.81, 134.64, 131.17, 129.78, 128.78, 127.87, 121.85, 120.98, 114.13, 55.41; IRν: 3 261(N—H), 3 058(=CH), 3 024(=CH), 1 661(C=O), 1 623(C=C), 1 598(C=C), 1 541(N—H) cm-1; EI-MSm/z: 253.1[M+], 131.1[C8H7CO+]。
N-(2-氯苯基)-肉桂酰胺(3f): m.p.140.6~141.8 ℃;1H NMRδ: 8.51(d,J=7.6 Hz, 1H, NH), 7.87(s, 1H, ArH), 7.76(d,J=15.6 Hz, 1H,β-H), 7.54~7.53(br, 2H, ArH), 7.38(br, 4H, ArH), 7.27(t,J=8.0 Hz, 1H, ArH), 7.03(t,J=7.6 Hz, 1H, ArH), 6.61(d,J=15.6 Hz, 1H,α-H);13C NMRδ: 163.9, 143.0, 134.8, 134.5, 130.2, 129.1, 128.9, 128.1, 127.8, 124.8, 122.9, 121.9, 120.6; IRν: 3 234(N—H), 3 057(=CH), 3 043(=CH), 1 663(C=O), 1 628(C=C), 1 540(N—H) cm-1; EI-MSm/z: 257.0[M+], 131.1[C8H7CO+]。
N-(3-氯苯基)-肉桂酰胺(3g): m.p.127.6~128.6 ℃;1H NMRδ: 8.22(s, 1H, NH), 7.74(d,J=16.8 Hz, 2H,β-H), 7.52(d,J=8.0 Hz, 1H, ArH), 7.42(d,J=7.2 Hz, 2H, ArH), 7.33~7.25(m, 3H, ArH), 7.21(t,J=8.0 Hz, 1H, ArH), 7.07(d,J=8.0 Hz, 1H, ArH), 6.63(d,J=15.6 Hz, 1H,α-H);13C NMRδ: 164.6, 143.0, 139.3, 134.7, 134.4, 130.2, 130.1, 128.9, 128.0, 124.5, 120.5, 120.3, 118.2; IRν: 3 170(N—H), 3 031(=CH), 1 663(C=O), 1 651(C=C), 1 596(N—H) cm-1; EI-MSm/z: 257.0[M+], 131.0[C8H7CO+]。
N-(4-氯苯基)-肉桂酰胺(3h): m.p.190.0~192.1 ℃;1H NMRδ: 10.37(s, 1H, NH), 7.77~7.75(m, 2H,β-H, ArH), 7.65~7.61(m, 3H, ArH), 7.46~7.38(m, 5H, ArH), 6.84(dt,J=15.6 Hz, 2.8 Hz, 1H,α-H);13C NMRδ: 168.9, 145.8, 143.4, 139.9, 135.1, 134.2, 133.9, 133.0, 132.2, 127.2, 126.0; IRν: 3 296(N—H), 3 094(=CH), 3 027(=CH), 1 661(C=O), 1 624(C=C), 1 591(C=C), 1 533(N—H) cm-1; EI-MSm/z: 257.0[M+], 131.1[C8H7CO+]。
N-(4-硝基苯基)-肉桂酰胺(3i): m.p.231.9~234.9 ℃;1H NMRδ: 10.82(s, 1H, NH), 8.24(br, 2H,β-H, ArH), 7.95(d,J=9.2 Hz, 2H, ArH), 7.70~7.65(m, 3H, ArH), 7.48~7.43(m, 3H, ArH), 6.86(d,J=15.6 Hz, 1H,α-H);13C NMRδ: 169.5, 150.7, 146.9, 139.6, 135.4, 134.3, 133.2, 130.3, 126.6, 124.1, 117.6; IRν: 3 364(N—H), 3 063(=CH), 3 027(=CH), 1 693(C=O), 1 632(C=C), 1 596(C=C), 1 541(N—H) cm-1; EI-MSm/z: 268.1[M+], 131.1[C8H7CO+]。
N,N-二苯基肉桂酰胺(3j): m.p.158.9~161.8 ℃;1H NMRδ: 7.77(d,J=15.6 Hz, 1H,β-H), 7.40~7.25(m, 15H, ArH), 6.48(d,J=15.6 Hz, 1H,α-H);13C NMRδ: 166.1, 142.7, 142.5, 135.0, 129.7, 129.2, 128.7, 127.9, 119.7; IRν: 3 050(=CH), 1 661(C=O), 1 615(C=C) cm-1; EI-MSm/z: 299.2[M+], 131.1[C8H7CO+]。
2结果与讨论
2.1合成
以3a的合成为模板反应,考察了DMAc用量,酰氯化反应时间和酰胺化反应时间对产率的影响,优化了合成反应条件。
(1) DMAc用量
1 10 mmol,r=n(1) ∶n(SOCl2) ∶n(2a)=1.0 ∶1.2 ∶1.0, CH2Cl26 mL,其余反应条件同1.2,考察DMAc用量对3a产率的影响,结果见表1。
由表1可见,DMAc对反应有显著的促进作用。当DMAc用量为4 mL时,产率最高(96.0%, Entry 3)。继续增大DMAc用量,反应产率基本稳定(Entry 3~5)。只加入DMAc,产率反而大大降低(64.2%)。其原因在于: CH2Cl2对反应产生的固体有助溶作用。因此,DMAc的最佳用量为4 mL。
表1DMAc用量对3a产率的影响*
Table 1Effect of DMAc dosage on yield of 3a
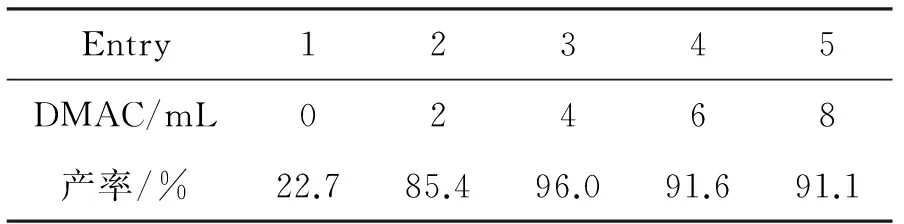
Entry12345DMAC/mL02468产率/%22.785.496.091.691.1
*1 10 mmol,r=1.0 ∶1.2 ∶1.0, CH2Cl26 mL,其余反应条件同1.2。

表2 酰氯化反应时间对3a产率的影响*
*1 10 mmol, DMAc 4 mL,其余反应条件同表1。
(2) 酰氯化反应时间
1 10 mmol, DMAc 4 mL,其余反应条件同2.1(1),考察酰氯化反应时间对3a产率的影响,结果见表2。
由表2可见,酰氯化反应时间为20 min时,产率最高(96.5%, Entry 3)。随着反应时间延长,产率反而有所降低(Entry 4~6)。因此,最佳酰氯化反应时间为20 min。
(3) 酰胺化反应时间
1 10 mmol, DMAc 4 mL, CH2Cl26 mL,酰氯化反应时间为20 min,其余反应条件同2.1(1),考察成酰胺化反应时间对反应产率的影响,结果见表3。

表3 酰胺化反应时间对3a产率的影响*
*1 10 mmol, DMAc 4 mL,酰氯化反应时间为20 min,其余反应条件同表1。
由表3可见,酰胺化反应时间为3 h时,产率最高(96.4%, Entry 6)。继续延长反应时间,收率反而有所降低(Entry 7)。因此,最佳酰胺化反应时间为3 h。
综上可见,合成3a的最优条件为:1 10 mmol,r=1.0 ∶1.2 ∶1.0, DMAc 4 mL, CH2Cl26 mL,酰氯化反应时间为20 min,酰胺化反应时间为3 h, 3a收率96.4%。
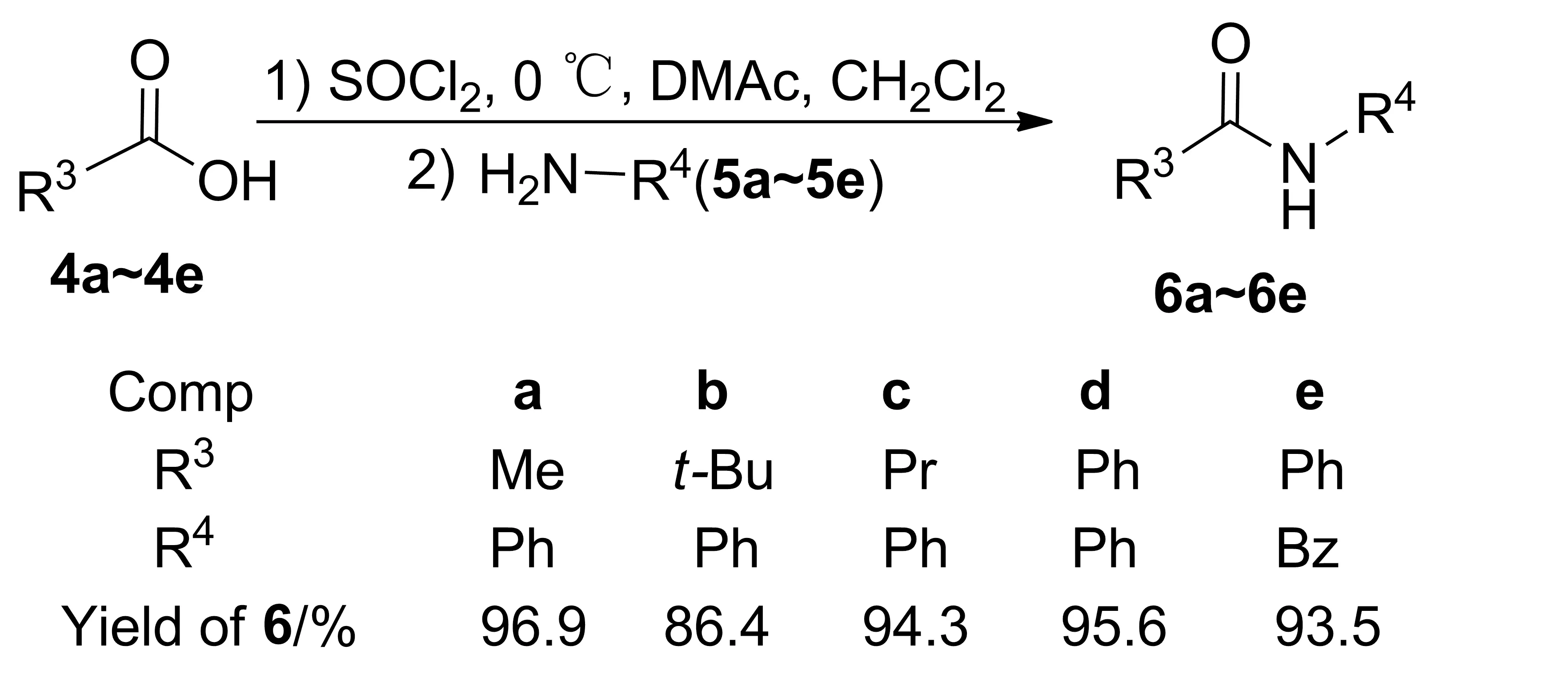
2.2反应拓展性
在优化条件下,对反应底物进行了拓展,考察了DMAc促进其它酰胺的反应,结果见Scheme 2。由Scheme 2可见,DMAc也能高效促进其他酰胺的合成,收率较高。该部分工作仍在继续进行中。
Scheme 2
2.3反应机理
DMAc促进反应进行的可能机理见Scheme 3:
(1) DMAc既是羧酸与SOCl2反应的催化剂,也是副产物HCl的缚酸剂,可促进酰氯生成。DMAc与SOCl2反应生成Vilsmeier-Hacck型盐(Ⅰ)[15-16]; Ⅰ与羧酸反应生成活性中间体(Ⅱ),羧基碳电正性增大,有利于Cl-进攻.Ⅱ。生成酰氯(Ⅲ)后,又释放出DMAc。此外,DMAc通过吸收HCl生成DMAc盐酸盐,使体系中“游离”的Cl-浓度增大,加速反应进行。
(2) DMAc盐酸盐释放的HCl催化酰氯与胺的反应,促进酰胺的生成。由于反应为“一锅法”操作,DMAc盐酸盐释放出的HCl与酰氯作用生成酰氯盐酸盐(Ⅳ),使酰氯羰基碳原子更容易接受胺分子中氮原子上非键电子对的进攻,从而加速酰胺反应进行。此外,HCl为酰胺反应的催化剂。

Scheme 3
以DMAc为促进剂,合成了10个N-取代肉桂酰胺(3a~3j)。该方法具有条件温和、操作简单、产率高等特点。
参考文献
[1]Ghose A K, Viswanadhan V N, Wendoloski J J. A knowledge-based approach in designing combinatorial or medicinal chemistry libraries for drug discovery.1.A qualitative and quantitative characterization of known drug databases[J].J Comb Chem,1999,1(1):55-68.
[2]Fagerlund A A, Sunnerheim K, Dimberg L H. Radical-scavenging and antioxidant activity of avenanthramides[J].Food Chem,2009,113(2):550-556.
[3]Lee M A M, Price R K, Strain J J,etal.Invitroantioxidant activity and antigenotoxic effects of avenanthramides and related compounds[J].J Agric Food Chem,2009,57(22):10619-10624.
[4]Zammit S C, Cox A J, Gow R M,etal. Evaluation and optimization of antifibrotic activity of cinnamoyl anthranilates[J].Bioorg Med Chem Lett,2009,19(24):700-7006.
[5]Pae H O, Jeong S O, Koo B S,etal. Tranilast,an orally active anti-allergic drug,up-regulates the anti-inflammatory heme oxygenase-1 expression but down-regulates the pro-inflammatory cyclooxygenase-2 and inducible nitric oxide synthase expression in RAW264.7 macrophages[J].Biochem Biophys Res Commun,2008,371(3):361-365.
[6]Sun X, Suzuki K, Nagata M,etal. Rectal administration of tranilast ameliorated acute colitis in mice through increased expression of heme oxygenase-1[J].Pathol Int,2010,60(2):93-101.
[7]Aymerick E, Edward E K B, Dominique L,etal. Production of tranilast [N-(3′,4′-dimethoxycinnamoyl)-anthranilic acid] and its analogs in yeast saccharomyces cerevisiae[J].Appl Microbiol Biotechnol,2011,89(4):989-1000.
[8]Zhang M, Lu X, Ye Y H,etal. Synthesis,structure,and biological assay of cinnamic amides as potential EGFR kinase inhibitors[J].Med Chem Res,2013,22(2):986-994.
[9]Lesetja L, Johann K, Anéipetzer J J,etal. Production of tranilast [N-(3′,4′-dimethoxycinnamoyl)-anthranilic acid] and its analogs in yeast saccharomyces cerevisiae[J].Eur J Med Chem,2011,46(10):5162-5174.
[10]David C C, Lei X Y, Manfred G R,etal. Design,synthesis,and biological evaluation of novel hybrid dicaffeoyltartaric/diketo acid and tetrazole-substituted l-chicoric acid analogue inhibitors of human immunodeficiency virus type 1 integrase[J].J Med Chem,2010,53(22):8161-8175.
[11]Bai J F, Zambron B K, Vogel P. Amides in one pot from carboxylic acids and amines via sulfinylamides[J].Org Lett,2014,16(2):604-607.
[12]Hussein M A. Synthesis,anti-inflammatory,and structure antioxidant activity relationship of novel 4-quinazoline[J].Med Chem Res,2013,22(10):4641-4653.
[13]Koenig R T, Dickman J R, Wise M L,etal. Effect of chemical systemic acquired resistance elicitors on avenanthramide biosynthesis in oat(Avena sativa)[J].J Agric Food Chem,2011,59(12):6438-6443.
[14]Raymond J C, Lisa D. Formation of acrylanilides, acrylamides,and amides directly from carboxylic acids using thionyl chloride in dimethylacetamide in the absence of bases[J].Org Process Res Dev,2006,10(5):944-946.
[15]Kimura Y, Matsuura D. Novel synthetic method for the Vilsmeier-Haack reagent and green routes to acid chlorides,alkyl formates,and alkyl chlorides[J].Int J Org Chem,2013,3(3A):1-7.
[16]郑大贵,周安西,祝显虹,等. 二甲基乙酰胺高效促进由醇制备氯代烃[J].有机化学,2016,36(1):137-142.
Dimethylacetamide-promoted Synthesis ofN-substituted Cinnamamides
LUO Nian-hua*,ZHENG Da-gui,ZHU Xian-hong,ZHOU An-xi,WANG Yong
(Key Laboratory of Applied Organic Chemistry, Higher Institutions of Jiangxi Province,Shangrao Normal University, Shangrao 334001, China)
Abstract:Ten N-substituted cinnamamides(3a~3j) were synthesized by chlorination of cinnamic acid with thionyl chloride in DMAc(4 mL) at 0 ℃ for 20 min, followed by amidation with arylamines at 25 ℃ for 3 h. The yield of 3a~3j were 85.8%~96.5%. The structures were confirmed by1H NMR,13C NMR, IR and EI-MS. The proposed mechanism for the promotion of DMAc for the reaction was suggested.
Keywords:dimethylacetamide; cinnamic acid; N-substituted cinnamamide; synthesis; promotion mechanism
收稿日期:2016-01-18
基金项目:江西省教育厅科技计划项目(GJJ151052); “信江英才866工程”领军人才培养计划项目(2013-37); 江西省大学生创新创业训练计划项目(201510416006)
作者简介:罗年华(1982-),男,汉族,江西吉安人,博士,讲师,主要从事不对称合成和方法学的研究。 E-mail: luoxiaoge102@163.com
中图分类号:O625.52
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.16023
