新型2-苯并噻唑磺酰脲氨基酸及其甲酯衍生物的合成与抗肿瘤活性
2016-06-12常霄巍巴俊杰
田 静, 常霄巍, 巴俊杰
(内蒙古医科大学 药学院,内蒙古 呼和浩特 010110)
·研究论文·
新型2-苯并噻唑磺酰脲氨基酸及其甲酯衍生物的合成与抗肿瘤活性
田静, 常霄巍, 巴俊杰*
(内蒙古医科大学 药学院,内蒙古 呼和浩特010110)
摘要:以2-巯基苯并噻唑为原料,经弱氧化和氨化制得2-苯并噻唑次磺酰胺(2); 2经高锰酸钾氧化制得2-苯并噻唑磺酰胺(3); 3与氯甲酸乙酯反应制得2-苯并噻唑磺酰胺甲酸乙酯(4); 4与L-氨基酸甲酯反应制得一系列2-苯并噻唑磺酰脲氨基酸甲酯(6a~6j); 6经水解合成了10个新型的2-苯并噻唑磺酰脲氨基酸(7a~7j),其结构经1H NMR, IR和ESI-MS表征。并研究了6和7对Cdc25B的抑制活性。结果表明:在用药浓度为20 μg·mL-1时,6c, 6j, 7d, 7h和7j对Cdc25B抑制活性较好,抑制率分别为78.1%, 71.2%, 65.6%, 57.2%和65.9%。
关键词:2-巯基苯并噻唑; L-氨基酸甲酯; 2-苯并噻唑磺酰脲氨基酸; 合成; 抗肿瘤活性
磺酰脲类化合物具有利尿、抗血栓、抗疟和抑菌等生物活性,且毒性较小,在医药和农药领域有广泛应用[1-4]。上世纪80年代末,研究人员在研究磺酰脲类口服降糖药的过程中发现,该类药物不但具有降糖作用,还对不同类型的肿瘤有一定的生长抑制作用[5]。通过深入研究该类化合物的生物活性,发现其对结肠癌、卵巢癌和肺癌等实体肿瘤抑制活性较好。目前,含磺酰脲结构的两种抗癌新药(LY186641和LY295501)已进入临床研究阶段[6-8]。

Scheme 1
细胞分裂周期25B(Cdc25B)是一种苏氨酸/酪氨酸双特异性蛋白磷酸酯酶,在细胞周期中有重要作用。尤其在G2/M期,它能促进细胞快速进入有丝分裂期[9-10]。Cdc25B是一种潜在的癌基因,可通过在人类乳腺癌、胃癌、肺癌、前列腺癌和淋巴癌等肿瘤细胞系中过度表达,导致肿瘤细胞生长和恶性转化。该基因被认为是一个新的治疗恶性肿瘤的药物靶点[11]。
本课题组长期从事芳基磺酰脲类化合物的合成与抗肿瘤活性研究[12-14]。在前期研究基础上,结合文献[15-19]成果,设计并合成了一系列新型的2-苯并噻唑磺酰脲氨基酸(7a~7j)及其甲酯衍生物(6a~6j)。以2-巯基苯并噻唑(1)为原料,经弱氧化和氨化制得2-苯并噻唑次磺酰胺(2); 2经高锰酸钾氧化制得2-苯并噻唑磺酰胺(3); 3与氯甲酸乙酯反应制得2-苯并噻唑磺酰胺甲酸乙酯(4); 4与L-氨基酸甲酯(5a~5j)反应制得6a~6j; 6经水解合成了7a~7j(Scheme 1),其结构经1H NMR, IR和ESI-MS表征。并研究了6和7对Cdc25B的抑制活性。
1实验部分
1.1仪器与试剂
XT-4A型熔点仪(温度未校正);ZF-1型紫外分析仪;Bruker Avance III 500型核磁共振仪(DMSO-d6为溶剂,TMS为内标);Affinity-1型红外光谱仪(KBr压片);Finnigan Lcq Advantage Max型质谱仪。
所用试剂均为分析纯。
1.2合成
(1) 2的合成[20]
冰盐浴冷却,在三口烧瓶中加入浓氨水112 mL,搅拌下于0~5 ℃同时滴加1 7.0 g(42 mmol)的1.78 mol·L-1氢氧化钠(28 mL)溶液和10%次氯酸钠溶液48 mL,滴毕(1 h),反应1 h。反应液抽滤,滤饼用水洗涤,真空干燥,用1,2-二氯乙烷重结晶得无色晶体2 6.3 g,收率82.5%, m.p.137~138 ℃。
(2) 3的合成[20]
在四口烧瓶中加入2 6.8 g(37 mmol),丙酮83 mL和蒸馏水40 mL,搅拌使其混合均匀;于28~30 ℃滴加50 g·L-1高锰酸钾溶液155 mL(用0.5 mol·L-1硫酸调至pH 8.0~8.1),滴毕(2 h),反应1 h。加入活性炭0.5 g和0.5 mol·L-1NaOH溶液11 mL,反应0.5 h。滤除二氧化锰和活性炭,滤液旋蒸除去丙酮,残余物用36%盐酸酸化,析出固体,抽滤,滤饼干燥,用1,2-二氯乙烷重结晶得无色晶体3 5.7 g,收率72.0%, m.p.176~177 ℃。
(3) 4的合成[21]
搅拌下,在三口瓶中加入3 1.5 g(7.0 mmol),碳酸钾2.9 g,水13 mL和丙酮13 mL,于5 ℃滴加氯甲酸乙酯1.0 g(10.5 mmol)和丙酮5 mL,滴毕,于5~10 ℃反应3 h(TLC检测)。加水120 mL,过滤,滤液用HCl调至pH 1,抽滤,滤饼用水洗涤至中性,真空干燥得白色固体4 1.7 g,收率84.8%, m.p.137~140 ℃。
(4) 6a~6j和7a~7j的合成(以6a和7a为例)
在三口瓶中加入L-苯丙氨酸甲酯盐酸盐(5a·HCl)392 mg(1.82 mmol)和甲苯30 mL,冰水浴冷却,搅拌下于0 ℃滴加三乙胺276 mg,反应2 h。安装精馏装置,加入4 0.5 g(1.75 mmol),加热,塔顶出馏分后补加等量甲苯(TLC检测);滤除甲苯,滤饼经硅胶柱层析[洗脱剂:V(二氯甲烷) ∶V(甲醇)=6 ∶1]纯化得淡黄色固体2-苯并噻唑磺酰脲-苯丙氨酸甲酯(6a)426 mg。
搅拌下,在反应瓶中加入6a和0.5 mol·L-1NaOH溶液40 mL(TLC检测),过滤,滤液滴加盐酸2 mL,滴毕,得白色固体2-苯并噻唑磺酰脲-苯丙氨酸(7a)357 mg。
用类似的方法合成淡黄色粉末6b~6j和白色粉末7b~7j。
6a: 收率58.0%, m.p.123~125 ℃;1H NMRδ: 8.10(d,J=8.0 Hz, 1H), 8.07(d,J=8.0 Hz, 1H), 7.53(t,J=7.5 Hz, 2H), 7.24~7.15(m, 5H), 6.33(d,J=8.0 Hz, 1H), 4.15(d,J=6.5 Hz, 1H), 3.34(s, 3H), 2.88~2.83(m, 2H); IRν: 3 385, 1 735, 1 617, 1 508, 1 375, 1 140 cm-1; ESI-MSm/z: 418.08{[M-H]-}。
6b: 收率86.8%, m.p.123~125 ℃;1H NMRδ: 8.09(d,J=8.0 Hz, 1H), 8.02(d,J=8.0 Hz, 1H), 7.54(t,J=7.5 Hz, 1H), 7.48(t,J=7.3 Hz, 1H), 6.43(d,J=7.0 Hz, 1H), 4.08~3.95(m, 1H), 3.53(s, 3H), 1.15(d,J=7.0 Hz, 3H); IRν: 3 390, 1 720, 1 380, 1 150, 1 620, 1 510 cm-1; ESI-MSm/z: 342.05{[M-H]-}。
6c: 收率63.3%, m.p.135~137 ℃;1H NMRδ: 8.09(d,J=5.0 Hz, 1H), 8.01(d,J=5.0 Hz, 1H), 7.55~7.46(m, 2H), 6.34(s, 1H), 3.59(d,J=5.0 Hz, 2H), 3.34(s, 3H); IR ν: 3 380, 1 740, 1 370, 1 130, 1 630, 1 510 cm-1; ESI-MSm/z: 328.09{[M-H]-}。
6d: 收率56.9%, m.p.120~123 ℃;1H NMRδ: 8.09(d,J=8.0 Hz, 1H), 8.00(d,J=8.0 Hz, 1H), 7.55~7.46(m, 2H), 6.46(d,J=7.5 Hz, 1H), 3.97(d,J=5.5 Hz, 1H), 3.64~3.51(m, 6H), 2.36~2.31(m, 2H), 1.86~1.72(m, 2H); IRν: 3 375, 1 730, 1 370, 1 145, 1 620, 1 520 cm-1; ESI-MSm/z: 414.12{[M-H]-}。
6e: 收率75.2%, m.p.117~119 ℃;1H NMRδ: 8.09(d,J=8.0 Hz, 1H), 8.02(d,J=8.5 Hz, 1H), 7.54(t,J=7.5 Hz, 1H), 7.48(t,J=7.5 Hz, 1H), 6.39(d,J=7.5 Hz, 1H), 4.01~3.97(m, 1H), 3.52(s, 3H), 1.59~1.57(m, 2H), 1.47~1.41(m, 1H), 0.89~0.77(m, 6H); IRν: 3 375, 1 746, 1 375, 1 150, 1 625, 1 528 cm-1; ESI-MSm/z: 384.39{[M-H]-}。
6f: 收率50.2%, m.p.154~156 ℃;1H NMRδ: 10.86(s, 1H), 8.08(d,J=8.0 Hz, 1H), 8.00(d,J=8.0 Hz, 1H), 7.54~7.42(m, 3H), 7.32(d,J=8.0 Hz, 1H), 7.14(s, 1H), 7.06~6.96(m, 2H), 6.19(d,J=7.5 Hz, 1H), 4.23(d,J=7.0 Hz, 1H), 3.47(s, 3H), 3.00~2.97(m, 2H); IR ν: 3 395, 1 732, 1 360, 1 132, 1 612, 1 510 cm-1; ESI-MSm/z: 457.15{[M-H]-}。
6g: 收率66.4%, m.p.127~129 ℃;1H NMRδ: 8.10(d,J=8.0 Hz, 1H), 8.00(d,J=8.0 Hz, 1H), 755~7.46(m, 2H), 6.23(d,J=8.5 Hz, 1H), 3.87(d,J=7.25 Hz, 1H), 3.33(s, 3H), 1.92~1.88(m, 1H), 0.87~0.80(m, 6H); IRν: 3 364, 1 750, 1 380, 1 140, 1 610, 1 530 cm-1; ESI-MSm/z: 370.21{[M-H]-}。
6h: 收率65.5%, m.p.125~127 ℃;1H NMRδ: 8.09(d,J=8.0 Hz, 1H), 8.00(d,J=8.0 Hz, 1H), 7.54(t,J=7.75 Hz, 1H), 7.47(d,J=7.5 Hz, 1H), 6.24(d,J=6.5 Hz, 1H), 3.93(t,J=7.0 Hz, 1H), 3.54(s, 3H), 1.64(s, 1H), 1.14~1.10(m, 2H), 0.86~0.81(m, 6H); IRν: 3 370, 1 740, 1 380, 1 150, 1 620, 1 528 cm-1; ESI-MSm/z: 384.39{[M-H]-}。
6i: 收率50.3%, m.p.157~159 ℃;1H NMRδ: 8.08(d,J=10.0 Hz, 1H), 8.00(d,J=10.0 Hz, 1H), 7.53~7.45(m, 2H), 6.94(d,J=5.0 Hz,2H), 6.67~6.61(m, 2H), 6.19(d,J=5.0 Hz, 1H), 4.08(d,J=5.0 Hz, 1H), 3.58(s, 3H), 2.75~2.71(m, 2H); IRν: 3 381, 1 727, 1 394, 1 136, 1 618, 1 515 cm-1; ESI-MSm/z: 434.17{[M-H]-}。
6j: 收率56.2%, m.p.132~134 ℃;1H NMRδ: 8.09(d,J=5.0 Hz, 1H), 8.01(d,J=5.0 Hz, 1H), 7.54(t,J=7.5 Hz, 1H), 7.47(t,J=7.5 Hz, 1H), 6.49(s, 1H), 4.24~4.21(m, 1H), 3.33(s, 3H), 2.50~2.43(m, 2H), 2.04~1.98(m, 5H); IRν: 3 395, 1 736, 1 380, 1 127, 1 654, 1 527 cm-1; ESI-MSm/z: 402.15{[M-H]-}。
7a: 收率86.8%, m.p.167~169 ℃;1H NMRδ: 8.10(d,J=8.0 Hz, 1H), 8.04(d,J=8.0 Hz, 1H), 7.55(t,J=7.5 Hz, 1H), 7.48(t,J=7.5 Hz, 1H), 7.06(s, 5H), 5.63(s, 1H), 3.78(s, 1H), 2.91~2.87(m, 2H); IRν: 3 429, 1 750, 1 421, 1 132, 1 650, 1 515 cm-1; ESI-MSm/z: 403.94{[M-H]-}。
7b: 收率69.5%, m.p.141~143 ℃;1H NMRδ: 12.79(s, 1H), 8.35~8.20(m, 2H), 7.72~7.65(m, 2H), 7.05(d,J=6.5 Hz, 1H), 4.04~4.00(m, 1H), 1.24(d,J=7.5 Hz, 3H); IR ν: 3 372, 1 745, 1 459, 1 173, 1 657, 1 536 cm-1; ESI-MSm/z: 327.84{[M-H]-}。
7c: 收率56.5%, m.p.162~164 ℃;1H NMRδ: 12.64(s, 1H), 8.29(d,J=10.0 Hz, 1H), 8.20(d,J=10.0 Hz, 1H), 7.71~7.65(m, 2H), 6.90(s, 1H), 3.67(d,J=5.0 Hz, 2H); IRν: 3 373, 1 715, 1 373, 1 155, 1 675, 1 536 cm-1; ESI-MSm/z: 313.94{[M-H]-}。
7d: 收率50.5%, m.p.163~165 ℃;1H NMRδ: 8.09(d,J=7.5 Hz, 1H), 8.03(d,J=8.0 Hz, 1H), 7.55~7.46(m, 2H), 5.85(d,J=5.5 Hz, 1H), 4.08(s, 1H), 2.18~2.09(m, 2H), 1.98~1.87(m, 2H); IRν: 3 396, 1 739, 1 398, 1 132, 1 657, 1 555 cm-1; ESI-MSm/z: 385.94{[M-H]-}。
7e: 收率68.6%, m.p.133~135 ℃;1H NMRδ: 12.87(s, 1H), 8.31~8.18(m, 2H), 7.72~7.65(m, 2H), 6.96(d,J=8.0 Hz, 1H), 4.03~4.01(m, 1H), 1.52~1.46(m, 3H), 0.81(d,J=6.5 Hz, 3H), 0.73(d,J=6.0 Hz, 3H); IRν: 3 370, 1 739, 1 363, 1 173, 1 698, 1 541 cm-1; ESI-MSm/z: 369.80{[M-H]-}。
7f: 收率49.1%, m.p.179~181 ℃;1H NMRδ: 10.59(s, 1H), 8.12~8.03(m, 2H), 7.55~7.43(m, 3H), 6.96~6.77(m, 4H), 5.69(d,J=6.5 Hz, 1H, 3.84(d,J=5.0 Hz, 1H), 3.06~2.93(m, 2H); IRν: 3 370, 1 739, 1 390, 1 132, 1 658, 1 554 cm-1; ESI-MSm/z: 442.96{[M-H]-}。
7g: 收率59.3%, m.p.154~156 ℃;1H NMRδ: 12.95(s, 1H), 8.19(d,J=7.0 Hz, 1H), 8.15(d,J=7.0 Hz, 1H), 7.71(d,J=7.0 Hz, 1H, 7.68(d,J=7.0 Hz, 1H), 6.79(s, 1H), 3.94(d,J=4.5 Hz, 1H), 2.06~2.01(m, 1H), 0.98(t,J=2.75 Hz, 6H); IRν: 3 395, 1 718, 1 370, 1 173, 1 655, 1 521 cm-1; ESI-MSm/z: 355.81{[M-H]-}。
7h: 收率60.5%, m.p.140~142 ℃;1H NMRδ: 8.08(d,J=8.0 Hz, 1H), 8.01(d,J=8.0 Hz, 1H), 7.53(t,J=7.75 Hz, 1H), 7.46(t,J=7.75 Hz, 1H), 5.72(d,J=6.5 H, 1H), 3.59~3.48(m, 1H), 1.66~1.60(m, 1H), 1.23~1.20(m, 2H), 0.78~0.76(m, 6H); IRν: 3 389, 1 725, 1 390, 1 139, 1 657, 1 582 cm-1; ESI-MSm/z: 370.05{[M-H]-}。
7i: 收率50.8%, m.p.168~170 ℃;1H NMRδ: 8.10(d,J=5.0 Hz, 1H), 8.02(d,J=5.0 Hz, 1H), 7.54~7.46(m, 2H), 6.86(d,J=5.0 Hz, 2H), 6.49(d,J=5.0 Hz, 2H), 5.58(s, 1H), 3.59~3.55(m, 1H), 2.51~2.49(m, 2H); IRν: 3 400, 1 700, 1 400, 1 118, 1 600, 1 518 cm-1; ESI-MSm/z: 419.98{[M-H]-}。
7j: 收率54.4%, m.p.156~158 ℃;1H NMRδ: 8.08(d,J=5.0 Hz, 1H), 8.01(d,J=5.0 Hz, 1H), 7.54~7.45(m, 2H), 5.85(s, 1H), 4.25(m,1H), 2.50(t,J=5.0 Hz, 2H), 2.38~1.91(m, 5H); IRν: 3 400, 1 682, 1 345, 1 127, 1 654, 1 572 cm-1; ESI-MSm/z: 388.15{[M-H]-}。
1.3抗肿瘤活性测定
6, 7和阳性对照物(Na3VO4)用DMSO配制为20 μg·mL-1溶液。加入96孔板,每孔2 μL,加入Cdc25B酶液20 μL,于4 ℃孵育5 min,加入底物OMFP 78 μL。用酶标仪于30 ℃测定波长535 nm处荧光值。计算酶初速度期内单位时间光吸收强度的增量,以此代表酶的初速度,然后计算抑制率[η=(vDMSO-vSample)/vDMSO×100%,其中,vSample为加药组初速度,vDMSO为空白组初速度]。
2结果与讨论
2.1合成
合成2时,NaClO溶液的活性氯含量对2收率影响较大。活性氯大于10%,收率较高。2性质不稳定,在空气中极易被氧化,需避免长时间与空气接触,最好直接投入下一步反应。
合成3时,反应温度和pH对3收率有较大影响。反应温度为28~30 ℃, pH 8.0~8.1, 3收率较高。
合成4时,投料比r[n(3)∶n(氯甲酸乙酯)∶n(K2CO3)]对4产率影响较大。r=1.0∶1.5∶3.0,收率最高。
合成6时,曾尝试先将3转化为2-苯并噻唑磺酰基异氰酸酯,再与5反应合成6。但由于2-苯并噻唑磺酰基异氰酸酯不易分离纯化而未能成功。
2.2表征(以6a为例)
(1)1H NMR
δ8.10, 8.07和7.53处吸收峰为苯环氢特征峰,δ6.33处吸收峰为苯胺仲酰胺氢特征峰,δ7.24~7.15处吸收峰为氨基酸苯环氢特征峰,δ4.15, 2.88~2.83处吸收峰为取代苯丙氨基酸氢特征峰,δ3.34处特征峰为取代基苯丙氨基酸甲酯上的甲基氢特征峰。
(2) IR
3 385 cm-1处吸收峰为仲酰胺N—H伸缩振动峰,1 735 cm-1处的尖锐强峰为羰基伸缩振动峰,1 375 cm-1和1 140 cm-1处吸收峰为SO2伸缩振动峰,1 617 cm-1和1 508 cm-1处吸收峰为苯环伸缩振动峰。
2.3抗肿瘤活性
表1为6和7对Cdc25B的抑制活性。由表1可见,以Na3VO4(IC50=1.51±0.23 μmol·L-1)为阳性对照,6c, 6j, 7d, 7h和7j对Cdc25B抑制活性较好,抑制率均大于50%。
由表1还可见,6和7的抑制活性没有显著差别,说明羧基不是必须的构效基团,这与文献[16]报道有所不同。6和7的氨基酸或氨基酸酯部分含硫原子,抑制活性较好(6j和7j)。
表16和7对Cdc25B的抑制活性*
Table 1Inhibition activities of 6 and 7 against Cdc25B
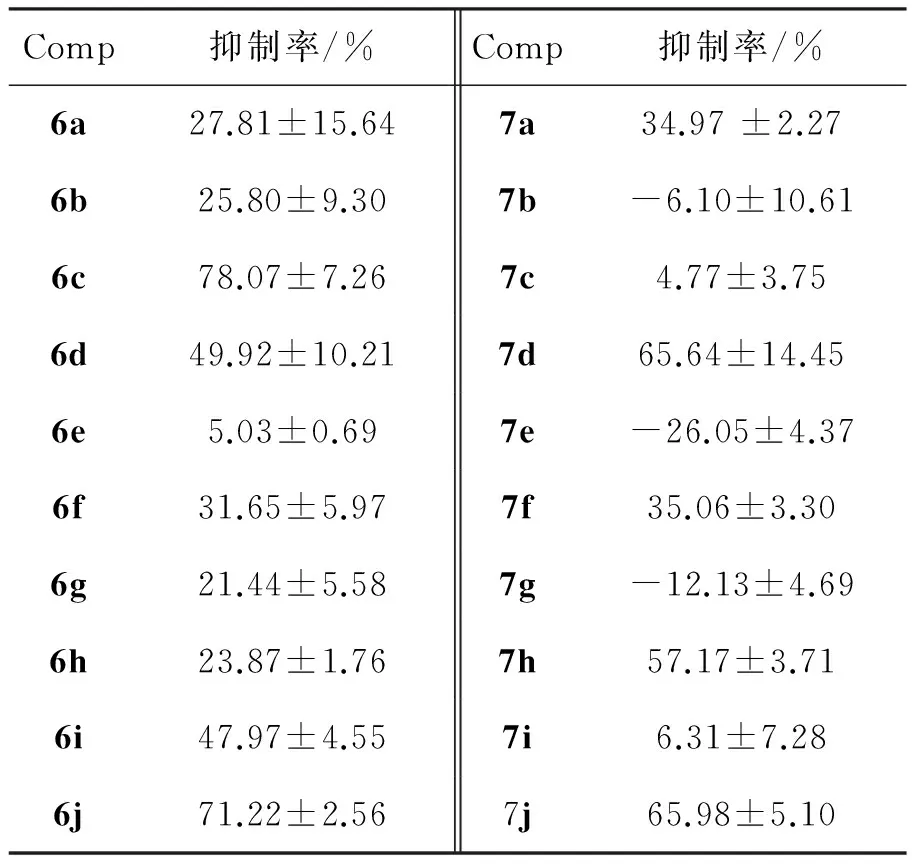
Comp抑制率/%Comp抑制率/%6a27.81±15.647a34.97±2.276b25.80±9.307b-6.10±10.616c78.07±7.267c4.77±3.756d49.92±10.217d65.64±14.456e5.03±0.697e-26.05±4.376f31.65±5.977f35.06±3.306g21.44±5.587g-12.13±4.696h23.87±1.767h57.17±3.716i47.97±4.557i6.31±7.286j71.22±2.567j65.98±5.10
*c=20 μg·mL-1
合成了一系列新型的2-苯并噻唑磺酰脲氨基酸及其甲酯(6a~6j和7a~7j)。初步的体外活性测试结果表明:在用药浓度20 μg·mL-1下,6c, 6j, 7d, 7h和7j对Cdc25B抑制活性较好,抑制率分别为78.1%, 71.2%, 65.6%, 57.2%和65.9%。6和7的结构优化和抗肿瘤活性研究正在进行中。
致谢:活性筛选实验由国家新药筛选中心协助完成,再次表示诚挚的谢意。
参考文献
[1]Simard J M, Woo S K, Schwartzbauer G T. Sulfonylurea receptor 1 in central nervous system injury:A focused review[J].Journal of Cerebral Blood Flow & Metabolism,2012,32:1699-1717.
[2]Woo S K, Kwon M S, Ivanov A,etal. The sulfonylurea receptor 1(sur1)-transient receptor potential melastatin 4(trpm4)channel[J].Bio Chem,2013,288(5):3655-3667.
[3]Leon C, Rodrigues J, Charris J,etal. Synthesis and evaluation of sulonylurea derivatives as novel antimalarials [J].Eur J Med Chem,2007,42(6):735-742.
[4]Pan L, Jiang Y, Liu Z,etal. Synthesis and evaluation of novel mono-subst-ituted sulfonylurea derivatives as antituberculosis agents[J].Eur J Med Chem,2012,50:18-26.
[5]Grindey G B. Identification of diarylsulfonylureas as novel anticancer drugs[J].Proc Am Assoc Cancer Res,1988,29:535-536.
[6]Houghton P J, Houghton J A. Antitumor diarylsulfonylureas: novel agents with unfulfilled promise[J].Invest New Drugs,1996,14(3):271-280.
[7]Kim S, Park J H, Koo S Y,etal. Novel diarylsulfonylurea derivatives as potent antimitotic agents[J]. Bioorganic & Medicinal Chemistry Letters,2004,14:6075-6078.
[8]Li H Q, Lv P C, Yan T. Urea derivatives as anticancer agents[J].Anti-Cancer Agents in Medicinal Chemistry,2009,9(4):471-480.
[9]Kumagai A, Dunphy W G. Regulation of the CDC25B protein during cycle in Xenopus extracts[J].Cell,1992,70(1):139-151.
[10]Mirey G, Chartrain I, Froment C,etal. CDC25B phosporylated by pEg3 localizes to centrosome and the spindle poles at mitosis[J].Cell Cycle,2005,4(6):806-811.
[11]Takemasa I, Yamamoto H, Sekimoto M,etal. Overexpression of CDC25B phospatase as a novel make of poor prognosis of human colorectal carcinoma[J].Cancer Res,2000,60(11):3043-3051.
[12]贾心语,苗娜,马丽娟,等.N-取代苯基-2-苯并噻唑磺酰脲类化合物的合成[J].中国药物化学杂志,2013,23(6):467-472.
[13]钱宇,田静,常霄巍,等. 新型N-取代苯基-9-烷基-3-咔唑磺酰脲类化合物的合成及其抗肿瘤活性[J].合成化学,2015,23(5):369-375.
[14]格根塔娜,王敏,巴俊杰. 新型N-取代苯基苯磺酰脲类化合物的合成[J].合成化学,2015,23(11):1040-1044.
[15]Mastrolorenzo A, Scozzafava A, Supuran C T. 4-Toluenesulfonylureido derivatives of amines, amino acids and dipeptides:A novel class of potential antitumor agents[J].European Journal of Pharmaceutical Sciences,2000,11:325-332.
[16]Yoshida M, Hayakawa I, Hayashi N,etal. Synthesis and biological evaluation of benzothiazole derivatives as potent antitumor agents[J].Bioorg Med Chem Lett,2005,15:3328-3332.
[17]Havrylyuk D, Mosula L, Zimenkovsky B,etal. Synthesis and anticancer activity evaluation of 4-thiazolidinones containing benzothiazole moiety[J].Eur J Med Chem,2010,45:5012-5021.
[18]Wenhua P Y, Jeman K L, Dug H H,etal. Induction of G2/M phase arrest and apoptosis by a new synthetic anticancer agent DW2282, in promyelocytic leukemia (Hl-60) cells[J].Biochem Pharmacol,2001,62(11):1439-1447.
[19]Park H, Bahn Y J, Jung S K,etal. Discovery of Novel Cdc25 Phosphatase Inhibitors with Micromolar Activity Based on the Structure-Based Virtual Screening[J].J Med Chem,2008,51(18):5533-5541.
[20]Woltersdorf O W, Schwam H, Bicking J B,etal. Topically active carbonic anhydrase inhibitors. 1.O-Acyl derivatives of 6-hydroxybenzothiazole-2-sulfonamide[J].J Med Chem,1989,32(11):2486-2492.
[21]陆阳,李春仁,池慧,等. 除草剂噻磺隆的合成[J].现代农药,2006,5(5):22-24.
Synthesis and Antitumor Activities of 2-Benzothiazolesulfonylureido Amino Acids and Their Methyl Esters
TIAN Jing,CHANG Xiao-wei,BA Jun-jie*
(School of Pharmacy, Inner Mongolia Medical University, Hohhot 010110, China)
Abstract:2-Benzothiazolesulfenamide(2) was prerared by oxidation and amination from 2-mercapto benzothiazole(1). 2-Benzothiazolesulfonamide(3) was obtained by potassium permanganate oxidation of 2. 2-Benzothiazolesulfonamide ethyl formate(4) was synthesized by reaction of 3 with ethyl chlorocarbonate. Ten novel 2-benzothiazolesulfonylureido amino acids(7a~7j) were prepared by reaction of 4 with L-amino acids, then hydrolyzing by NaOH. The structures were characterized by1H NMR, IR and ESI-MS. The inhibitory activities of 6 and 7 against Cdc25B were investgated. The results showed that 6c, 6j, 7d, 7h and 7j exhibited good inhibitory activities at 20 μg·mL-1with inhibition rate of 78.1%, 71.2%, 65.6%, 57.2% and 65.9%, respectively。
Keywords:2-mercapto benzothiazole; L-amino acid methyl ester; 2-benzothiazolesulfonylureido amino acid; synthesis; antitumor activity
收稿日期:2016-02-19
基金项目:内蒙古自治区自然科学基金资助项目(2013MS1210); 内蒙古自治区高等学校科学研究项目(NJZY13427)
作者简介:田静(1989-),女,汉族,内蒙古鄂尔多斯人,硕士研究生,主要从事药物合成的研究。通信联系人: 巴俊杰,教授, E-mail: bajunjie1982@sina.com
中图分类号:O626.25; O629.71
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.16045
