三联吡啶修饰的新型苯并二噻吩电子给-受体分子的合成及性能研究
2016-06-12李凡超乔洪冰戚顺新陈炳刚陈学刚
李凡超, 柳 林, 乔洪冰, 戚顺新, 陈炳刚, 陈学刚
(青岛科技大学 高分子科学与工程学院 橡塑材料与工程教育部重点实验室,山东 青岛 266042)
·研究论文·
三联吡啶修饰的新型苯并二噻吩电子给-受体分子的合成及性能研究
李凡超, 柳林, 乔洪冰, 戚顺新, 陈炳刚, 陈学刚*
(青岛科技大学 高分子科学与工程学院 橡塑材料与工程教育部重点实验室,山东 青岛266042)
摘要:以4,8-二酮苯并[1,2-b ∶4,5-b′]二噻吩为原料,合成了两种新型的2,2′ ∶6′,2″-三联吡啶修饰的苯并二噻吩电子给-受体结构分子(M1和M2),其结构经1H NMR,13C NMR, IR和元素分析表征。用UV-Vis, FL, TGA和CV研究了M1和M2的性能。结果表明:M1和M2均具有良好的热稳定性,热分解温度(T5)分别为335 ℃和430 ℃。由于电子给-受体结构的存在,M1和M2均表现出明显的分子内电荷转移跃迁(ICT),其最大吸收峰分别为446 nm和468 nm,荧光发射峰分别为517 nm和552 nm;起始还原电位分别为-0.57 eV和-0.62 eV,起始氧化电位分别为0.69 eV和0.87 eV。
关键词:2,2′ ∶6′,2″-三联吡啶; 苯并[1,2-b ∶4,5-b′]二噻吩; 电子给-受体; 合成; 性能
有机共轭分子具有分子结构确定,纯化简单,电荷迁移率较高和光电性能良好等优点,在场效应晶体管、催化传感、光伏等领域发展迅速。其中,苯并[1,2-b∶4,5-b′]二噻吩(BDT)及其衍生物因具有高度的平面共轭结构和高载流子迁移率而备受关注。侯剑辉等[1]首次在用于太阳能电池的共轭聚合物中引入了BDT单元。Huo等[2]成功将噻吩拼接至BDT的中心苯环上,合成了含噻吩侧链的苯并二噻吩。陈永胜等[3]将由烷氧基修饰中心苯环的BDT单元引入有机共轭小分子,改善了小分子成膜性差、填充因子低等缺点[4-5]。
2,2′ ∶6′,2″-三联吡啶(TPY)是一种典型的三齿配体,在超分子化学和超分子材料中有广泛应用。TPY的4′-位比较易于修饰,可通过引入适宜官能团实现性能调控。近年来,将TPY单元引入分子材料,改善其光电性能已成为研究热点。Yuan等[6]报道了线型和星型TPY衍生物在乙腈溶液中具有较强的蓝色荧光现象。Emmerling等[7]通过在TPY的4′-位上引入多种取代基,发现其荧光特性发生了明显变化。
基于此,本文将具有给电子性的BDT单元和具有吸电子性的TPY单元结合,合成结构新颖的电子给-受体分子,以期获得性能良好的化合物。以4,8-二酮苯并[1,2-b∶4,5-b′]二噻吩(1)为原料,合成了2种新型的2,2′ ∶6′,2″-三联吡啶修饰的苯并二噻吩电子给-受体结构分子(M1和M2, Scheme 1),其结构经1H NMR,13C NMR, IR和元素分析表征。用UV-Vis, FL, TGA和CV研究了M1和M2的性能。
Scheme 1
1实验部分
1.1仪器与试剂
Hitachi U-4100型紫外-可见分光光度计;Hitachi F-4600型荧光光谱仪;Bruker Avance 500型核磁共振谱仪(CDCl3为溶剂,TMS为内标);Bruker tensor 27型红外光谱仪(KBr压片);Vario E L型元素分析仪;Netzsch TG 209F1型热重分析仪(氮气保护下,以10 ℃·min-1的升温速率升至800 ℃);Autolab PGSTAT 204型电化学工作站(铂电极为工作电极,Ag/AgCl电极为参比电极,铂丝为对电极,二氯甲烷为溶剂,四丁基高氯酸铵为支持电解质,溶液浓度:0.1 mol·L-1,扫描速率:100 mV·s-1)。
4′-(对溴苯基)-2,2′ ∶6′,2″-三联吡啶,4′-(对频哪醇硼酸酯苯基)-2,2′ ∶6′,2″-三联吡啶[8],2-(2-辛基十二烷基)噻吩[9]和1[1]按文献方法合成;其余所用试剂均为分析纯。
1.2合成
(1) 4,8-二(2-辛基十二烷氧基)苯并[1,2-b∶4,5-b′]二噻吩(2)的合成
在三口烧瓶中加入1 880 mg(4.0 mmol),锌粉572 mg(8.8 mmol)和去离子水20 mL,氮气保护下加入NaOH 4 g,回流反应1 h。加入1-溴-2-辛基十二烷4.332 g(12.0 mmol)和催化量四丁基溴化铵(TBAB),回流反应12 h。倾入冰水中,用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥后经硅胶柱层析[洗脱剂A:V(正己烷) ∶V(二氯甲烷)=4 ∶1]纯化得无色液体2 2.526 g,收率80.6%;1H NMRδ: 7.48(d,J=5.5 Hz, 2H), 7.37(d,J=5.5 Hz, 2H), 4.18(d,J=5.2 Hz, 4H), 1.86(m, 2H), 1.66~1.28(m, 64H), 0.90(m, 12H)。
(2) 2,6-二溴-4,8-二(2-辛基十二烷氧基)苯并[1,2-b∶4,5-b′]二噻吩(3)的合成
在反应瓶中加入2 1.566 g(2.0 mmol)和二氯甲烷20 mL,搅拌使其溶解;冰水浴冷却下,缓慢滴加溴素0.22 mL(4.0 mmol)的二氯甲烷(20 mL)溶液,滴毕,于室温反应6 h。旋蒸除溶后经硅胶柱层析(洗脱剂:A=8 ∶1)纯化得白色固体3 1.428 g,收率75.9%;1H NMRδ: 7.41(s, 2H), 4.08(d,J=5.3 Hz, 4H), 1.81(m, 2H), 1.60~1.27(m, 64H), 0.87(m, 12H)。
(3) M1的合成
在反应瓶中加入3 941 mg(1.00 mmol), 4′-(对频哪醇硼酸酯苯基)-2,2′ ∶6′,2″-三联吡啶957 mg(2.20 mmol)和THF 80 mL,搅拌使其溶解;加入碳酸钠2.120 g和去离子水8 mL,氮气保护下加入Pd(PPh3)423 mg,回流(80 ℃)反应24 h。用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥后经硅胶柱层析[洗脱剂B:V(二氯甲烷) ∶V(丙酮)=6 ∶1]纯化得黄色固体M1 817 mg,收率58.4%;1H NMRδ: 8.81(s, 4H), 8.77(d,J=4.0 Hz, 4H), 8.70(d,J=8.0 Hz, 4H), 7.99(d,J=8.0 Hz, 4H), 7.91(t,J=7.3 Hz, 4H), 7.87(d,J=8.0 Hz, 4H), 7.76(s, 2H), 7.38(t,J=6.0 Hz, 4H), 4.27(d,J=5.0 Hz, 4H), 1.97(m, 2H), 1.77~1.14(m, 64H), 0.89(m, 12H);13C NMRδ: 156.09, 155.92, 149.34, 149.05, 144.48, 142.72, 138.08, 136.95, 134.94, 132.83, 129.52, 127.80, 126.79, 123.87, 121.40, 118.57, 116.39, 39.24, 31.94, 31.36, 30.20, 29.77, 29.43, 27.07, 22.70, 14.11; IRν: 3 049, 3 010, 2 953, 2 921, 2 851, 1 266, 1 030 cm-1; Anal.calcd for C92H112N6O2S2: C 79.04, H 8.07, N 6.01; found C 79.52, H 8.01, N 5.94。
(4) 4,8-二[5-(2-辛基十二烷基)-2-噻吩]苯并[1,2-b∶4,5-b′]二噻吩(4)的合成
在反应瓶中加入2-(2-辛基十二烷基)噻吩1.87 g(5.12 mmol)和干燥THF 20 mL,搅拌使其溶解;氮气保护,冰水浴冷却下滴加2.2 mol·L-1正丁基锂的正己烷(2.56 mL)溶液,滴毕,于50 ℃反应2 h。加入1 280 mg(1.28 mmol)的THF(5 mL)溶液,于50 ℃反应3 h。冷却至室温,滴加SnCl2·2H2O 2.312 g的10%HCl(4.5 mL)溶液,滴毕,反应2 h。反应物倒入冰水(100 mL)中,用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥后经硅胶柱层析(洗脱剂:A)纯化得淡黄色液体4 651 mg,收率55.7%;1H NMRδ: 7.64(d,J=5.7 Hz, 2H), 7.44(d,J=5.7 Hz, 2H), 7.28(d,J=3.4 Hz, 2H), 6.88(d,J=3.3 Hz, 2H), 2.85(d,J=6.7 Hz, 4H), 1.72(m, 2H), 1.45~1.18(m, 64H), 0.87(m, 12H)。
(5) 2,6-二(三正丁基锡)-4,8-二[5-(25-辛基十二烷基)-2-噻吩]苯并[1,2-b∶4,5-b′]二噻吩(5)的合成
在反应瓶中加入4 370 mg(0.40 mmol)和干燥THF 20 mL,搅拌使其溶解;氮气保护下冷却至-78 ℃,滴加2.2 mol·L-1正丁基锂的正己烷(0.55 mL)溶液,滴毕(15 min),于室温反应2 h。冷却至-78 ℃,滴加三丁基氯化锡0.45 mL(1.62 mmol),滴毕,反应15 min;于室温反应过夜。用冰水(50 mL)淬灭反应,用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥后经中性氧化铝柱层析(洗脱剂:A=8 ∶1)纯化得淡黄色黏稠液体5 358 mg,收率59.3%;1H NMRδ: 7.70(s, 2H), 7.34(d,J=3.4 Hz, 2H), 6.88(d,J=3.3 Hz, 2H), 2.86(d,J=6.6 Hz, 4H), 1.73(m, 2H), 1.56(m, 12H), 1.45~1.18(m, 88H), 0.87(m, 30H)。
(6) M2的合成
在反应瓶中加入5 350 mg(0.23 mmol), 4′-(对溴苯基)-2,2′ ∶6′,2″-三联吡啶218 mg(0.56 mmol)和甲苯10 mL,搅拌使其溶解;氮气保护下,加入Pd(PPh3)412 mg,于110 ℃反应24 h。粗产物倒入水(150 mL)中,用二氯甲烷萃取,合并有机相,用无水硫酸钠干燥后经硅胶柱层析(洗脱剂:B)纯化得橙黄色固体M2 193 mg,收率52.6%;1H NMRδ: 8.77(s, 4H), 8.75(d,J=4.2 Hz, 4H), 8.69(d,J=7.9 Hz, 4H), 7.97(d,J=8.1 Hz, 4H), 7.95(s, 2H), 7.89(t,J=7.8 Hz, 4H), 7.85(d,J=8.1 Hz, 4H), 7.41(d,J=3.3 Hz, 2H), 7.37(t,J=6.0 Hz, 4H), 6.98(d,J=3.3 Hz, 4H), 2.93(d,J=6.6 Hz, 4H), 1.80(m, 2H), 1.42~1.21(m, 64H), 0.89(m, 12H);13C NMRδ: 156.05, 155.84, 149.56, 148.97, 146.08, 144.09, 139.13, 138.12, 137.71, 137.17, 137.00, 135.06, 127.93, 127.81, 126.93, 125.58, 123.95, 121.55, 119.61, 118.78, 40.11, 34.82, 33.51, 31.93, 30.08, 29.71, 29.38, 26.75, 22.68, 14.08; IRν: 3 063, 3 013, 2 952, 2 919, 2 850 cm-1; Anal.calcd for C100H116N6S4: C 78.49, H 7.64, N 5.49; found C 78.71, H 7.61, N 5.42。
2 结果与讨论
2.1光学性能
(1) UV-Vis
图1为M1和M2固体和在二氯甲烷(DCM)中的UV-Vis谱图。由图1可见,无论是固态还是溶液态,M1和M2均显示出三个吸收带。能量较高的两条吸收谱带,分别源于n-π*跃迁和π-π*跃迁。由于M1和M2的分子结构中均有电子给体(BDT单元)和电子受体(TPY单元),因此表现出典型的分子内电荷转移跃迁。M1的固态和在溶液中的吸收峰分别位于446 nm和423 nm; M2的固态和溶液中的吸收峰分别位于468 nm和424 nm。此外,由于M2中引入的供电单元(噻吩)导致其固态的平面性更好,供电性更强,使得M2固态时在低能两端的吸收峰比M1进一步红移(22 nm)。在溶液态中,M1和M2的低能量吸收峰位置差别并不大,其可能原因在于:溶液态时,噻吩单元与BDT核之间的自由旋转度较大,导致其共轭程度与M1接近,吸收光谱相差不大。

λ/nm
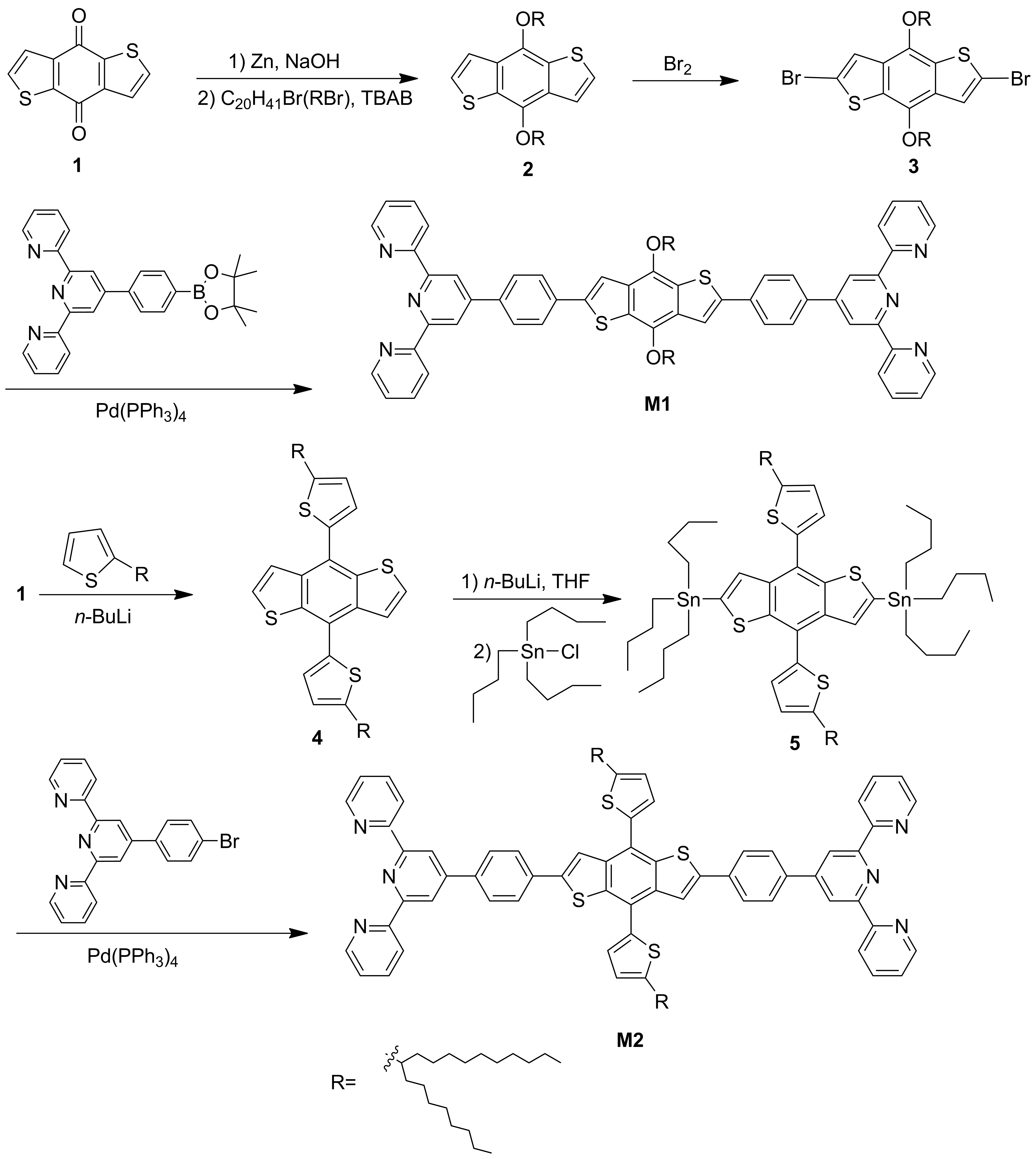
(2) FL
λ/nm
图2为M1和M2固体和在DCM中的FL谱图。由图2可见,M1的固态和在DCM中的最大发射峰分别位于517 nm和524 nm,相差不大。这是因为在M1的结构中,与苯并二噻吩结构相连的基团为烷氧基,在固态中对分子间的影响类似液态,因此发射峰比较接近。M2的固态和在溶液中的最大发射峰分别位于552 nm和490 nm。荧光发射峰出现明显红移(35 nm)的可能原因为:引入了强给体子体(噻吩单元),分子中BDT核的给电子能力增强,提高了分子中电子给-受体强度,增强了分子间在固态下的π-π相互作用,进而提高了平面性,共轭度增加。而在溶液态中,噻吩单元与苯并二噻吩之间的单键能以较大的自由度旋转,破坏了平面性,导致发射光谱发生蓝移。
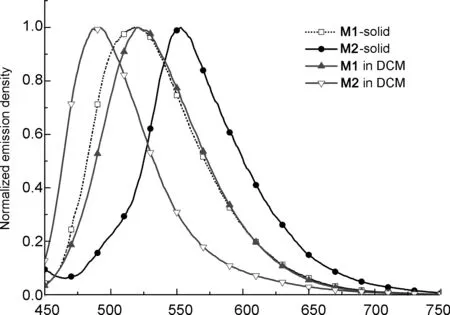
2.2热性能
图3为M1和M2的TGA曲线。由图3可见,M1和M2的热分解温度(T5)分别为335 ℃和430 ℃。M1与M2的热分解温度有较大差异,原因在于:M1用烷氧基修饰苯并二噻吩的中心苯环,M2用烷基噻吩修饰,噻吩基团使M2具有更大的有效共轭,且C—C键能大于C—O键能。
Temperature/℃
2.3电化学性能
图4为M1和M2的CV曲线。由图4可见,负向扫描过程中均出现了准可逆的还原过程,M1和M2的起始还原电位分别为-0.57 eV和-0.62 eV。该还原峰源于分子结构中TPY单元连续得到的电子被还原。M1和M2的电子受体结构单元相似,还原电位接近。正电位扫描过程中均出现了不可逆的氧化过程,M1和M2的起始氧化电位分别为0.69 eV和0.87 eV。尽管M1和M2的氧化行为类似,但M2中的噻吩单元与BDT单元具有高度共轭性,因此电化学稳定性更好,第一氧化电位更高。

Potential/V
3结论
合成了2种新型的2,2′ ∶6′,2″-三联吡啶修饰的苯并二噻吩电子给-受体结构分子(M1和M2)。M1和M2具有良好的热稳定性,其热分解温度(T5)分别为335 ℃和430 ℃。M1和M2均表现出明显的分子内电荷转移跃迁,其紫外-可见最大吸收峰分别为446 nm和468 nm,荧光发射峰分别为517 nm和552 nm;起始还原电位分别为-0.57 eV, -0.62 eV,起始氧化电位分别为0.69 eV, 0.87 eV。
参考文献
[1]Hou J H, Park M H, Zhang S Q,etal. Bandgap and molecular energy level control of conjugated polymer photovoltaic materials based on benzo[1,2-b∶4,5-b′]dithiophene[J].Macromolecules,2008,41(16):6012-6018.
[2]Huo L J, Zhang S, Guo X,etal. Replacing alkoxy groups with alkylthienyl groups:A feasible approach to improve the properties of photovoltaic polymers[J].Angew Chem,2011,50(41):9871-9876.
[3]Zhou J Y, Wan X J, Liu Y S,etal. Small molecules based on benzo[1,2-b∶4,5-b′]dithiophene unit for high-performance solution-processed organic solar cells[J].J Am Chem Soc,2012,134(39):16345-16351.
[4]Zhou J Y, Zuo Y, Wan X J,etal. Solution-processed and high-performance organic solar cells using small molecules with a benzodithiophene unit[J].J Am Chem Soc,2013,135(23):8484-8487.
[5]Kan B, Zhang Q, Liu F,etal. Small molecules based on alkyl/alkylthio-thieno[3,2-b]thiophene-substituted benzo[1,2-b∶4,5-b′]dithiophene for solution-processed solar cells with high performance[J].Chem Mater,2015,27(24):8414-8423.
[6]Yuan S C, Chen H B, Zhang Y,etal. Rigid linear and star-shapedπ-conjugated 2,2′ ∶6′,2″-terpyridine ligands with blue emission[J].Org Lett,2006,8(25):5701-5704.
[7]Emmerling F, Bricks J L, Resch-Genger U,etal. Influence of the donor substituent and acceptor alkylation on the structure-analytical properties of mono- and bifunctional biphenyl-type fluorescent reporters[J].Journal of Molecular Structure,2008,874(1-3):14-27.
[8]Zhou Y, Zhong C F, He Y,etal. Novel polymeric metal complexes of 2,7-bis[2-(2′-pyridyl)benzimidazole]-9,9′-dioctyluorene with Cu(II) and Zn(II):Synthesis and luminescence properties[J].Inorg Organomet Polym,2009,19(3):328-334.
[9]Mohanakrishnan A K, Amaladass P, Clement J A. Synthesis of end-blocked thienyl oligomers incorporating benzo[c]thiophene[J].Tetrahedron Lett,2007,48(5):779-784.
Synthesis and Properties of Novel Benzo[1,2-b∶4,5-b′]dithiophene Electron Donor-acceptor Molecules Modified with Terpyridine
LI Fan-chao,LIU Lin,QIAO Hong-bing,QI Shun-xin,CHEN Bing-gang,CHEN Xue-gang*
(Key Laboratory of Rubber-plastics, Ministry of Education, School of Polymer Science and Engineering,Qingdao University of Science and Technology, Qingdao 266042, China)
Abstract:Two novel benzo[1,2-b ∶4,5-b′]dithiophene electron donor-accepter molecules(M1 and M2) modified with terpyridine, were synthesized from 4,8-dihydrobenzo[1,2-b ∶4,5-b′]dithiophene-4,8-dione. The structures were charcterized by1H NMR,13C NMR, IR and elemental analysis. The properties of M1 and M2 were investgated by UV-Vis, FL, TGA and CV. The results indicated that M1 and M2 had excellent thermal stabilities and the decomposition temperatures of M1 and M2 were 335 ℃ and 430 ℃, respectively. Due to the donor-acceptor structures, the target molecules M1 and M2 showed obvious intramolecular charge transfer(ICT) transition. The maximum UV-Vis absorption peaks for M1 and M2 were 446 nm and 468 nm, and the fluorescence emission peaks were 517 nm and 552 nm, respectively. The initial oxidation potentials for M1 and M2 were -0.57 eV and -0.62 eV and the initial reduction potentials were 0.69 eV and 0.87 eV, respectively.
Keywords:2,2′∶6′,2″-terpyridine; benzo[1,2-b ∶4,5-b′]dithiophene; electron donor-acceptor; synthesis; property
收稿日期:2016-01-07
基金项目:国家自然科学基金资助项目(20804022); 山东省自然科学基金资助项目(ZR2011BMO01); 国家级大学生创新创业训练计划项目(201510426014)
作者简介:李凡超(1987-),男,汉族,山东烟台人,硕士研究生,主要从事功能高分子的研究。通信联系人: 陈学刚,博士,副教授, E-mail: xgchen@qust.edu.cn
中图分类号:O626.12; O626.32
文献标志码:A
DOI:10.15952/j.cnki.cjsc.1005-1511.2016.05.16013
