耐多药结核病快速诊断技术对耐二线药结核菌诊断价值的Meta分析*
2016-06-06马峻郭毅
马 峻 郭 毅
guoyi@whu.edu.cn
耐多药结核病快速诊断技术对耐二线药结核菌诊断价值的Meta分析*
马峻1郭毅2,#
guoyi@whu.edu.cn
【摘要】目的:Meta分析耐多药结核病快速诊断技术(Genotype MTBDRsl)对耐二线药结核菌研究中的临床诊断效能。方法:检索Pubmed、Embase和Cochrane图书馆等数据库从建库至2015-01有关Genotype MTBDRsl技术对耐二线药结核菌应用诊断的研究文献,采用QUADAS-2条目进行质量评估,符合纳入标准的研究应用Meta-Disc软件进行异质性检验,计算其合并灵敏度、特异度、阳性似然比、阴性似然比、诊断比值比及95%可信区间,建立受检者工作特征曲线(SROC),通过曲线下面积(AUC)评估Genotype MTBDRsl技术在诊断耐二线药结核菌中的价值,比较其对临床样本和培养株样本耐二线药的敏感度和特异度,并评价文献发表偏倚。结果:共纳入22篇文献,其整体研究的异质性较高,病例选择偏倚风险较高;耐氟喹诺酮类合并灵敏度、特异度和AUC分别为0.87、0.97和0.9690;耐阿米卡星分别为0.87、1.00和0.9944;耐卷曲霉素分别为0.88、0.97和0.9791;耐卡那霉素分别为0.50、0.99和0.9814;耐乙胺丁醇分别为0.69、0.87和0.7349,除耐阿米卡星特异度分布差异无统计学意义外(P>0.05),其它均有统计学意义(P<0.01)。Genotype MTBDRsl技术检测不同样本耐二线药的敏感度和特异度无统计学差异(P>0.05)。各研究不存在发表偏倚。结论:Genotype MTBDRsl技术在耐氟喹诺酮类,阿米卡星与卷曲霉素研究中具有较高诊断价值,但对耐卡那霉素和乙胺丁醇的诊断效能有待进一步提高。
【关键词】耐多药结核病快速诊断技术;二线药;结核菌;Meta分析
目前,结核病仍是威胁全球公共卫生安全的严重疾病之一,在我国的流行与传播更不容乐观,耐多药结核病(Multi-Drug Resistant Tuberculosis,MDR-TB)是导致疫情居高不下的重要原因[1],成为结核病防控难题。研究常用二线抗结核药物氟喹诺酮类、阿米卡星、卷曲霉素、卡那霉素和乙胺丁醇对多耐药、耐多药、泛耐药结核分枝杆菌感染的防治有极其重要的作用。由于传统药敏试验耗时耗力[2],给临床早期治疗与诊断带来诸多困难,采用分子生物学方法快速检测抗结核二线药耐药基因突变,快速报告结核临床株耐药情况受到临床欢迎。本文Meta分析国外使用耐多药结核病快速诊断技术(Genotype MTBDRsl)对耐二线药结核菌诊断效能,进一步评价临床应用价值。
1资料与方法
1.1检索方法
检索策略采用主题词与自由词结合,并根据具体数据库调整检索方法。为了减少漏查文献,由两名评价员单独检索并对纳入研究的参考文献进行再次检索。计算机检索Pubmed、Embase和Cochrane图书馆数据库。检索年限从建库至2015-01。检索语种为英语,检索词为“Genotype MTBDRsl” and “Tuberculosis” or “TB” or “TB Infection” or “TB Disease” or “Mycobacterium tuberculosis” or “Mycobacterium tuberculosis complex”。
1.2纳入和排除标准
纳入标准:(1)所有研究均以药敏结果作为“金标准”;(2)研究对象均应用Genotype MTBDRsl技术诊断耐二线药结核菌;(3)纳入研究的Genotype MTBDRsl检测和“金标准”检查的间隔时间不超过一个月;(4)纳入文献原始数据能够直接或间接计算出真、假阳性率等。
排除标准:(1)未使用Genotype MTBDRsl技术诊断耐二线药结核菌文献;(2)述评、文摘、讲座和综述等二次文献。
1.3质量评价
由两位评价者单独评价所纳入文献质量,当意见不一致时讨论解决。根据QUADAS-2条目[3]进行质量评价,每个研究逐条按照“是”、“否”、“不清楚”进行评价。“是”为满足该条目标准,“否”为不满足标准或文中未提及该标准,“不清楚”表示部分满足标准或者无法从该文献中得到充足的资料。
1.4统计学处理
使用MetaDisc 1.4和Stata 13.0软件进行数据分析。如I2>50%,提示异质性较高,则采用随机效应模型(D-L法)进行Meta分析;I2≤50%采用固定效应模型(M-H法)进行Meta分析。计算耐药真阳性值(True Resistance, TR)、真阴性值(True Susceptibility, TS)、假阳性值(False Resistance, FR)、假阴性值(False Susceptibility, FS),分析检测技术的灵敏度、特异度,阳性似然比(Positive Likelihood Ratio, PLR)、阴性似然比(Negative Likelihood Ratio,NLR)、诊断比值比(Diagnostic Odds Ratio,DOR)以及95%可信区间(Confidence Interval,CI),然后建立受检者工作特征曲线(Summary Receiver Operating Curve,SROC),并计算曲线下面积(AUC)以及Q值评估诊断价值。并分析检测技术对不同类型样本(临床样本和培养株)的灵敏度和特异度。通过Begg’s值定量分析发表偏倚。
2结果
2.1入选文献特征
预检出43篇英文文献,根据纳入标准和排除标准,审读各文献摘要后筛选得到25篇文献,最后通读全文纳入19篇文献[4-22],6篇为检测临床样本[4, 10, 11, 15, 16, 22]、13篇为检测临床培养株[5-9, 12-14, 17-21],其中3篇检测了两种样本[4,10,11],因此后文按纳入22篇文献进行分析。其基本特征见表1。

表1 纳入文献的基本特征
注:NA为不清楚
2.2纳入研究的质量评价
QUADAS-2 工具包括4项内容(图1A):病例选择、待评价试验、金标准和病例进展情况,用于评估偏倚风险;临床适用性评估不包括病例进展情况。纳入研究的偏倚风险和临床适用性评估结果为:病例选择和病例进展情况有较高偏倚风险,而待评价试验和金标准的偏倚风险较低。见表2和图1B。

表2 纳入文献质量评价
注:“↑”为低风险;“↑↑”为高风险;“?”为不清楚
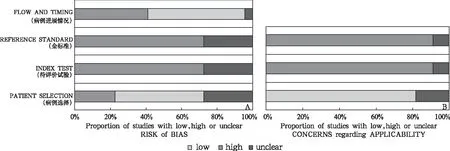
图1 文献质量评价结果
2.3Meta分析
2.3.1异质性分析:应用MetaDisc 1.4软件分析所有纳入研究耐氟喹诺酮类、阿米卡星、卷曲霉素、卡那霉素及乙胺丁醇数据的灵敏度差异均有统计学意义(χ2值分别为58.39、30.59、33.03、111.14、94.37,P<0.01),特异度除耐阿米卡星(χ2=11.49,P>0.05)外,其它差异均有统计学意义(χ2值分别为68.64、25.76、40.77、368.19,P<0.01);同时只有耐阿米卡星I2<50%,其余I2≥50%;提示整体研究的异质性较高。通过TR、TS、FR、FS计算的各研究采用Genotype MTBDRsl技术诊断耐二线抗结核药的灵敏度和特异度见图2。

注:图中横线长短表示95%可信区间范围的大小,线条中间大小各异的圆点表示灵敏度、特异度值的位置,圆点的大小为
2.3.2SROC的AUC分析:如图3,耐氟喹诺酮类、阿米卡星、卷曲霉素、卡那霉素和乙胺丁醇AUC分别为0.9690、0.9944、0.9791、0.9814和0.7349,Q值分别为0.9182、0.9707、0.9356、0.9398和0.6810。即耐乙胺丁醇AUC最小,诊断敏感度和特异度最低。

注:图A、B、C、D、E分别为耐氟喹诺酮类、阿米卡星、卷曲霉素、卡那霉素和乙胺丁醇SROC曲线
2.3.3不同类型样本耐二线药效能分析:采用Genotype MTBDRsl检测两种类型样本耐氟喹诺酮类、阿米卡星、卷曲霉素、卡那霉素和乙胺丁醇的特异度均高于0.94,敏感度除耐卡那霉素较低(0.44-0.67),其它均高于0.75。其中耐氟喹诺酮类、阿米卡星和卡那霉素以临床样本检测的灵敏度较高,耐卷曲霉素以培养株检测的敏感度较高;耐氟喹诺酮类特异度以临床样本较高,而耐阿米卡星、卷曲霉素和卡那霉素的特异度以培养株较高,但差异均无统计学意义(P>0.05)。见表3。
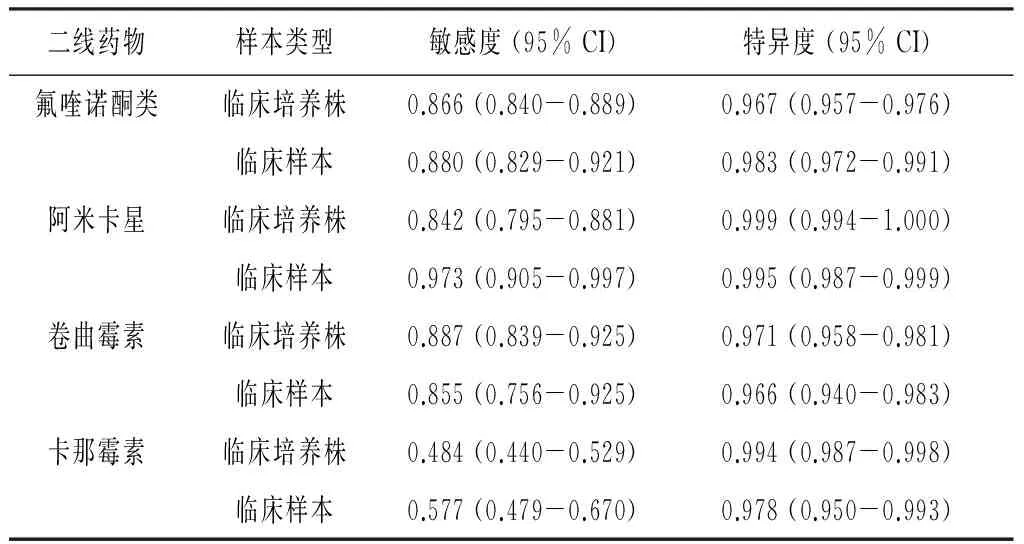
表3 两种样本耐二线药敏感度和特异度分析
2.3.4发表偏倚:使用Stata 13.0软件计算耐氟喹诺酮类、阿米卡星、卷曲霉素、卡那霉素和乙胺丁醇Begg’s值分别为0.43、-2.02、-0.42、0.18和0.49,对应P值均>0.05,表明各研究不存在明显发表偏倚。
3讨论
Genotype MTBDRsl技术来自德国Hain Lifescience公司,用于结核分枝杆菌对二线药物的耐药性检测,其原理是应用多重PCR结合反向杂交技术,与固定在硝化纤维膜条带上的特异耐药基因进行杂交后,根据显色条带判读耐药性及耐药突变位点,可在6h内获得结果,实现了结核分枝杆菌耐药性的快速检测。但该技术的应用评价不尽一致。循证医学方法可通过综合小样本数据,达到扩大样本量、减少抽样误差,增加分析结果的可靠性。本文通过选择较高质量文献Meta分析Genotype MTBDRsl技术诊断耐二线药结核菌的临床价值。
临床诊断性试验广泛使用QUADAS-2条目进行文献质量评估,主要从偏倚风险与临床适用性两方面评价异质性和偏倚的产生。偏倚风险包括病例选择、待评价试验、金标准、疾病进展情况,而临床适用性主要由前三者组成。本文纳入研究的偏倚风险包括:(1)病例选择偏倚,只有22.7%的研究为低风险,50.0%为高风险,这可能由于没有连续或随机纳入病例所致;(2)待评价试验偏倚,72.7%的研究为低风险,未出现高风险,说明大部分纳入研究的结果判读是在不知晓金标准试验结果的情况下进行的;(3)金标准偏倚,与待评价试验偏倚风险一样,72.7%文献为低风险,未出现高风险,说明大部分研究的诊断金标准可以正确区分是否耐二线结核药以及金标准结果判读采用了盲法;(4)疾病进展偏倚,54.5%的研究为高风险,提示不是所有病例都被纳入分析。临床适用性偏倚分析显示,81.8%的研究存在病例选择高风险,待评价试验与金标准不存在高风险。
本Meta分析表明,Genotype MTBDRsl技术除了诊断耐阿米卡星合并特异度不存在明显异质性外,其它耐二线药合并灵敏度和特异度均存在较大的异质性。异质性来源主要有:(1)Genotype MTBDRsl技术所检测样本类型不同;(2)纳入研究受试者来自不同国家、种族,其生活状况、疾病发生率等均有差异;(3)纳入研究受试者结核治疗方式、治疗时间长短不一;(4)检测人员经验与技术水平存在差异。本研究还表明Genotype MTBDRsl技术诊断耐氟喹诺酮类、阿米卡星、卷曲霉素、卡那霉素SROC的AUC和Q值均大于0.90,而耐乙胺丁醇SROC的AUC及Q值仅在0.70左右,提示Genotype MTBDRsl技术用于诊断耐乙胺丁醇结核菌不是一种很好的选择。Genotype MTBDRsl技术诊断耐卡那霉素及乙胺丁醇的合并灵敏度分别为0.50(95%CI 0.46-0.54)和0.69(95%CI 0.66-0.71),明显低于其它耐二线药的合并灵敏度(>0.80),这可能导致耐卡那霉素与乙胺丁醇结核菌漏诊;而且,Genotype MTBDRsl技术诊断耐乙胺丁醇的合并特异度也较低(0.87),有可能将乙胺丁醇敏感结核菌诊断为耐乙胺丁醇结核菌,引起误诊。本文根据样本类型分析了Genotype MTBDRsl技术对耐二线药的灵敏度和特异度,结果表明,临床样本和培养株样本类型不会影响Genotype MTBDRsl技术的诊断价值。但考虑本文纳入研究中只有6篇文献采用了临床样本,这可能缺乏说服力,需要纳入更多临床样本研究来进一步验证上述结论。Begg’s检验未发现本文纳入的各研究间存在显著发表偏倚,提示文献质量较高,结果具有一定的可信度。
本研究存在以下局限:各研究间样本数量差异较大,相关分析时可能得出假阳性结果;检索策略中虽然使用多种方法提高检索的全面性,但依然可能由于检索不全面而漏检一些有价值的文献;另外,纳入文献中只有6篇为临床样本,其余均为培养株样本,可能会导致各研究间检测价值差异较大。
综上所述,Genotype MTBDRsl技术诊断耐氟喹诺酮类、阿米卡星、卷曲霉素结核菌敏感度和特异度较高,但对耐卡那霉素和乙胺丁醇药诊断价值还需进一步提高。同时还需纳入更多针对临床样本检测的研究来进一步评估Genotype MTBDRsl技术检测临床样本的诊断价值。
◀
马峻(1971-),男,汉族,主管技师,主要从事结核菌耐药机制及分子诊断研究
参考文献
1Abubakar I, Zignol M, Falzon D, et al. Drug-resistant tuberculosis: time for visionary political leadership[J]. Lancet Infect Dis, 2013, 13(6):529-539.
2Garrigo M, Aragon LM, Alcaide F, et al. Multicenter laboratory evaluation of the MB/BacT Mycobacterium detection system and the BACTEC MGIT 960 system in comparison with the BACTEC 460TB system for susceptibility testing of Mycobacterium tuberculosis[J]. J Clin Microbiol, 2007, 45(6):1 766-1 770.
3Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8):529-536.
4Hillemann D, Rusch-Gerdes S, Richter E. Feasibility of the GenoType MTBDRsl assay for fluoroquinolone, amikacin-capreomycin, and ethambutol resistance testing of Mycobacterium tuberculosis strains and clinical specimens[J]. J Clin Microbiol, 2009, 47(6):1 767-1 772.
5Kiet VS, Lan NT, An DD, et al. Evaluation of the MTBDRsl test for detection of second-line-drug resistance in Mycobacterium tuberculosis[J]. J Clin Microbiol, 2010, 48(8):2 934-2 939.
6Brossier F, Veziris N, Aubry A, et al. Detection by GenoType MTBDRsl test of complex mechanisms of resistance to second-line drugs and ethambutol in multidrug-resistant Mycobacterium tuberculosis complex isolates[J]. J Clin Microbiol, 2010, 48(5):1 683-1 689.
7van Ingen J, Simons S, de Zwaan R, et al. Comparative study on genotypic and phenotypic second-line drug resistance testing of Mycobacterium tuberculosis complex isolates[J]. J Clin Microbiol, 2010, 48(8):2 749-2 753.
8Huang WL, Chi TL, Wu MH, et al. Performance assessment of the GenoType MTBDRsl test and DNA sequencing for detection of second-line and ethambutol drug resistance among patients infected with multidrug-resistant Mycobacterium tuberculosis[J]. J Clin Microbiol, 2011, 49(7):2 502-2 508.
9Kontsevaya I, Mironova S, Nikolayevskyy V, et al. Evaluation of two molecular assays for rapid detection of mycobacterium tuberculosis resistance to fluoroquinolones in high-tuberculosis and -multidrug-resistance settings[J]. J Clin Microbiol, 2011, 49(8):2 832-2 837.
10Lacoma A, Garcia-Sierra N, Prat C, et al. GenoType MTBDRsl for molecular detection of second-line-drug and ethambutol resistance in Mycobacterium tuberculosis strains and clinical samples[J]. J Clin Microbiol, 2012, 50(1):30-36.
11Miotto P, Cabibbe AM, Mantegani P, et al. GenoType MTBDRsl performance on clinical samples with diverse genetic background[J]. Eur Respir J, 2012, 40(3):690-698.
12Lopez-Roa P, Ruiz-Serrano MJ, Alcala L, et al. Susceptibility testing to second-line drugs and ethambutol by GenoType MTBDRsl and Bactec MGIT 960 comparing with agar proportion method[J]. Tuberculosis, 2012, 92(5):417-421.
13Tessema B, Beer J, Emmrich F, et al. First- and second-line anti-tuberculosis drug resistance in Northwest Ethiopia[J]. Int J Tuberc Lung Dis, 2012, 16(6):805-811.
14Said HM, Kock MM, Ismail NA, et al. Evaluation of the GenoType(R) MTBDRsl assay for susceptibility testing of second-line anti-tuberculosis drugs[J]. Int J Tuberc Lung Dis, 2012, 16(1):104-109.
15Ajbani K, Nikam C, Kazi M, et al. Evaluation of genotype MTBDRsl assay to detect drug resistance associated with fluoroquinolones, aminoglycosides and ethambutol on clinical sediments[J]. PLoS One, 2012, 7(11):e49433.
16Barnard M, Warren R, Gey Van Pittius N, et al. Genotype MTBDRsl line probe assay shortens time to diagnosis of extensively drug-resistant tuberculosis in a high-throughput diagnostic laboratory[J]. Am J Respir Crit Care Med, 2012, 186(12):1 298-1 305.
17Ignatyeva O, Kontsevaya I, Kovalyov A, et al. Detection of resistance to second-line antituberculosis drugs by use of the genotype MTBDRsl assay: a multicenter evaluation and feasibility study[J]. J Clin Microbiol, 2012, 50(5):1 593-1 597.
18Ferro BE, Garcia PK, Nieto LM, et al. Predictive value of molecular drug resistance testing of Mycobacterium tuberculosis isolates in Valle del Cauca, Colombia[J]. J Clin Microbiol, 2013, 51(7):2 220-2 224.
19Biadglegne F, Tessema B, Rodloff AC, et al. Magnitude of gene mutations conferring drug resistance in mycobacterium tuberculosis isolates from lymph node aspirates in ethiopia[J]. Int J Med Sci, 2013, 10(11):1 589-1 594.
20Singh AK, Maurya AK, Kant S, et al. Rapid detection of drug resistance and mutational patterns of extensively drug-resistant strains by a novel GenoType(R) MTBDRsl assay[J]. J Postgrad Med, 2013, 59(3):179-185.
21Jin J, Shen Y, Fan X, et al. Underestimation of the resistance of Mycobacterium tuberculosis to second-line drugs by the new GenoType MTBDRsl test[J]. J Mol Diagn, 2013, 15(1):44-50.
22Tukvadze N, Bablishvili N, Apsindzelashvili R, et al. Performance of the MTBDRsl assay in Georgia[J]. Int J Tuberc Lung Dis, 2014, 18(2):233-239.
The Diagnosis of Mycobacterium Tuberculosis Resistant to Second-Line Drugs with Genotype MTBDRsl Assay: A Meta-Analysis*
MA Jun1, GUO Yi2,#
1Department of Clinical Laboratory, Wuhan Medical Treatment Center, Wuhan 430000, China;2Department of Epidemiology, Wuhan University School of Public Health, Wuhan 430071, China;#Corresponding author
【Abstract】Objective: To investigate the clinical value of multi-drug resistant tuberculosis(MDR-TB) rapid diagnostic technique genotype MTBDRsl assay in diagnosing mycobacterium tuberculosis resistant to second-line drugs with meta-analysis. Method: We searched Pubmed, Embase and the Cochrane Librar until January 2015. The Meta-Disc software was used to calculate sensitivity, specificity, positive likelihood ratio (PLR), negative likelihood ratio (NLR), diagnostic odds ratio (DOR), corresponding 95% confidence interval (CI), as well as summary receiver operating curve (SROC). The diagnosis value of MTBDRsl assay was evaluated by area under the curve (AUC), and compare the sensitivity and specificity between clinical samples and culture strains. meanwhile we assess the publish bias of included studies.Results: We identified 22 English literatures involving five different drugs (fluoroquinolones, amikacin, capreomycin, kanamycin and ethambutol). The overall heterogeneity of study was high, and the risk of selection bias was higher. The summarized sensitivity, specificity, and AUC were 0.87, 0.97 and 0.9690 for fluoroquinolones, 0.87, 1.00 and 0.9944 for amikacin, 0.88, 0.97 and 0.9791 for capreomycin, 0.50, 0.99 and 0.9814 for kanamycin and 0.67, 0.87 and 0.7349 for ethambutol, respectively. In addition to the specificity of amikacin resistance had no significant difference (P> 0.05), others were statistically significant (P<0.01). The sensitivity and specificity of different samples had no statistical significance (P>0.05). There were no publish bias in all included studies.Conclusion: Genotype MTBDRsl demonstrate excellent accuracy for detecting drug resistance to fluoroquinolones, amikacin and capreomycin, but it may not be an appropriate choice for kanamycin and ethambutol.
【Key words】Genotype MTBDRsl; Second-line drugs; Mycobacterium tuberculosis; Meta-analysis
*[基金项目]武汉市卫生局临床医学科研项目(WX12C02)
[中图分类号]R446.5
[文献标识码]A
[文章编号]1005-1740(2016)02-0031-08
第一作者简介:本文
本文2015-11-25收到,2016-04-14修回
