非洲紫罗兰组培体系中卡那霉素的抗性筛选
2015-09-10国会艳李继光张春蕊等
国会艳 李继光 张春蕊等

摘要: 采用组织培养技术,在非洲紫罗兰组培过程中的愈伤组织诱导、芽的分化、生根阶段分别进行不同浓度卡那霉素(Kan)的抗性筛选。结果表明,在愈伤组织诱导阶段,Kan浓度为60 mg/L时外植体的愈伤诱导受到抑制;在芽的分化阶段,Kan浓度为80 mg/L时芽的增殖受到抑制;在生根阶段,Kan浓度为120 mg/L时生根受到抑制。
关键词: 卡那霉素;抗性筛选;非洲紫罗兰
中图分类号: S681.204+.3 文献标志码: A
文章编号:1002-1302(2015)08-0056-02
自1983年成功获得转基因烟草以来 [1],关于转基因的研究越来越多,世界转基因市场总收入超过30 000亿美元,仅转基因植物种子的收入可达3 000亿美元 [2]。目前已成功获得200多种转基因植物,3 000多例转基因植物已进入大田试验阶段 [3]。在植物的转基因研究中,npt-[QX(Y15]Ⅱ[QX)]基因常被作为选择标记基因,该基因编码氨基糖苷-3′-磷酸转移酶(aminnoglycoside-3′-phosphotransferase)Ⅱ,又称npt-Ⅱ(neomycin phosphotransferaseⅡ),该酶使氨基糖苷类抗生素(卡那霉素、新霉素、巴龙霉素G418等)磷酸化而失活 [4];因此,npt-[QX(Y15]Ⅱ[QX)]基因可用作遗传转化过程中区分转基因、非转基因植物细胞的标记 [5]。卡那霉素(kanamycin,Kan)影响线粒体和叶绿体的核糖体70S起始复合物生成,使蛋白质合成受阻,最终导致细胞死亡 [6]。根据其特性,对以npt-[QX(Y15]Ⅱ[QX)]基因为选择标记基因的转基因后代株系进行筛选,后代发生分离,含目的基因的株系一定携带npt-[QX(Y15]Ⅱ[QX)]基因,对卡那霉素处理不敏感;不含目的基因的植株不具有卡那霉素抗性,对卡那霉素处理敏感。目前,利用Kan对转基因株系进行筛选已经应用于水稻、小麦、棉花、番茄等作物 [7]。不同植物、不同类型的外植体应使用不同浓度的卡那霉素,使其有效抑制未转化成功的细胞生长并使之缓慢死亡,又不影响转化成功的细胞正常生长。抗生素浓度过低虽不影响转化株的正常生长,但可能出现嵌合体和假阳性现象;抗生素浓度过高则毒性过强,会快速杀死细胞,而死细胞对邻近活细胞常有较强的抑制作用,不利于转化细胞的生长 [8]。非洲紫罗兰(Saintpaulia ionantha)为非洲苦苣苔科多年生草本植物,原产于非洲坦桑尼亚海拔700~1 000 m [JP3]的乌桑巴拉山,是一种观赏价值较高的室内盆栽花卉,被誉为“室内花卉皇后” [9-10]。植物基因工程不仅广泛应用于农作物的改良,也是花卉改良的主要手段,[JP2]本试验确定了非洲紫罗兰组培体系中的卡那霉素抗性筛选浓度,为进一步的转基因研究提供依据,并为花卉品种的改良提供全新思路。
1 材料与方法
1.1 材料
非洲紫罗兰组培苗(组培室培养)、卡那霉素、6-BA、NAA。生芽培养基配方为:MS、0.5 mg/L 6-BA、0.5 mg/L NAA。生根培养基配方为:1/2MS、0.01 mg/L NAA。
1.2 方法
1.2.1 愈伤组织的诱导 配制诱导愈伤组织的培养基时,分别加入浓度为20、40、60、80、100 mg/L的Kan,同一浓度至少配制6瓶培养基。挑选生命力强的组培苗叶片,将其切成小方块并接种至不同Kan浓度的培养基中,各瓶接种相同数量的外植体。置于组培室中,在25 ℃下光照培养约20 d,定期观察并记录。
1.2.2 芽的分化 配制芽分化培养基时,分别加入浓度为20、40、60、80、100 mg/L的Kan,同一浓度至少配制6瓶培养基。将非洲紫罗兰的不定芽接种至不同Kan浓度的芽增殖培养基中,各瓶接种相同数量的芽体。置于组培室中,在 25 ℃ 下光照培养约20 d,定期观察并记录。
1.2.3 根的生长 配制生根培养基时,分别加入浓度为60、80、100、120 mg/L的Kan,同一浓度至少配制6瓶培养基。将非洲紫罗兰的不定芽接种至不同Kan浓度的生根培养基中,各瓶接种相同数量的芽体。置于组培室中,在25 ℃下光照培养约20 d,定期观察并记录。
2 结果与分析
2.1 愈伤组织诱导阶段Kan浓度的筛选
Kan浓度为20(图1-A)、40 mg/L(图1-B)时非洲紫罗兰外植体颜色较绿;Kan浓度为60 mg/L(图1-C)时外植体发黄;Kan浓度为80(图1-D)、100 mg/L(图1-E)时外植[CM(25]体失绿褐化。可见,愈伤组织诱导阶段的Kan浓度为
[FK(W17][TPGHY1.tif]
60 mg/L 时,愈伤组织的诱导受到抑制。
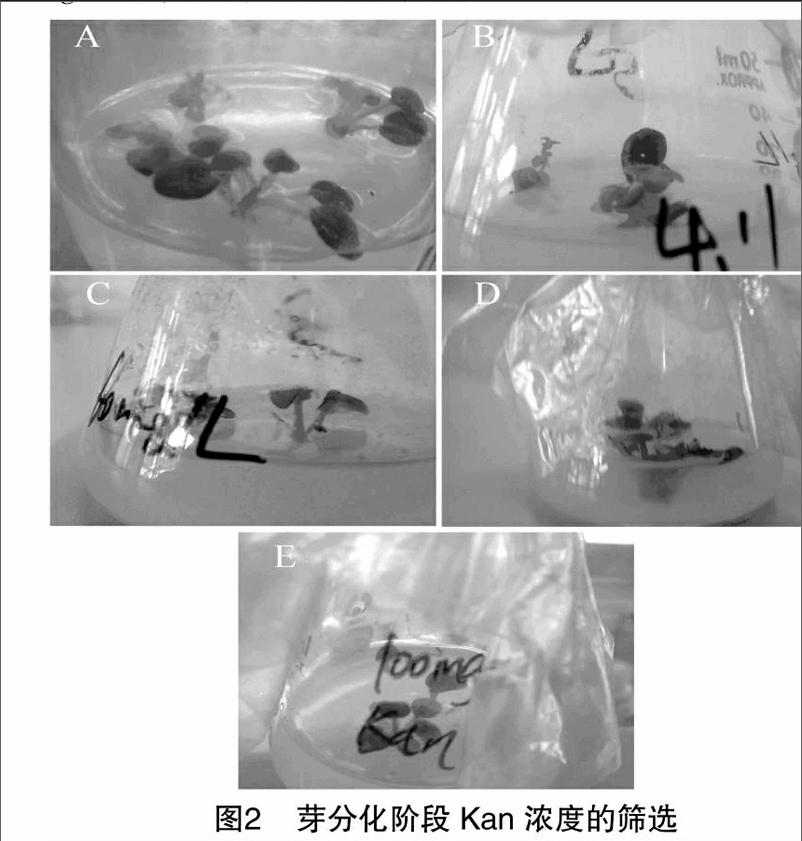
2.2 芽分化阶段Kan浓度的筛选
在Kan浓度为20(图2-A)、40(图2-B)、60 mg/L(图2-C)的芽增殖培养基中,外植体生长良好,叶片颜色较绿;Kan浓度为80(图2-D)、100 mg/L(图2-E)时芽体枯黄,失去芽增殖能力。可见,芽分化阶段的Kan浓度为 80 mg/L 时,芽的分化受到抑制。
[FK(W17][TPGHY2.tif]
2.3 生根阶段Kan浓度的筛选
在Kan浓度为60(图3-A)、80 mg/L(图3-B)的生根培养基中,植株可正常生根;Kan浓度为100 mg/L(图3-C)时,仅部分植株能够生根,其余植株无根生长;Kan浓度为120 mg/L(图3-D)时,植株的生根完全被抑制。可见,生根阶段的Kan浓度为120 mg/L时,植株完全丧失生根能力,后续试验可用此浓度筛选去除转基因阴性株系。
3 结论与讨论
本试验利用组织培养的方法,将非洲紫罗兰的外植体接
种于不同Kan浓度的培养基中进行培养。结果表明,在愈伤组织诱导阶段,Kan浓度为60 mg/L时外植体的愈伤诱导受到抑制;在芽的分化阶段,Kan浓度为80 mg/L时芽的增殖受到抑制;在生根阶段,Kan浓度为120 mg/L时根的生长受到抑制。
在植物转化过程中,必须通过筛选才能获得转基因成功的植株,将卡那霉素作为一种筛选剂加入选择培养基中,以便对转化植株进行筛选。卡那霉素浓度的高低直接影响转化细胞的生长 [11]。不同植物、同一植物不同外植体对卡那霉素的敏感性均可能存在差异,因此筛选浓度各不相同。转化前应设置不同的卡那霉素浓度梯度,找到植物最为敏感的卡那霉素浓度,以便在适当条件下有效抑制非转化细胞的生长并使其缓慢死亡,从而准确筛选出转基因阳性株系。
参考文献:
[1] 陈光中. 安全性的争议[J]. 预防医学杂志,2001,3(9):405-406.
[2]杜建中,孙 毅,王景雪,等. 转基因玉米中目的基因的遗传表达及其抗病性研究[J]. 西北植物学报,2007,27(9):1720-1727.
[3]李剑芳,邬敏辰,王 琴. 基因食品机器安全性研究进展[J]. 江苏食品与发酵,2003(3):8-12.
[4]Wang G L,Fang H J. Plant genetic engineering[M]. 2nd ed.Beijing:Sience Press,2002:527-606.
[5]姚春馨,许明辉,李进斌,等. 转几丁质酶-葡聚糖酶双价基因水稻稻米毒理试验[J]. 中国粮油学报,2007,22(4):18-23.
[6]赵 爽,雷建军,陈国菊,等. 卡那霉素在转基因芥菜中的应用[J]. 遗传,2008,30(4):501-507.
[7]欧阳波,龙 芳,张扬勇,等. 利用转基因标记NPT[QX(Y15]Ⅱ[QX)]快速、规模化纯合转基因番茄[J]. 武汉植物学研究,2006,24(1):12-16.
[8]景 岚,孙燕飞,张 岗,等. 油菜遗传转化体系中卡那霉素浓度的筛选及抑菌剂的选择[J]. 西北农业学报,2008,17(1):102-105.
[9]裴仁济,陈小强,孙 宁,等. 花色模式植物——非洲紫罗兰[J]. 北方园艺,2010(11):219-222.
[10] 陆 帅,董永辉,陈 佳. 非洲紫罗兰形态特征及繁殖技术[J]. 现代农村科技,2009,43(6):39.
[11]王关林,方宏筠. 植物基因工程[M]. 北京:科学出版社,2009:527-528.
