用甘蔗汁生产丁醇的试验研究
2016-12-19磊译刘慧霞校对
焦 磊译,刘慧霞校对
(广西大学轻工与食品工程学院,广西 南宁 530004)
用甘蔗汁生产丁醇的试验研究
焦 磊译,刘慧霞校对
(广西大学轻工与食品工程学院,广西 南宁 530004)
丁醇是分子式为C4H90H的一种饱和脂肪醇,它可用作运输燃料,以及各种化学应用中的介质和溶剂。20世纪50年代以前,丙酮丁醇发酵一直是工业上生产溶剂的标准方法。现代微生物的技术已经改造了生产菌,使之能够产出更高纯度的丁醇,而不是产出以前那种混合溶剂。丁醇作为一个代用燃料来源有许多优势:一是更高的能量;二是能够在现有管道中运输使用;三是容易和汽油相互混合。丁醇能够从甘蔗汁,糖蜜或者蔗渣水解液中的糖中生产出来,这主要是通过一系列拜式梭菌发酵蔗糖而实现。甘蔗汁和糖蜜能够直接发酵生成丁醇,糖蜜发酵丁醇的产量为0.30g/g,甘蔗汁发酵丁醇的产量为0.34g/g,而在等量的蔗糖浓度下每克蔗糖产出0.27克丁醇。从经济学角度来看,从甘蔗产品中生产丁醇的方法是可行的。
生物量;丁醇;发酵;甘蔗汁
0 前言
通过丙酮丁醇梭杆菌发酵生产丙酮丁醇是我们所知的最古老的一种工业发酵方法之一。其生产规模仅次于酒精酵母发酵,而且是所知最大的生物技术过程之一。1950年以前,工业溶剂丙酮,丁醇和异丙醇都是通过发酵而来的(见图1)。

图1 丙酮丁醇发酵工厂
按照以往发酵丁醇的方法,两种梭菌种类丙酮丁醇梭杆菌或者丁酸杆菌被选择为发酵菌种。在典型的丙酮丁醇发酵中,丁酸,丙酸,乳酸和乙酸首先生成,培养液的pH下降,培养菌经历一系列新陈代谢过程,然后才生成丁醇,丙酮,异丙醇和乙醇。
由葡萄糖生产丁醇的得率较低,一般在15%左右,很少有超过25%的。丁醇的产量受限于严重的产物抑制。当丁醇浓度为1%时,抑制细胞的生长和发酵达20%。当丁醇浓度为1.6%时,则完全抑制了细胞的生长和发酵。传统丙酮丁醇发酵的液体培养基中,丁醇的浓度不超过1.3%。
通过发酵产丁醇重新激发了人们对于发展可再生能源的兴趣。丁醇既是一种重要的工业溶剂,也是一种比乙醇更好的潜在能源(如表1)。

表1 替代燃料的属性
丁醇作为一种可替代燃料资源具有很多优点:一是更高的能含量;二是能够在现有管道中运输使用;三是容易和汽油混合。由于它的低溶解度,在水存在的情况下,丁醇相对于乙醇不太容易从混合燃料中分离出来。
从糖类中生产丁醇来自于生化路线,首先葡萄糖生成乙酰辅酶A,同时有丙酮和丁酸产生,然后丁酸转化为丁醇,通过微生物群,丙酮转化为丙醇。虽然人们尝试很多方法来改变这些微生物的遗传性状,使丙酮从丁醇的生产中分离出来,但是并没有完全成功,因为丙酮和丁醇始终共享一个共同中间体(如图2)。通常抑制丙酮的生成也会使丁醇的产量减少。

图2 丁醇和丙酮的生化途径
在过去的二十年左右,人们进行了很多工程尝试来提高丙酮丁醇乙醇(ABE)发酵中丁醇的产量,包括有细胞回收和细胞固定来增加发酵细胞的浓度和反应堆的生产力,使用萃取发酵来使产物的抑制最小化。但是发酵后的丁醇浓度仍然少于2%,生产效率为4.469g/1/h,得率为25%左右。
优化丙酮丁醇乙醇(ABE)发酵过程一直是工业过程的一个目标。像其他任何一种生物原料一样,丙酮丁醇乙醇(ABE)发酵的可行性依赖于原料的成本和微生物的生产能力。如果丁醇能够从低成本的糖中以较为经济的手段生产出来,则市场对丁醇的需求量将会大大增加。近期很多研究主要集中在木质纤维素转化糖上,以及发酵法生产丁醇这一替代能源方面。
很少有报道将甘蔗糖作为可利用的原料来发酵生产丁醇。这一研究的开展是由于我们对美国路易斯安那州制糖工业生产生物燃料的兴趣引起的。
1 材料和方法
1.1 微生物和种菌制备
本研究使用一系列拜氏梭菌。200μL细菌孢子在80℃条件下热冲击10分钟后放到冰中冷却,然后接种到27mL蛋白胨葡萄糖酵母膏培养基中,在34℃下培养12.16h。
1.2 碳源
本研究使用不同的碳源:实验室级蔗糖,赤糖糊,混合汁,以及来源于玉米淀粉的葡萄糖作为对照。玉米淀粉水解成麦芽低聚糖,经淀粉转葡糖苷酶生成葡萄糖。酶将95%的淀粉转化为葡萄糖。
1.3 补料分批发酵
发酵是在125ml的螺钉封顶瓶中进行的,其中有120ml的培养液,温度为34℃,没有搅拌、气流或者pH控制。培养液包含有蔗糖(5%浓度),糖蜜(含糖5.9%),糖汁(含糖4.9%),或者5%的葡萄糖作为碳源,补充1g/L的酵母浸出液。培养液灭菌以后,过滤消毒原液包括:缓冲液(KH2P04,50g/L;K2HP04,50g/L,乙酸铵220g/L),维生素(对氨基苯甲酸,0.1g/L;维生素B1,0.19g/L;生物素,0.001g/L),矿物质(MgS04-7H20,20g/L;MnS04.H20,1g/L;FeS04.7H20, 1g/L;NaCl,lg/L),每样添加lmL。同时接种高度能动的菌体细胞。在发酵的过程中,采集4mL样品测定吸光度、pH、溶剂浓度、有机酸含量,并进行糖品分析。
1.4 分析程序
在600nm的吸光度下可以预估菌体细胞浓度。溶剂、丁醇、丙酮、乙醇都是通过气相色谱来测定(使用PhenomenexZP waxplus)。有机酸、乙酸、丁酸都是通过高效液相色谱测定(使用阴离子交换柱Dionex lonpacAS.11)。糖类则通过高效液相色谱测定(使用Biorad HPS87K)。
2 结果和讨论
拜式梭菌的生长曲线对于所有碳源都是相似的,达到指数晚期的时间约为30h,49.5h后达到最大增长量,无论是加蔗糖还是加葡萄糖的培养液,它们的pH都在指数晚期以前下降,然后回升。这是一个典型的拜式梭菌生长模式,反映出产量以及有机酸的利用。在大多数ABE培养基中,丁醇在稳定期以后开始产生。在整个发酵过程中,少量的丙酮和乙醇一直存在,但是糖蜜发酵是个例外,丁醇产量在生长期便开始逐渐增加。这种模式表明丁醇通过拜式梭菌连续高效生产(如图3)。培养过程中糖蜜能引起酸化,这是因为添加的糖蜜中有0.65Brix的乙酸,相对于其他碳源,这抑制了丁醇的生成。在稳定期以后,丁醇的产量逐渐增加。在糖汁的发酵中,丁醇的产量在12h至49.5h之间快速增加。
糖汁(含4.9%的糖)和糖蜜(5.9%糖)都是发酵丁醇的优良培养基(如图4)。更高浓度的糖蜜就会抑制菌体生长,这可能是由于渗透作用所致。在所有情况下,异丙醇是最大的副产品。这个产物的模式同丁酸杆菌的产物非常相似。在所有的试样中,都发现有少量的乙醇。葡萄糖和蔗糖发酵生成的丁醇没有什么不同。这两种发酵碳源都不是最佳的。在所有的情况下,发酵完以后仍然有残糖。
糖汁和糖蜜发酵生成产物的能力要高于蔗糖或葡萄糖。
在碳源的使用方面,它依赖于产物的生成(如表2所示),使用甘蔗原料所产生的溶剂是使用纯糖或玉米水解物所产生的溶剂的1.3倍。

图3 不同碳源对丙酮丁醇产量的影响(■丙醇,◆丁醇,▲总量)
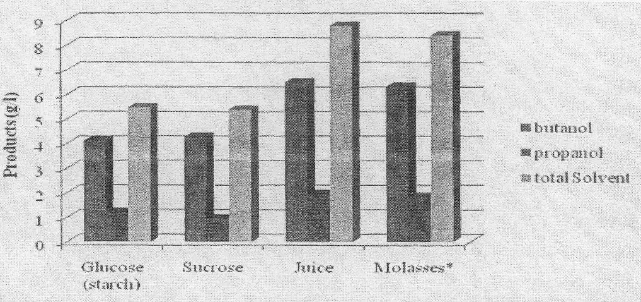
图4 在不同的5%单一碳源条件下,发酵后丁醇、丙醇和总溶剂的产量(g/L,96.5小时)
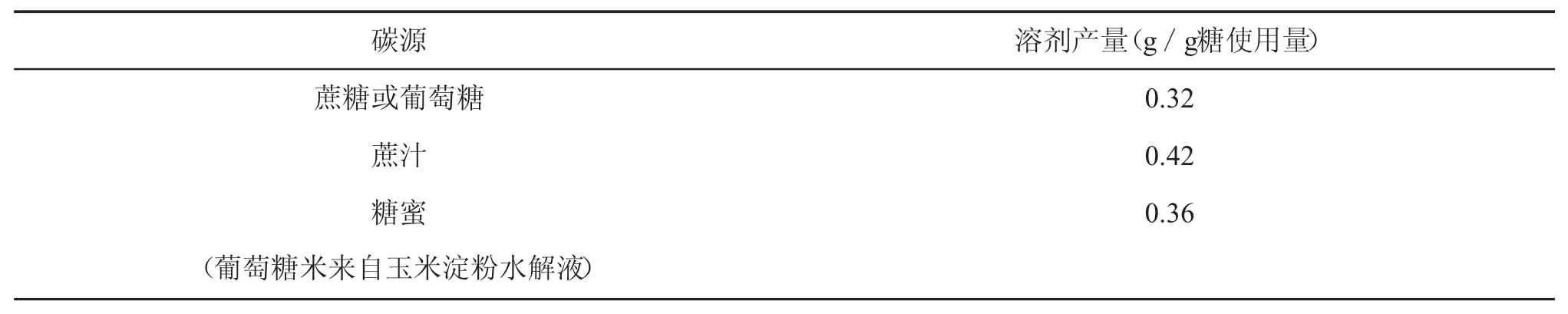
表2 不同碳源的溶剂产量
在所有情况下,首先产生丁醇,并伴随有相当部分的异丙醇。丙酮和乙醇要么缺失,要么微量存在(如表3)。
由于原料的作用不同,溶剂的收益不尽相同,有的差别。比较丁醇发酵和乙醇发酵的情况,值得注意的是酒精酵母发酵有个理论上的最大收益51%,它将1.65kg的糖转化成lL的乙醇。糖的用量和相关的发酵丁醇的原料花费列于表4中。

表3 不同碳源的溶剂收益率
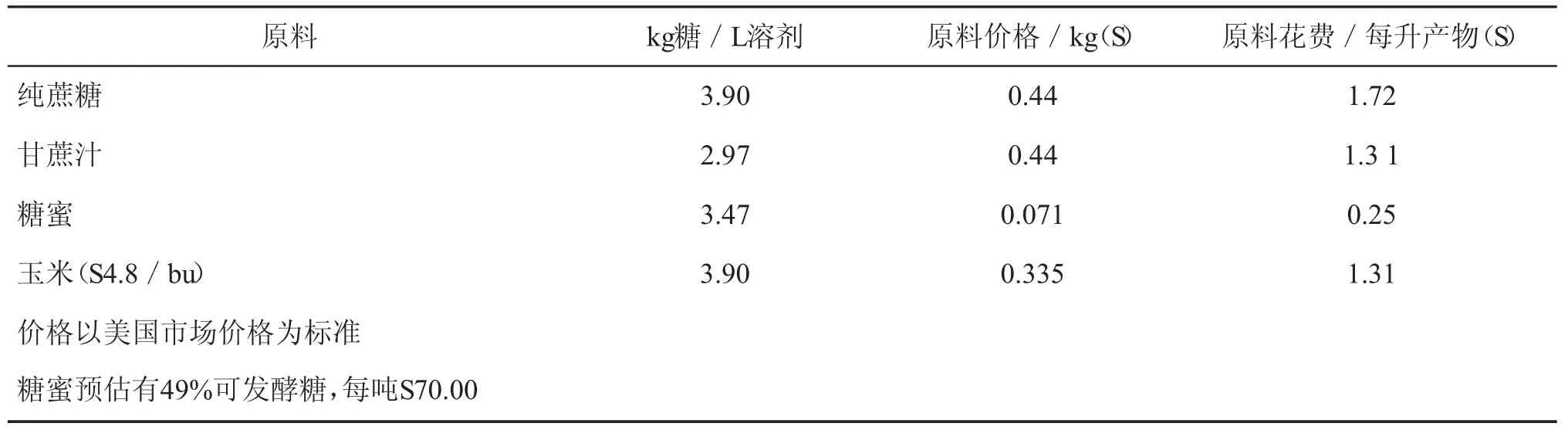
表4 生产丁醇所需原料成本估价
虽然由糖转化成丁醇或丙醇低于转化成乙醇,但是丁醇的热量值更高,也减少了燃料运输管理的问题,这些都值得人们考虑将它作为燃料来生产。从糖汁中直接生产的丁醇燃料很可能会与玉米酒精产生竞争,而用糖蜜发酵丁醇的成本更低。可以预料,努力改进菌株以及工艺将会使收益提高更多。
[1] Ezeji,T.C.Qureshi,N.and Blaschek,H.R(2007)Bioproduction of butanol from biomass:from genes to bioreactors.Current Opinion in Biotechnology 18:220-227.
[2] Jones,D.T.and Woods,D.R.(1986)Acetone-butanol fermentation revisited.Microbio1.Rev 50:484-524.
[3] Parekh,M.,Formanek,J.and Blaschek,H.R(1998)Development of a cost-effective glucose—corn steep medium for production of butanol by’Clostridium beij erinckii.J.Ind,Micr0.Biotech.21:187-191.
[4] Qureshi,N.and Blaschek,H.R(1999)Butanol recoverry from model solutions/fermentation broth by pervaporation:evaluation of membrane performance.Biomass Bioener9.17:175-184.
[5] Qureshi,N.and Blaschek,H.R(2000)Economics of butanol fermentation using hyper—butanol producing Clostridum beijerinckii BAl01.Trans IChemE 78:Part C:139.144.
[6] Qureshi,N.,Ezeji,T.C.,EbenegJ.,Dien,B.S.,Cotta,M.A.and Blaschek,H.R (2008)Butanol production by Clostridum beijerinckii Part l:Use of acid and enzyme hydrolysed corn fiber.Bioresource Tech.99:5915-5922.
[7] Qureshi.N.Saha,B.and Cotta,M(.2007)Butanol production from wheat straw hydrolvsate using Clostrrdum beijerrnckii.Bioprocess and Bioaystems Engineein930:419-427.
[8] Rame>D.(2007)Butanol:the other alternative fuel.National Agricultural Biotechnology Counci119:Brookings South Dakota,May 22-23.
[9] Stanier,R.,Doudororoff,M.and Adelber9,E.(1970)The microbial world,3rd edition.Prentice Hall,Englewood Cliffs,N.J,l86.
[10]Zhen9,Y-N.,Li,L-Z.,Xian,M.,Ma,Y-J.,Yan9,J.M.,Xia,X.and He,D.Z.(2009)Problems with the microbial production ofbutan01.J.Ind.MicrobiolBiotechno1.36:1127-1138.
TS249.9
B
2095-820X(2016)01-05
2016-02-25
邮箱:dday@agcenter.isu.edu
