糖尿病并发抑郁症大鼠海马血脑屏障结构的损伤及其机制*
2016-06-05杜青王宇红赵洪庆杨蕙孟盼徐雅岚
杜青,王宇红,△,赵洪庆,杨蕙,孟盼,徐雅岚
糖尿病并发抑郁症大鼠海马血脑屏障结构的损伤及其机制*
杜青1,王宇红1,2△,赵洪庆1,杨蕙2,孟盼1,徐雅岚1
(1.湖南中医药大学中药粉体与创新药物省部共建国家重点实验室培育基地,长沙410208; 2.湖南中医药大学第一附属医院,长沙410007)
目的:研究糖尿病并发抑郁症大鼠海马血脑屏障结构关键蛋白紧密连接蛋白(ZO-1)、基底膜蛋白(CoIV)、周细胞蛋白(a-SMA)的表达情况及其损伤机制。方法:采用高脂灌胃14 d后,再尾静脉注射链脲佐菌素(STZ,38 mg/kg),随机分为2组(n=15):糖尿病组和糖尿病并发抑郁症组;正常大鼠随机分为2组(n=15):空白对照组和抑郁症组。糖尿病组与空白对照组正常饲养,糖尿病并发抑郁症组和抑郁症组慢性不可预知性应激28 d。检测各组大鼠血糖值的变化,Open-field及Morris实验评价大鼠行为学变化,透射电子显微镜观察大鼠海马血脑屏障形态学改变,免疫组化法检测大鼠海马血脑屏障关键蛋白ZO-1、CoIV、a-SMA表达情况。结果:与空白对照组比较,糖尿病并发抑郁症组大鼠血糖异常升高,自主活动次数减少,逃避潜伏期延长,空间探索时间减少(P<0.05,P<0.01);海马血脑屏障内皮模糊,毛细血管管腔狭窄,周边胶质细胞终足水肿,ZO-1、α-SMA表达显著减少(P<0.05),CoIV的表达显著增加(P<0.05);与糖尿病组比较,糖尿病并发抑郁症组大鼠自主活动次数显著减少(P<0.01),逃避潜伏期延长(P<0.05),海马血脑屏障毛细血管管腔更为狭窄、胶质细胞终足水肿更为明显,a-SMA表达显著下降(P<0.05)。结论:糖尿病并发抑郁症血脑屏障关键蛋白ZO-1、CoIV、α-SMA表达紊乱可能是其结构损伤发生机制之一。
糖尿病并发抑郁症;CoIV;ZO-1;a-SMA;大鼠
糖尿病因长期机体代谢紊乱可诱发多种组织和器官不同程度的病变,长期的病痛折磨和经济负担更容易产生严重的心理压力,在生理与心理的双重刺激下极易并发抑郁症。糖尿病并发抑郁症(diabetes mellitus with depression,DD)较糖尿病危害更大,增加了糖尿病患者的自杀率和致残率,患者自杀的危险性高达10%[1]。国内外研究表明[2],糖尿病和抑郁症具有生物学相关性,两者皆可损伤血脑屏障结构功能的完整性。血脑屏障由脑毛细血管内皮细胞之间紧密连接、毛细血管基膜、星形胶质细胞终足和周细胞4层结构构成,是维持中枢神经系统功能稳定特有的重要结构[3]。上述结构的标志性蛋白有紧密连接蛋白(zonula occludens-1,ZO-1)、基底膜蛋白(type IV collagen,CoIV)、周细胞蛋白(αsmooth muscle actin,a-SMA),这些蛋白表达正常与否与血脑屏障的结构稳定密切相关。因此,本实验以血脑屏障结构标志性蛋白CoIV、ZO-1、a-SMA的表达为切入点,以糖尿病、抑郁症为模型对照,深入探究糖尿病并发抑郁症血脑屏障结构损伤的分子机制。
1 材料与方法
1.1材料
SPF级雄性SD大鼠60只,180~220 g,由湖南斯莱克景达实验动物有限公司提供,许可证号: SCXK(湘)2013-0004;合格证号:43004700004535。
链脲佐菌素(streptozotocin,STZ)(美国Sigma公司);兔抗大鼠CoIV、ZO-1、a-SMA多克隆抗体(武汉博士德有限公司);高脂乳剂(10%胆固醇、0.2%丙硫氧嘧啶、20%猪油、2%胆酸钠、20%聚山梨酯20%吐温-80、20%丙二醇,加蒸馏水至100 ml);4%多聚甲醛固定液(0.1 mol/L PBS缓冲液加入40 g多聚甲醛,加热至55℃~60℃,溶解);2.5%戊二醛固定液,1%锇酸固定液,10%福尔马林固定液。
左归降糖解郁方:黄芪18 g、贯叶连翘3 g、姜黄9 g、熟地黄15 g、山茱萸12 g、枸杞12 g、菟丝子9 g、杜仲9 g、丹参12 g、丹皮6 g、牛膝9 g,由湖南中医药大学第一附属医院制成口服液。盐酸二甲双胍片:批号1402115,由湖南湘雅制药有限公司提供;盐酸氟西汀胶囊:批号2087A,由法国Patheon公司提供。
1.2动物模型的制备
糖尿病动物模型的制备:SD大鼠连续14 d每天定时灌胃高脂乳剂(10 ml/kg)后,禁食不禁水24 h,尾静脉一次性注射溶于新鲜配制的枸橼酸缓冲液(0.1 mol/L、pH 4.5)的STZ(38 mg/kg),造模3 d后,禁食不禁水12 h,测定空腹血糖,其中≥16.00 mmol/L的大鼠即合格。
抑郁症动物模型的制备[4]:SD大鼠采用28 d慢性不可预测性应激。刺激因素包括倾笼45°24 h,昼夜颠倒24 h,4℃冰水浴5 min,45℃热刺激5 min,噪音刺激8 h,潮湿垫料24 h(200 ml/cage),夹尾1 min。每天进行一种,同种刺激不连续出现。
糖尿病并发抑郁症动物模型的制备[5]:采用以上两种方法联合制备DD模型。
1.3分组
60只SD大鼠,按体重随机选取30只SD大鼠制备成糖尿病模型后,随机分为糖尿病组、糖尿病并发抑郁症组;剩余30只SD大鼠按体重随机分为抑郁症组、空白对照组(n=15)。实验周期为46 d,糖尿病动物模型制备成功后,各组每周进行血糖检测,直到抑郁症和糖尿病并发抑郁症动物模型造模结束后,对各组大鼠进行行为学检测,然后腹腔取血,其中各组大鼠中的7只灌注后取全脑用于免疫组化检测,剩余8只取海马用于电镜检测。
1.4空腹血糖测定
动物禁食12 h后,依照血糖仪说明书用血糖试纸检测血糖。
1.5行为学检测
1.5.1 Open-field实验各组大鼠从80 cm×80 cm ×40 cm、底面均分为25个方格的黑色敞箱的角落放入,适应1 min后,拍摄并记录各组大鼠3 min内水平运动格数(四爪皆进入方可记一次),垂直竖立的次数(两爪腾空放下记一次),记录大鼠最后活动总得分,以大鼠自主活动次数作为评价其抑郁行为的指标。
1.5.2 Morris水迷宫实验将平台置于D象限,注入清水(水温23℃~25℃),水的深度刚好没过平台2 cm左右,撒入适量脱脂奶粉并混匀以减少光反射。学习能力检测:第1~4天定位航行实验,大鼠从不同的方位面向池壁放入,观察60 s内大鼠爬上平台的逃避潜伏期(escape latency,EL),若60 s内还未爬上,将大鼠引导至台上,并记入EL为60 s。记忆能力检测:第5天空间探索实验,撤走平台,大鼠自对立象限放入,记录60 s内大鼠在D象限游泳的空间探索时间(space exploration time,SET)。实验均在上午8∶00-12∶00内完成,保持室内其他物体位置不变。
1.6样本采集
24 h禁食不禁水的动物用10%的水合氯醛(4 ml/kg)麻醉后,固定于手术台上,快速剖开胸部使心脏暴露,从左心室心尖处插入灌注刺针同时剪破右新耳,灌注生理盐水,待流出的液体澄清后,慢速灌注4%多聚甲醛溶液(保存在4℃冰箱内)至动物四肢僵硬。断头取出全脑,固定于4%多聚甲醛溶液中。各组部分大鼠全脑分离双侧海马,液氮速冻,-80℃保存。
1.7透射电镜检测
取上述各组大鼠海马组织样本,用2.5%戊二醛浸泡固定24 h;再用1%锇酸(OsO4)固定2 h;丙酮逐级脱水,每次10~15 min;环氧树脂包埋剂包埋;切超薄片,采用醋酸铀及拘橼酸铅双重染色,置于铜载网(200目)上,透射电镜下观察海马血脑屏障结构变化,并拍照记录。
1.8免疫组化检测
取固定好的全脑组织,用乙醇溶液进行梯度脱水,常规石蜡包埋,切片,常规脱蜡、水化、冲洗,然后滴加封闭液,37℃孵育30 min,去除多余的液体。滴加一抗兔抗大鼠抗体(ZO-1 l∶100)、(CoIV 1∶ 100)、(α-SMA 1∶100),4℃过夜,37℃温育45 min,PBS冲洗3次。加入二抗,PBS冲洗3次。滴加SABC,37℃温育30 min,PBS冲洗3次。滴加DAB显色7 min,清水冲洗10 min。再用苏木精轻度复染2 min,脱水至透明后封片。采用ImagePro软件分析各组免疫组化的阳性细胞数。
1.9统计学处理
数据分析采用统计软件SPSS 16.0,所有计量资料以均数±标准差(珋x±s)表示,组间采用单因素方差分析(One-way-ANOVA),双侧t检验。
2 结果
2.1各组大鼠的空腹血糖
与空白组比较,抑郁症组大鼠空腹血糖比较稳定,糖尿病组、糖尿病并发抑郁症组大鼠血糖随应激时间的延长显著升高(P<0.01,表1)。

Tab.1 The levels of blood glucose in rats of each group(mmol/L,n=15,珋x±s)
2.2糖尿病并发抑郁症大鼠的自主活动
与空白对照组比较,糖尿病组、抑郁症组、糖尿病并发抑郁症组大鼠自主活动数明显减少(P<0.01);与糖尿病组比较,糖尿病并发抑郁症组大鼠自主活动数明显减少(P<0.01)。提示,糖尿病并发抑郁症组大鼠较糖尿病组大鼠对新鲜事物的探索能力明显减弱,兴趣缺失(表2)。

Tab.2 Independent activities in different groups(n=15,珋x± s)
2.3糖尿病并发抑郁症大鼠的学习记忆能力
在定位航行实验中,与空白对照组比较,第3、4天,糖尿病并发抑郁症组逃避潜伏期明显延长(P<0.01),提示学习记忆能力显著降低。在空间探索实验中,与空白对照组比较,其余三组的探索时间均有不同程度的缩短(P<0.05,表3)。
2.4海马血脑屏障的结构损伤
空白对照组大鼠海马血脑屏障毛细血管内皮光滑,基底膜薄厚均匀,血管周围未见水肿;糖尿病组大鼠海马血脑屏障毛细血管管腔变窄,血管周围水肿;抑郁症组大鼠海马血脑屏障毛细血管周围有水肿;糖尿病并发抑郁症组大鼠海马毛细血管内皮边界凹凸不平,管腔异常狭窄,基底膜有增厚现象,血管周围水肿明显。提示,糖尿病并发抑郁症组海马血脑屏障结构损伤最为严重(图1)。

Tab.3 Results of Morris water maze test in rats of each group(n=15,珋x±s)
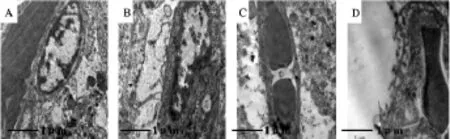
Fig.1 Thebloodbrainbarriermorphologicalchangesindifferent groups(×25 000) A:Control group;B:Diabetic mellitus group;C:Depression group;D:Diabetes mellitus with depression group
2.5ZO-1、α-SMA和CoIV蛋白表达变化
与空白对照组比较,糖尿病组、糖尿病并发抑郁症组大鼠海马血脑屏障ZO-1、α-SMA免疫阳性细胞数显著减少(P<0.05),而CoIV免疫阳性细胞数显著增加(P<0.05);提示ZO-1、α-SMA蛋白减少,而CoIV蛋白增加。与糖尿病组比较,糖尿病并发抑郁症组大鼠海马血脑屏障α-SMA免疫阳性细胞数减少(P<0.05),提示α-SMA蛋白减少(表4,图2)。

Tab.4 ZO-1,α-SMA and CoIV immunoreactive cells of hippocampus blood brain barrier in different groups(n= 7,珋x±s)
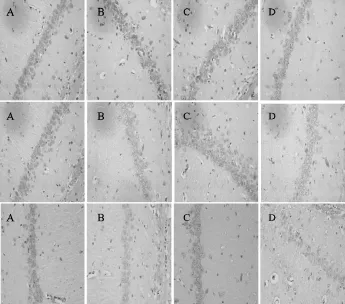
Fig.2 ZO-1,a-SMA and CoIV immunoreactive cells of hippocampus blood brain barrier in different groups(×400) A:Control group;B:Diabetic mellitus group;C:Depression group;D:Diabetes mellitus with depression group
3 讨论
糖尿病以其慢性病的特点成为影响人类健康问题的又一大杀手,而糖尿病患者易于并发抑郁症,二者相互影响并可加重病情的发展。因此,对于糖尿病并发抑郁症发生机制的研究刻不容缓。研究表明,糖尿病与抑郁症皆可使海马血脑屏障通透性改变。急性高血糖时,部分内皮细胞出现肿胀,随着高血糖时间的延长,血脑屏障的整个毛细血管出现变形,血管密度减少并出现动静脉分流,微血管壁钙沉积,部分基膜明显增厚,内皮细胞出现伪足[6]。Najjar S等[7]也通过临床和实验研究证实重度抑郁症存在血脑屏障通透性改变。血脑屏障是中枢神经系统特有的重要结构,其结构的完整性可凭其屏障功能保证中枢神经系统功能的稳定。本课题组前期研究证实,海马是糖尿病并发抑郁症发生的关键靶器官[5],而海马血脑屏障的屏障功能可阻止血液中的有害物质的进入保护其免受损害。有文献表明,糖尿病病理条件下血脑屏障的损伤是通过紧密连接蛋白ZO-1的减少所致的微血管管腔狭窄[8],α-SMA表达的减少所致的周细胞丢失[9],CoIV表达增加所致的基底膜增厚[9]、星形胶质细胞终足肿胀等形态学改变来完成。
ZO-1是一类存在于上皮和血管内皮细胞的高分子量磷蛋白,紧密连接胞质表面,组织紧密连接的组件与皮层肌动蛋白细胞的骨架进行连接是其功能之一[10,11]。CoIV是广泛分布于血脑屏障基底膜透明层的核心胶原成分,可与层粘连蛋白结合形成基底膜的骨架,是基底膜主要的组成蛋白[12],对血脑屏障的屏障作用维持起着重要作用[13]。有研究表明,糖尿病时由于持续高血糖从而刺激CoIV及层粘连蛋白的合成,导致转录这些分子的mRNA水平升高,促使毛细血管基底膜增厚[14]。a-SMA表达异常是周细胞表型转化的标志[15]。周细胞表型转化是指周细胞经过各种有害机制作用受到损伤,导致细胞形态、结构发生改变;在糖尿病病理条件下,氧化应激使线粒体发生损伤,致使血脑屏障周细胞损伤丢失[9]。
本实验采用反应动物自主活动的Open-field实验以及Morris水迷宫实验对各组大鼠进行检测,发现与糖尿病组相比,糖尿病并发抑郁症组大鼠自主活动数明显减少,逃避潜伏期延长,空间探索时间减少。提示糖尿病并发抑郁症大鼠的活动度和对新鲜环境的好奇程度严重下降,学习记忆能力减弱,抑郁症状明显。电镜结果进一步表明,糖尿病并发抑郁症大鼠海马血脑屏障形态学变化较糖尿病、抑郁症大鼠更为明显,海马血脑屏障毛细血管管腔更为狭窄、胶质细胞终足水肿更显著。免疫组化结果表明糖尿病并发抑郁症大鼠海马血脑屏障结构关键蛋白ZO-1、α-SMA、CoIV的免疫阳性细胞数紊乱,我们推测:ZO-1、α-SMA蛋白的减少可能使紧密连接的组件无法嵌入细胞骨架、周细胞丢失,虽然CoIV表达的增加使基底膜厚度发生变化,但整体表现为血脑屏障结构发生变化,通透性增加;糖尿病并发抑郁症海马血脑屏障结构的损伤可能是其发生机制之一。
[1]张娟,毕艳,沈山梅,等.2型糖尿病患者抑郁的患病率及相关危险因素分析[J].中华内分泌代谢杂志,2011,2(10):796-799.
[2]Schroeter ML,Abdul-Khaliq H,Krebs M,et al.Serum markers support disease-specific glial pathology in major depression[J].J Affect Disord,2008,111(2):271-280.
[3]余爱勇,赵玉武.糖尿病对血脑屏障影响的研究进展[J].国际神经病学神经外科学杂志,2008,38(2): 150-153.
[4]Willner P.Chronic mild stress(CMS)revisited:consistency and behaviouralneurobio logical concordance in the effects of CMS[J].Neuropsychobiol,2005,52(2):90-110.
[5]Wang YH,Yin LT,Yang H,et al.Hypoglycemic and anti-depressant effects of Zuogui Jiangtang Jieyu formulation in a model of unpredictable chronic mild stress in rats with diabetes mellitus[J].Exp Ther Med,2014,8(1): 281-285.
[6]Aggarwal A,Khera A,Singh I,et al.S-nitrosoglutathione prevents blood-brain barrier disruption associated with increased matrix metalloproteinase-9 activity in experimental diabetes[J].J Neurochem,2015,132(3):595-608.
[7]Najjar S,Pearlman DM,Devinsky O,et al.Neurovascular unit dysfunction with blood-brainbarrier hyperpermeability contributes to major depressive disorder:a review of clinical andexperimental evidence[J].J Neuroinflammation,2013,10:142.
[8]Hawkins BT,Lundeen TF,Norwood KM,et al.Increased blood-brain barrier permeability and altered tight junctions in experimental diabetes in the rat:contribution of hyperglycaemia and matrix metalloproteinases[J].Diabetol,2007,50(1):202-211.
[9]许庆梅.糖尿病大鼠侧脑室脉络丛及脑小血管基底膜的观察和脑小血管α-SMA及CD31表达的研究[D].石家庄,河北医科大学:2011.
[10]Howarth AG,Hughes MR,Stevenson BR.Detection of the tight junction-associated protein ZO-1 in astrocytes and other nonepitheli-al cell types[J].Am J Physiol,1992,262(2 Pt1):C461-469.
[11]Fanning AS,Jameson BJ,Jesaitis LA,et al.The tight junction protein ZO-1 establishes a link between the transmembrane protein occluding and the actin cytoskeleton[J].J Biol Chem,1998,273(45):29745-29753.
[12]Hayashi Y,Makino H,Ota Z.Serum and urinary concentrations of type IV collagen and laminin as a marker of microangiopathy in diabetes[J].Diabet Med,1992,9 (4):366-370.
[13]董小平,喻斌,金路,等.血脑屏障的细胞组成研究进展[J].中国实验方剂学杂志,2012,18(8): 281-284.
[14]Nishikawa T,Giardino I,Edelstein D,et al.Changes in diabetic retinal matrix protein mRNA levels in common transgenic mouse strain[J].Curr Eye Res,2000,21 (1):581-587.
[15]Margarti A,Zeng L,Xu Q.Stem cells,vascular smooth muscle cells and atherosclerosis[J].Histol Histopathol,2006,21(9):979-985.
Damages and its mechanism of the blood brain barrier in rats with diabetes mellitus with depression
DU Qing1,WANG Yu-hong1,2△,ZHAO Hong-qing1,YANG Hui2,MENG Pan1,XU Ya-lan1
(1.Training Bases,Hunan Key Laboratory of Chinese Materia Medica Powder and Innovative Drugs Established by Provincial and Ministry,Changsha 410208;2.The First Hospital of Hunan University of Traditional Chinese Medicine,Changsha 410007,China)
Objective:To investigate the expressions of key proteins type IV collagen(CoIV),zonula occludens-1(ZO-1),αsmooth muscle actin(a-SMA)and the mechanisms of the structural injuries of the blood brain barrier in the hippocampus of diabetic rats with depression.Methods:After 14 days of high-fat diet,the rats were treated with streptozotocin(STZ,38 mg/kg,iv).Then,the animals were randomly divided into 2 groups(n=15):the diabetic group and the diabetes mellitus with depression group.The normal rats were randomly divided into 2 groups(n=15):the control group and the depression group.Diabetic group and controlgroup were kept in normal conditions.The diabetes mellitus with depression group and the depression group were treated with chronic unpredictable stress for 28 days.The levels of blood glucose were detected.The behavior changes of rats were evaluated by open-field test and Morris test.The blood brain barrier morphological changes were observed under the electron microscope.The expressions of CoIV,ZO-1 and a-SMA in rat hippocampal blood-brain barrier were detected by immunocytochemistry.Results:Compared with control group,the level of blood glucose was increased,the number of autonomic activity was decreased,the escape latencies were significantly longer in the Morris water maze test,as well as the space exploration times were shortened in the diabetes mellitus with depression group (P<0.05,P<0.01).The endothelial cells of the hippocampus were blurred,the capillary lumen was narrow,and the peripheral glial cells were edema,the expressions of ZO-1 and a-SMA were decreased(P<0.05),while the expression of CoIV was increased(P<0.05).Compared with diabetic group,the number of autonomic activity in the diabetes mellitus with depression group was significantly decreased(P<0.01),the escape latencies were longer(P<0.05),the blood brain barrier capillary lumen was more narrow and the glial cell terminal edema was more obvious,the expression of a-SMA was decreased(P<0.05).Conclusion:The abnormal expressions of ZO-1,CoIV and–SMA,key proteins in the hippocampal blood brain barrier,may be involved in the mechanisms of structural damages of the blood brain barrier in diabetes mellitus with depression.
diabetes mellitus with depression;CoIV;ZO-1;a-SMA;rats
R338
A
1000-6834(2016)06-558-05
10.13459/j.cnki.cjap.2016.06.016
国家自然科学基金(81373578,81403379,81573965)
2015-09-09
2016-06-12
△【通讯作者】Tel:0731-85369061;E-mail:wyh107@126.com
猜你喜欢
杂志排行
中国应用生理学杂志的其它文章
- 5-HT1B受体亚型对小脑顶核介导的运动行为的影响*
- Association study between the angiotensin converting enzyme gene insertion/deletion polymorphism and Qinghai Han Chinese with congenital heart disease
- The infl uence of heterogeneity on the analysis of sleep-wake architecture in the single-prolonged stress rats
- Effect of creatine phosphate sodium on miRNA378, miRNA378* and calumenin mRNA in adriamycin-injured cardiomyocytes
- Changes of microcirculation in healthy volunteers and patients with septic shock in Xining
- 当归黄芪提取物对慢性腹膜功能衰竭大鼠腹膜功能、结构及TGF-β1表达的影响*
