一枝蒿黄酮类提取物体内抗乙肝病毒活性及化学成分研究
2016-05-30张素挽刘中奇贺金华戎晓娟顾政一
杨 璐, 张素挽, 刘中奇, 贺金华, 戎晓娟, 顾政一
(1新疆医科大学药学院药剂物化教研室, 乌鲁木齐 830011; 2新疆维吾尔自治区药物研究所, 乌鲁木齐 830004;3解放军第四军医大学, 西安 710000)
一枝蒿黄酮类提取物体内抗乙肝病毒活性及化学成分研究
杨璐1,2, 张素挽1, 刘中奇3, 贺金华2, 戎晓娟2, 顾政一2
(1新疆医科大学药学院药剂物化教研室, 乌鲁木齐830011;2新疆维吾尔自治区药物研究所, 乌鲁木齐830004;3解放军第四军医大学, 西安710000)
摘要:目的研究一枝蒿黄酮类提取物抗鸭乙型肝炎病毒(DHBV)作用及化学成分。方法一枝蒿药材经50%乙醇提取,采用聚酰胺柱进行分离纯化,得到一枝蒿30%、50%乙醇洗脱物。采用1日龄北京鸭,人工感染鸭乙型肝炎病毒模型,将阳性鸭随机分为30%乙醇洗脱物组、50%乙醇洗脱物组、阿德福韦酯组、病毒对照组,各组分别于给药前、给药期间不同时间(5 d和10 d)和停药后3 d取血,分离血清;停药后第3天杀剖,取肝脏,以血清DHBV-抗原、血清DHBV-DNA、肝脏DHBV-DNA作为药效评价指标,研究其体内抗乙肝病毒的作用。采用LC-HRMS/MS法对有效部位化学成分进行分析。结果50%乙醇洗脱物在200 mg/kg剂量下能显著抑制鸭乙肝病毒血清和肝脏中DNA复制,30%乙醇洗脱物的抑制作用较弱。从50%乙醇洗脱物中推测出5种主要化合物,分别为6-去甲氧基-4′-O-甲基茵陈色原酮-7-O-β-D-葡萄糖苷、紫花牡荆素、异山奈甲黄素、洋艾素、山柰素-3,3′,4′-三甲醚。结论50%乙醇洗脱物有抗HBV的作用,50%乙醇洗脱物中推测出的5种主要化合物可能在抗HBV中起到重要的作用。
关键词:一枝蒿; 黄酮类;鸭乙型肝炎病毒(DHBV); 化学成分
一枝蒿(Artemisia rupestris L.)为菊科(Compositae)蒿属(Artemisia L.)植物岩蒿的地上部分或全草,为新疆道地药材,也是维吾尔医常用传统药材,其在我国主要分布于新疆北疆一带,具有清热解毒、健胃消食、镇静止吐、抗过敏等功效[1]。有研究报道一枝蒿中含有黄酮类、倍半萜类、氨基酸类、苷类、多糖类、挥发油类、多肽和生物碱等化学成分[2]。近年来,国内外研究发现中药中的黄酮类或黄酮衍生物具有较好的针对流感病毒神经氨酸苷酶靶点的抗病毒活性和抗肝炎病毒活性[3]。本课题组前期研究表明一枝蒿提取物中可能存在抗病毒活性强的黄酮类化学成分[4]。现有文献中大多采用一枝蒿酮酸及其衍生物或一枝蒿总黄酮进行抗病毒研究[5-7],而对一枝蒿黄酮类成分经分离纯化后的部位的抗病毒作用报道较少。本研究首次采用一枝蒿50%乙醇提取物经聚酰胺柱分离获得的各部位进行抗乙肝病毒研究,并采用LC-HRMS/MS法对有效部位化学成分进行初步分析,推测有效部位的主要化学成分,揭示有效部位的物质组成,为后期实验研究奠定基础。
1仪器与试药
1.1仪器BP211D电子天平(德国赛多利斯),DMIRB显微镜(德国Leica公司),Dionex UltiMate 3000 HPLC仪(美国戴安),Q-Exactive mass spectrometer配备Xcalibur 2.3 software(美国赛默飞世尔),SK3300H超声波清洗仪(上海科导超声仪器有限公司)。
1.2药材一枝蒿(新疆西部加斯特药业有限公司提供,批号:201308),北京鸭(1日龄,上海金连家禽合作社有限公司提供,批号:20140424),鸭乙肝病毒(由复旦大学药学院提供),阿德福韦酯(浙江安科福韦药业有限公司,批号:140420),聚酰胺(30~60目,浙江省台州市路桥四甲生化塑料厂,批号:20140305),DIG-High Prime DNA Labeling and Detection Starter Kit I(罗氏公司,11745832910),甲醇为色谱纯(美国Fisher公司,批号:141062),其余试剂均为分析纯。
2方法与结果
2.1一枝蒿样品的制备将一枝蒿药材粉碎,加入10倍量50%乙醇,加热回流,提取3次,提取时间分别为2、2、1 h,合并提取液,滤过,减压浓缩,真空干燥,得浸膏。将浸膏粉末用水混悬,上样于聚酰胺柱,依次用水和不同浓度的乙醇水溶液进行洗脱,分别收集30%、50%乙醇洗脱液,分别减压浓缩、干燥,得30%乙醇洗脱物和50%乙醇洗脱物。
2.230%、50%乙醇洗脱物体内抗乙肝病毒实验
2.2.1鸭乙型肝炎病毒感染 1日龄北京鸭,静脉注射DHBV阳性鸭血清,0.2 mL/只,在感染病毒后8 d取血,分离血清,-70℃保存待检。
2.2.2药物治疗实验将阳性鸭随机分为30%乙醇洗脱物组(5只)、50%乙醇洗脱物组(5只)、阿德福韦酯组(6只)、病毒对照组(6只)。30%、50%乙醇洗脱物组按200 mg/kg体质量灌胃给药,阿德福韦酯组按17 mg/kg体质量灌胃给药,病毒对照组给予0.5% CMC,每天1次,给药10 d,停药3 d。各组分别在给药前、给药期间不同时间(5 d和10 d)和停药后3 d取血,分离血清,-70℃保存待检;停药后第3天杀剖,取肝脏。采用Dot blot方法[8]检测血清DHBV-抗原,分别取各组在不同时间分离得到的血清2 μL点样于硝酸纤维素膜,干燥,封闭,斑点杂交,洗膜并进行免疫检测;采用地高辛试剂盒Dot blot方法[8]检测血清DHBV-DNA,分别取各组在不同时间分离得到的血清1 μg进行DNA探针标记,将DNA固定,杂交,进行免疫检测;采用地高辛试剂盒Southern blot方法[9]检测肝脏DHBV-DNA,将各组鸭肝脏加少量灭菌生理盐水匀浆后,反复冻融3次,低速离心后取1 μg,进行DNA探针标记,将DNA固定,利用琼脂糖凝胶电泳将插入载体的模板DNA从载体上分离出来并杂交,进行免疫检测。
2.2.330%、50%乙醇洗脱物体内抗乙肝病毒实验结果
2.2.3.130%、50%乙醇洗脱物对血清中DHBV-抗原复制的影响用药期间,血清DHBV-抗原受到轻微抑制,50%乙醇洗脱物用药和停药3 d能持续保持对血清DHBV抗原的抑制,抑制率为13.0%~16.1%;30%乙醇洗脱物给药5 d抑制率为12.7%,但是抑制率随时间下降,停药后反跳;阿德福韦酯也轻微抑制血清抗原水平,抑制率为10%;病毒对照组抑制率为5.7%~7.3%,见图1。
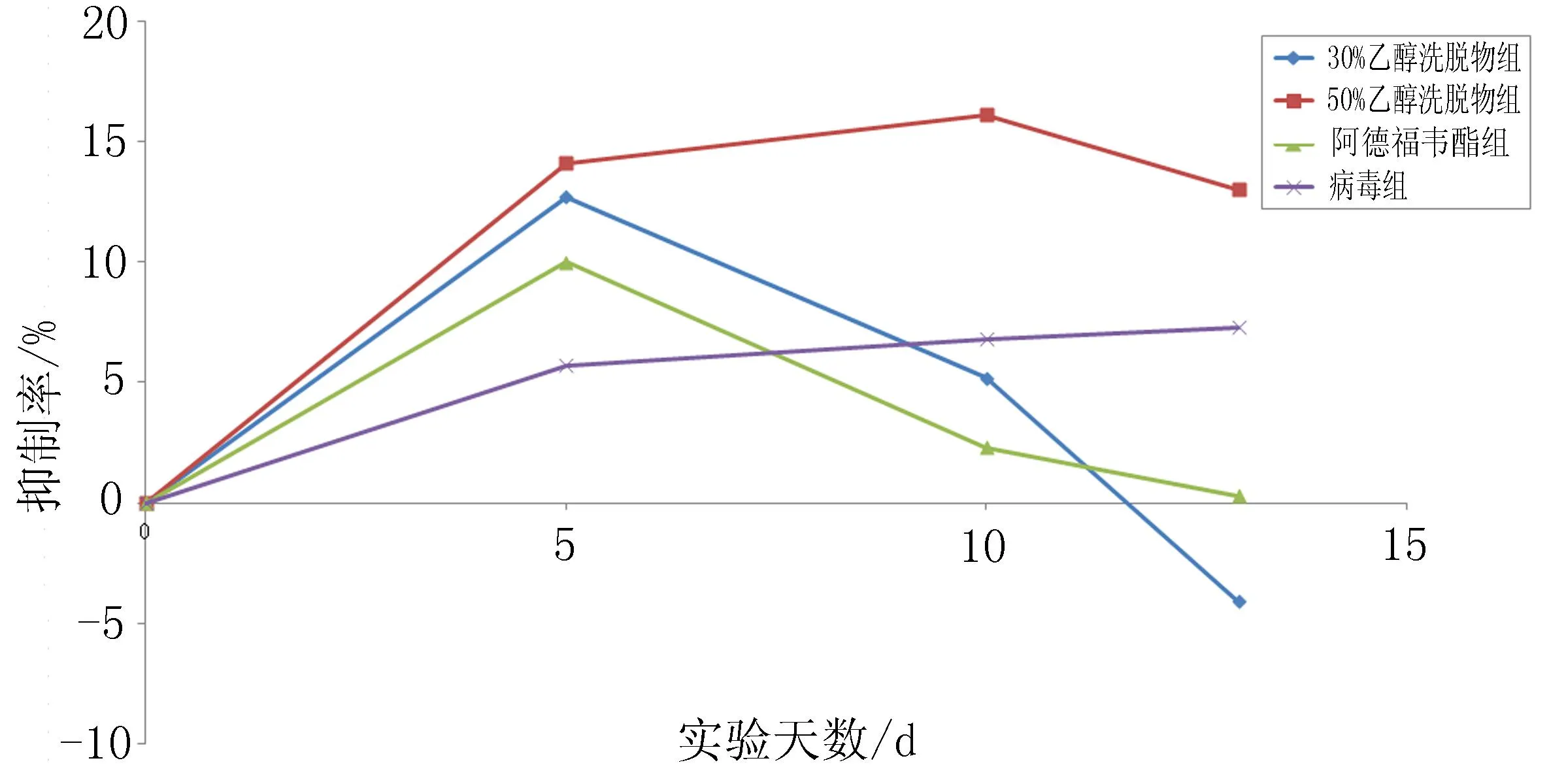
图1 30%、50%乙醇洗脱物对血清中DHBV-抗原复制的影响
2.2.3.230%、50%乙醇洗脱物对血清中DHBV-DNA复制的影响用药期间,血清DHBV-DNA受到显著抑制,50%乙醇洗脱物用药和停药3 d能持续保持对血清DHBV-DNA的抑制,抑制率为72.2%~94.6%;30%乙醇洗脱物给药5 d抑制率为37.4%,但是抑制率随时间下降,10 d无效;阿德福韦酯用药期间显著抑制血清DNA水平,抑制率为89.0%~92.7%,停药3 d后反跳39.7%;病毒对照组抑制率为9.1%~32%,见图2。
2.2.3.330%、50%乙醇洗脱物对肝组织DHBV-DNA水平的抑制作用用药10 d停药3 d,与病毒对照组比较,30%乙醇洗脱物对肝脏DHBV-DNA的抑制率为7.1%,而50%乙醇洗脱物的抑制率为38.6%,阿德福韦酯的抑制率29.1%。该结果与血清DHBV-DNA的抑制效果相吻。
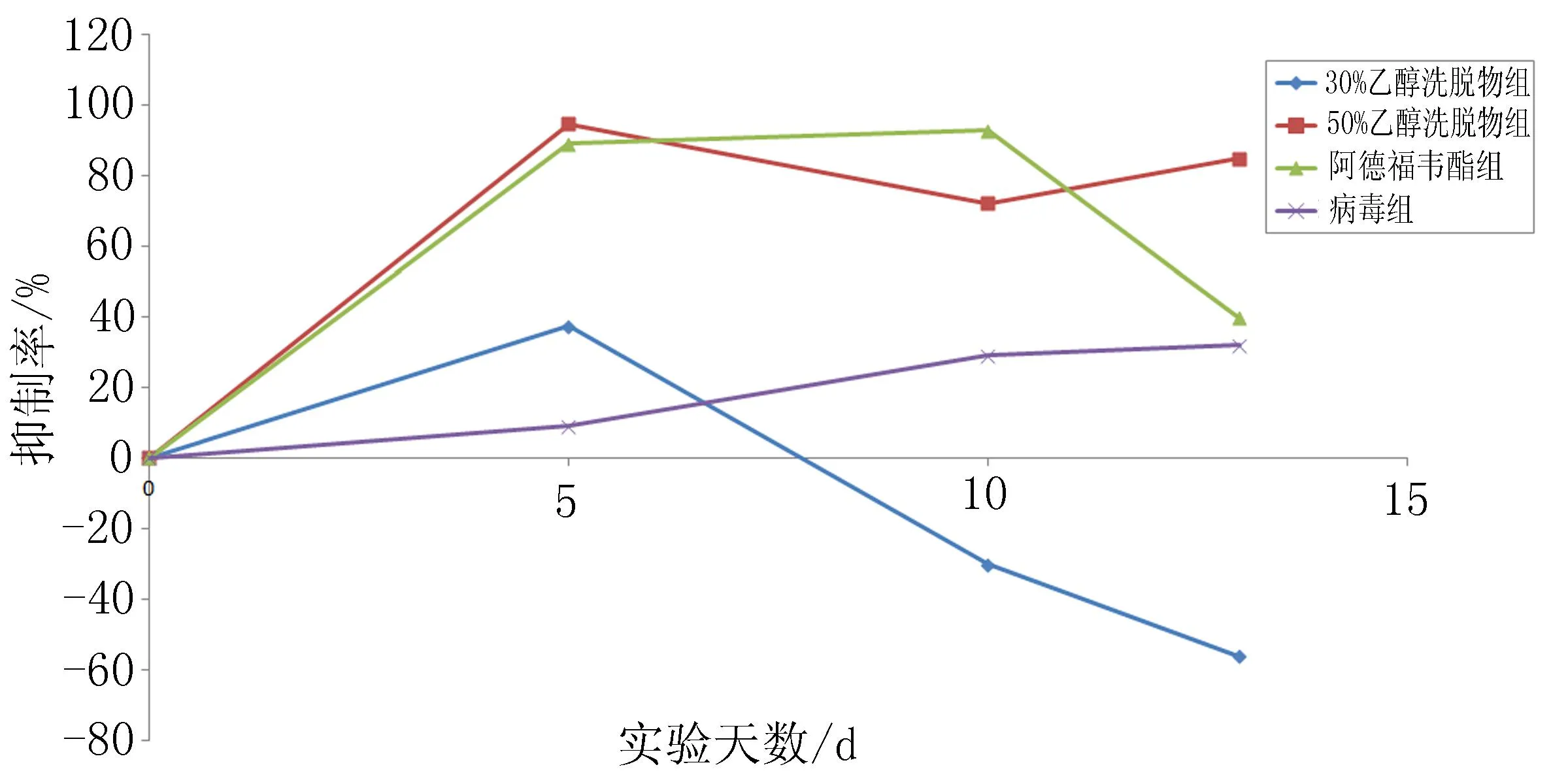
图2 30%、50%乙醇洗脱物对血清中DHBV-DNA复制的影响
2.350%乙醇洗脱物化学成分分析
2.3.1样品配制称取50%乙醇洗脱物粉末约10 mg,置5 mL量瓶中,加入50%甲醇水适量,超声至完全溶解,冷却至室温,定容,制成约2 mg/mL的溶液,过微孔滤膜(0.2 μm),取续滤液。
2.3.2色谱条件色谱柱Agilent C18 250 mm×4.6 mm;流动相为水(A)-甲醇(B),梯度洗脱(0~40 min,20%B→85%B;40~45 min,85%B;45~55 min,20%B),在200~400 nm波长范围内进行扫描;流速:1 mL/min;进样量:10 μL;柱温:30℃。柱后1∶2分流(1/3进入质谱仪)。
2.3.3质谱条件在一个质谱数据采集周期内同时进行高、低不同碰撞能量的2个EMS扫描。采集方式为Full MS+ddMS2。扫描范围:70~1 000 m/z;色谱峰宽(FWH):15 s;分辨率:70 000;最大离子补集时间:100 ms;鞘气:40 psi;喷雾电压:3.5 kV;毛细管温度:350℃;共轴气温度:220℃;隔离窗宽度:1.0 m/z。
2.3.450%乙醇洗脱物化学成分分析结果取50%乙醇洗脱物溶液按“2.3.2”项下色谱条件和“2.3.3”项下质谱条件进行LC-HRMS/MS分析,并根据样品分子量推测化合物,结果推测出5种化合物:6-去甲氧基-4′-O-甲基茵陈色原酮-7-O-β-D-葡萄糖苷、紫花牡荆素、异山奈甲黄素、洋艾素、山柰素-3,3′,4′-三甲醚,见图3~5、表1。
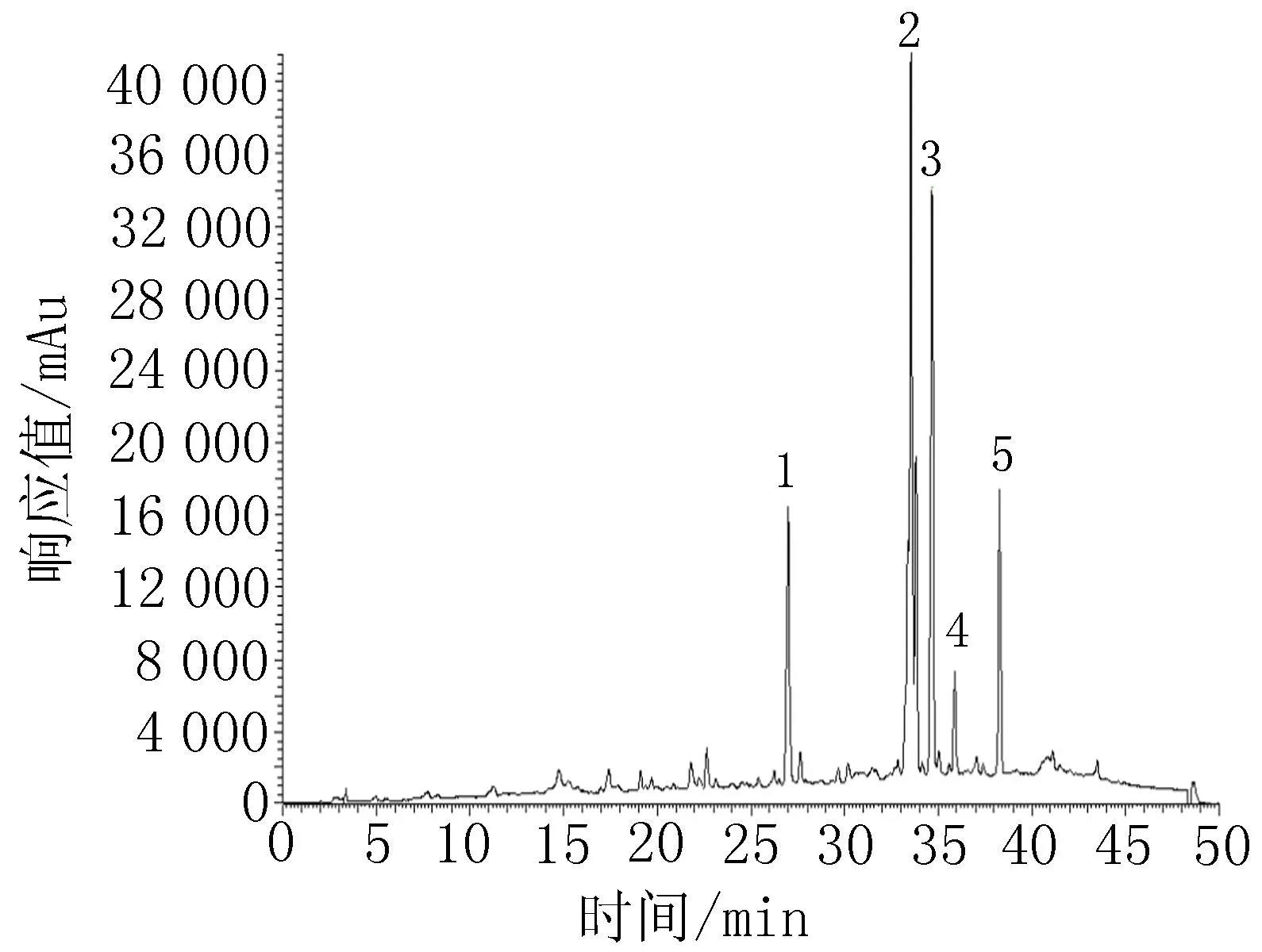
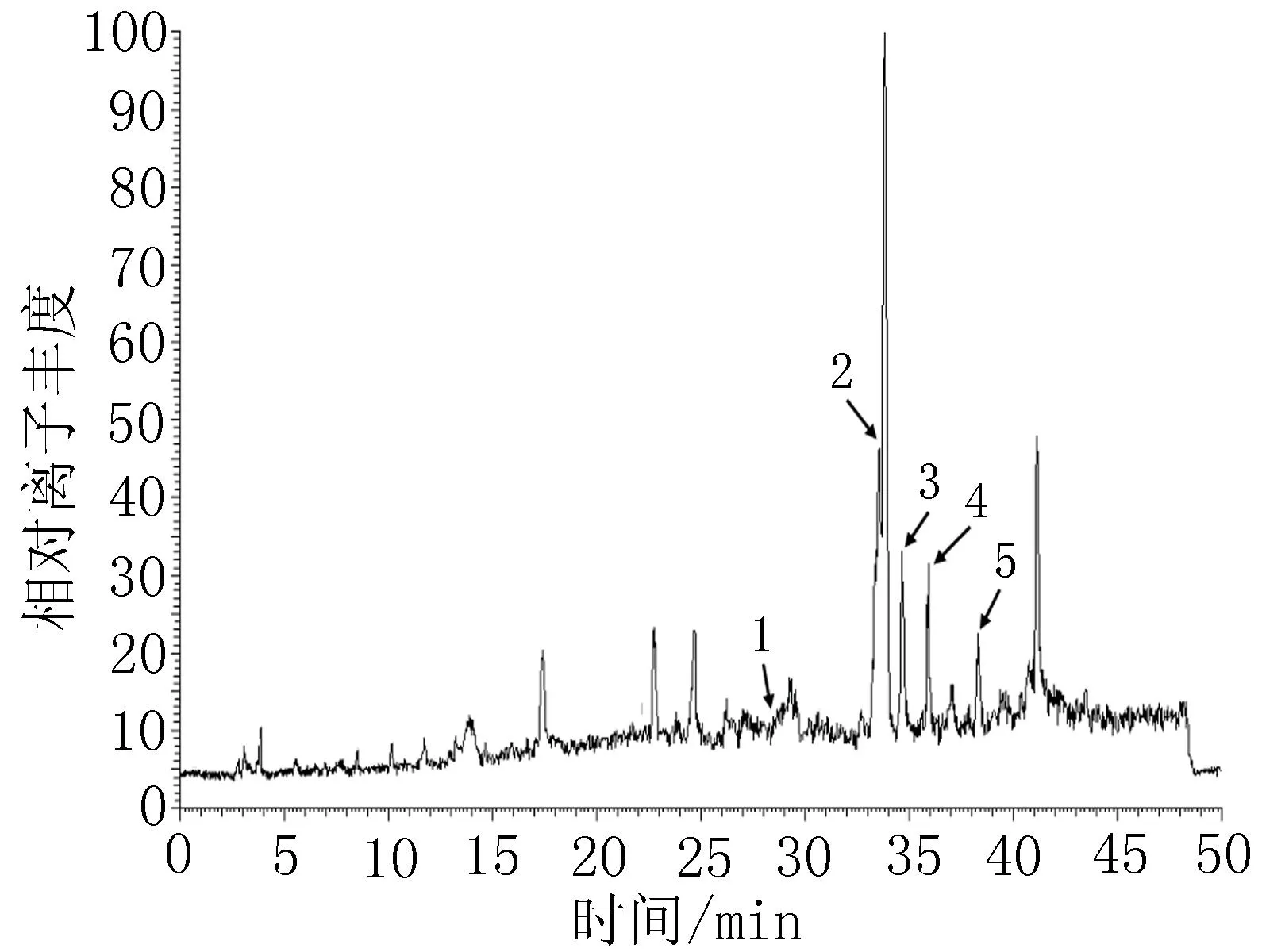
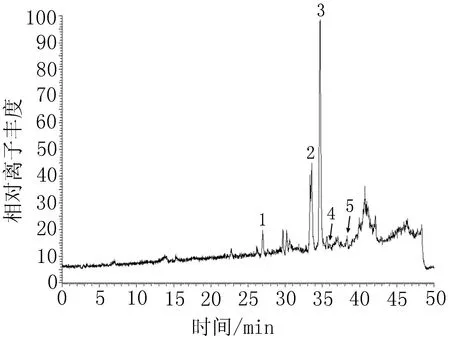
图350%乙醇洗脱物HPLC图
图450%乙醇洗脱物HPLC-ESI-MS总离子流色谱图-正离子检测模式图550%乙醇洗脱物HPLC-ESI-MS总离子流色谱图-负离子检测模式
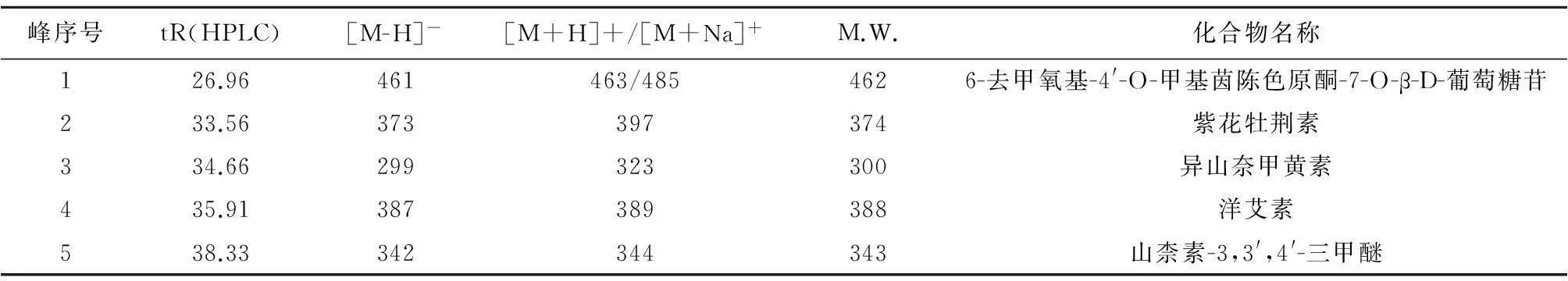
表1 50%乙醇洗脱物中主要化合物推测结果
3讨论
目前鸭乙型肝炎病毒模型是卫生部规定的新药抗乙型肝炎病毒药效学评价的唯一动物模型,国内外研究目前普遍采用的乙肝动物模型为DHBV感染1~3日龄雏鸭,其病毒血症持续时间较长且较稳定,且无明显的自然转阴现象,是研究人类乙型肝炎发病机制、病毒复制过程及筛选有效治疗药物的理想动物模型[10]。动物给药剂量与人给药剂量的换算:本实验根据公式[11]lg S=0.876±0.698 log P(其中S为体表面积,P为体质量)计算后,Dose(鸭,g/kg体质量)=6.1×Dose(人,g/kg体质量),即鸭用剂量约为人用剂量的6倍,或者说鸭剂量为6 g/kg体质量,相当于人用1 g/kg体质量(人体质量假设为60 kg,鸭体质量假设为150 g。如体质量有差异,则倍数有一定差异,但误差不会很大)。
本实验中使用的阿德福韦酯是治疗HBV的常见药物,实验结果表明50%乙醇洗脱物对DHBV的抑制作用高于阿德福韦酯,且在停药后依然存在抑制作用,提示50%乙醇洗脱物的治疗作用可能优于阿德福韦酯。
在本研究体内抗乙肝病毒实验中,50%乙醇洗脱物样品在200 mg/kg剂量下能显著抑制鸭乙肝病毒血清和肝脏中DHBV-DNA复制,30%乙醇洗脱物有抑制DHBV-抗原作用,但对血清和肝脏中DHBV-DNA复制的抑制作用相对较弱,且有反跳现象。提示50%乙醇洗脱物中可能含有抗DHBV作用很强的单体化合物。通过对50%乙醇洗脱物的化学成分分析[12-14],鉴别出50%乙醇洗脱物中的5种化合物,分别为6-去甲氧基-4′-O-甲基茵陈色原酮-7-O-β-D-葡萄糖苷、紫花牡荆素、异山奈甲黄素、洋艾素、山柰素-3,3′,4′-三甲醚。林珊等[15]通过急性抗炎模型观察紫花牡荆素的抗炎作用,结果表明紫花牡荆素具有明显的体内抗炎作用。灵丹草具有抗感染、抗病原微生物等作用[16],《中国药典》记载臭灵丹中的特征性成分为洋艾素,提示洋艾素可能有抗感染和抗病原微生物等作用。这2种成分都具有抗炎作用,提示一枝蒿中的紫花牡荆素和洋艾素可能起到抗DHBV作用。此结果对进一步研究一枝蒿中单体化合物抗DHBV作用奠定了物质基础。
参考文献:
[1]肖威,拉甫·艾白.新疆一枝蒿研究进展[J].中国民族医药杂志,2008,14(7):61-66.
[2]刘勇民,于德泉.新疆一枝蒿化学成分的研究[J].药学学报,1985,20(7):514-518.
[3]Liu MM, Zhou L, He PL ,et al. Discovery of flavonoid derivatives as anti-HCV agents via pharmacophore search combining molecular docking strategy[J]. Eur J Med Chem,2012,52(11):33-43.
[4]秦子茹,贺金华,顾政一,等.一枝蒿不同溶剂提取物抗病毒作用的谱效关系研究[J].中国药房,2015,26(7):889-893.
[5]雍建平,聂礼飞.一枝蒿酮酸苄酯类衍生物的合成、体外抗流感病毒和单纯Ⅰ,Ⅱ型疱疹病毒活性研究[J].有机化学,2009,29(10):1640-1644.
[6]赵江瑜,阿吉艾克拜尔·艾萨.新型一枝蒿酮酸异噁唑衍生物的合成及其抗A,B型流感病毒活性研究[J].有机化学,2012,32(2):333-337.
[7]郭珊珊,高英杰,时宇静,等.一枝蒿总黄酮体外抗乙肝病毒作用机理的实验研究[J].中国实验方剂学杂志,2009,15(10):72-74.
[8]陈渊卿,顾健人,蒋惠秋,等.斑点杂交试验直接检测血清中乙型肝炎病毒DNA[J].中华传染病杂志,1983,1(2):63-66.
[9]萨姆布鲁克.分子克隆实验指南[M].北京:科学出版社,1996:463.
[10]杨柯,郑作文.广西藤茶提取物TTF抗鸭乙型肝炎病毒的实验研究[J].时珍国医国药,2007,11(18):2634-2635.
[11]徐淑云.药理实验方法学[M].北京:人民卫生出版社,1982:1860.
[12]杨建波,吉腾飞,宋卫霞,等.新疆一枝蒿化学成分的研究[J].中草药,2008,39(8):1125-1127.
[13]王燕,吐尔洪·阿西木,堵年生.新疆一枝蒿化学成分的研究[J].新疆医科大学学报.2004,27(4):361-363.
[14]宋卫霞,吉腾飞,司伊康,等.新疆一枝蒿化学成分的研究[J].中国中药杂志,2006,31(21):1790-1792.
[15]林珊,张宏.紫花牡荆素体内抗炎作用的研究[J].中西医结合学报,2007,5(5):573-575.
[16]豆涛.不同产地的臭灵丹体外抑菌作用比较[J].中国药业,1998,7(5):45-46.
(本文编辑施洋)
Study on in vivo anti-hepatitis B virus activity and chemical constituents analysis of flavonoids from Artemisia rupestris L.
YANG Lu1,2, ZHANG Suwan1, LIU Zhongqi3, HE Jinhua2, RONG Xiaojuan2, GU Zhengyi2
(1DepartmentofPharmacy,CollegeofPharmacy,XinjiangMedicalUniversity,Urumqi830011China;2XinjiangInstituteofMaterialMedical,Urumqi830004,China,3theFourthMilitaryMedicalUniversity,Xi’an710000)
Abstract:ObjectiveTo study the anti-DHBV effect and chemical constituents of flavonoids extract from Artemisia rupestris. MethodsThe separation and purification of the 50% ethanol extract of Artemisia rupestris L. were performed with polyamide column.30% and 50% ethanol-eluted fractions were obtained. 1-day old Beijing ducklings were used to establish the model of duck Hepatitis B Virus. The positive ducks were randomly divided into 30% ethanol extract group, 50% ethanol extract group, adefovir dipivoxil group and virus control group. The blood of ducks were collected and the serum were isolated before medication, and at the 5th, 10th day after medication, and the 3rd day after stopping medication; These ducks were killed and livers were removed on the third day after stopping medication. The activity of in vivo anti-HBV was determined by Serum DHBV antigen,Serum DHBV-DNA and Liver DHBV-DNA detection with the method of immunohistochemistry. The ethanol-eluted fractions and the components were analyzed by LC-HRMS/MS. Results50% ethanol-eluted fraction can significantly inhibit DHBV-DNA replication in serum and liver in the 200mg/kg dose. 30% ethanol-eluted fraction has weak inhibition. Five compounds were gained from 50% ethanol-eluted fraction as 6-demethoxy-4′-O-methylcapillarisin-7-O-β-D-glucopyranoside, Caticin,kaempferide, artemetin, kaempferol 3,3′,4′-trimethylether. Conclusion50% ethanol-eluted fraction can significantly inhibit DHBV-DNA replication in serum and liver, indicating that 50% ethanol-eluted fraction has an effect on anti-HBV.
KeyWords:Artemisia rupestris L.; flavonoids; DHBV; chemical constituents
收稿日期:2015-11-16]
doi:10.3969/j.issn.1009-5551.2016.05.013
中图分类号:R966
文献标识码:A
文章编号:1009-5551(2016)05-0578-04
作者简介:杨璐(1991-),在读硕士,研究方向:药物新制剂与新剂型。通信作者:顾政一,男,研究员,博士生导师,研究方向:药物新制剂与新剂型研究,E-mail:zhengyi087@126.com。
基金项目:国家自然科学基金新疆联合基金(U1303224)
