人脐静脉内皮细胞原代培养及鉴定
2016-05-30阎江洪吴倩怡罗素新
阎江洪, 吴倩怡, 罗素新, 夏 勇
(重庆医科大学1生命科学研究院, 2第一附属医院心内科, 重庆 400010)
人脐静脉内皮细胞原代培养及鉴定
阎江洪1, 吴倩怡2, 罗素新2, 夏勇1
(重庆医科大学1生命科学研究院,2第一附属医院心内科, 重庆400010)
摘要:目的建立一个详细、易于重复的人脐静脉内皮细胞原代培养操作流程。方法采用胶原酶消化法分离人脐静脉内皮细胞;用倒置显微镜观察细胞形态,免疫荧光法检测内皮细胞标志分子,Western blotting 检测内皮细胞标志酶——一氧化氮合酶的含量。结果0.2%胶原酶Ⅰ在37℃条件下消化5~13 min可得到高纯度(95%)人脐静脉内皮细胞;在倒置显微镜下,人脐静脉内皮细胞呈典型的鹅卵石样,细胞核明显;Ⅷ因子和CD31的免疫荧光检测呈阳性;Western blotting结果显示,分离到的人脐静脉内皮细胞中有一氧化氮合酶持续合成。结论建立的人脐静脉内皮细胞原代培养和鉴定的操作流程简单易学,且在形态、标志分子和关键性标志酶3个方面提供细胞鉴定的方法和参考数据。
关键词:人脐静脉内皮细胞; 原代培养; 鉴定
血管内皮细胞是位于血管内表面的一类单层细胞。内皮细胞直接与血液接触,具有多种生理功能,可调节各种生物学反应,比如凝血和纤溶过程、炎症细胞的黏附和迁移、血管通透性等[1]。当内皮细胞受到伤害,就会引起诸如动脉粥样硬化、血栓、高血压等疾病。体外培养的内皮细胞是最常见且最重要的研究心血管疾病的工具细胞,因此对内皮细胞的研究尤为重要。体外研究心血管疾病的模型细胞主要有ECV304、EA.hy926和原代人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)3种。ECV304细胞是研究者1985年在HUVEC的常规培养过程中获得的一株自发变异体,但Brown等[2]后来对该细胞系进行了鉴定,发现其与人膀胱癌细胞系T24/83更为相近。因此,该细胞系逐渐被心血管疾病研究者所淘汰。EA.hy926细胞系产生于1983年,由原代培养的HUVEC和A549细胞融合而来[3],具有内皮细胞特有的WP小体和Ⅷ因子标志物等,广泛用于白细胞黏附、体外血管形成、内皮细胞氧化应激、蛋白表达调控等多方面研究[4-8]。但是由于反复传代,用EA.hy926细胞系获得的研究结果和体内的真实情况常常相悖[9]。因此,人们更青睐最接近于本体的原代内皮细胞。在原代内皮细胞中,HUVEC因原材料易获得且所获得的实验结果更符合人体情况,是人们研究原代内皮细胞的首选。
人脐静脉内皮细胞的分离和原代培养对操作者的技术要求高,步骤多,很难培养成功。初学者常因缺少有效的参考而无法对已获得的原代细胞进行有效鉴定。虽然近几十年陆续有一些有关人脐静脉内皮细胞分离和培养的文献报道[10-15],但其描述都不十分详细,所得的鉴定图片清晰度不够,指导性不强。本研究在借鉴国内外学者研究的基础上,经过反复摸索,总结出一个详尽、可重复的操作流程,以帮助初学者在短时间内掌握HUVEC原代培养技术及其纯度鉴定方法。
1材料与方法
1.1主要试剂与仪器胶原酶Ⅰ(美国Sigma公司),肝素钠(北京鼎国公司),ECM培养基(美国Sciencell公司),胎牛血清(美国Gibco公司),胰蛋白酶(美国Sigma公司),EDTA(国药集团化学试剂有限公司),DMEM培养基(美国Gibco公司)Ⅷ因子一抗(美国Abcam公司),CD31一抗(美国Abcam公司),FITC-羊抗小鼠二抗(Proteintech公司),DAPI(碧云天),抗荧光衰减封片剂(Solarbio公司),内皮型一氧化氮合酶(eNOS)一抗(Millipore公司),羊抗兔二抗(Proteintech公司),25 cm2细胞培养瓶(美国康宁公司),6孔板(美国康宁公司),激光共聚焦显微镜(日本尼康公司),水浴锅(HRYSTAL公司),超净工作台(AIRTECH公司),二氧化碳细胞培养箱(Thermo公司),倒置细胞显微镜(江南公司),蛋白质电泳及转印系统(美国Bio-Rad公司),Western Blotting荧光化学发光成像系统(美国Bio-Rad公司)。
1.2方法
1.2.1标本采集新生儿脐带收集于重庆医科大学附属第一医院产科。选择无感染、无妊娠期高血压的健康孕妇,剖腹产手术后无菌获取20 cm左右的新生儿脐带。脐带放入含2 g/L肝素钠的无菌PBS溶液(137 mM NaCl, 2.7 mM KCl,10 mM Na2HPO4,2 mM KH2PO4, pH7.4)中,迅速带回实验室,该过程尽量不要超过1 h。
1.2.2人脐静脉内皮细胞的分离在超净台中,用无菌PBS溶液(室温)将脐带表面黏液及血液冲洗干净,找到管壁薄、腔略大的脐静脉。用去掉针头的10 mL无菌注射器吸取PBS溶液冲洗脐静脉,直到流出液中无血色。根据清洗过程脐带的漏液情况修剪脐带,得到一段完整的脐带。用止血钳夹闭脐带一端,从脐带另外一端灌注0.2%胶原酶Ⅰ(胶原酶Ⅰ用无菌PBS溶液配制,灌注前加入CaCl2溶液使其终浓度为1 mM),至脐带处于充盈状态,用止血钳夹闭脐带。将夹闭的脐带放入无菌PBS溶液中,在37℃条件下孵育5~13 min(具体孵育时间与酶的批次活力相关,第1次使用时需要做时间梯度)。孵育过程中,不时轻轻揉搓脐带(力度以脐带内表面间相互有接触为准),促进胶原酶与血管壁充分而均匀接触。取出脐带,用无菌纱布吸干脐带表面的液体,在脐带一端的止血钳内侧剪短脐带,让消化液流入事先装好中和液(含10% FBS的DMEM培养基,其体积与消化液体积相同)的无菌离心管内。接着用注射器吸取无菌PBS溶液冲洗脐静脉,冲洗的PBS溶液也一并收集。充分混匀后, 800 r/min离心5 min,弃上清液,加入中和液重悬后再次离心,弃上清液,加入ECM培养基制成细胞悬液。将细胞悬液接种到25 cm2细胞培养瓶中,置于5% CO2、37℃培养箱中静止培养,24 h后更换培养液,除去未贴壁细胞。以后每隔1~2 天换液,维持细胞的营养和内环境稳定。
1.2.3人脐静脉内皮细胞的传代培养待内皮细胞长至约80%融合后,去掉旧培养基,用PBS溶液冲洗3次,加入0.25%胰酶(含0.02% EDTA)溶液1 mL消化0.5~1 min,待大多数细胞变圆时,加入2 mL DMEM培养基(含10% FBS)终止消化。用移液管稍稍吹打并收集细胞至离心管中,800 r/min离心5 min,弃上清,加入ECM培养基制成细胞悬液,均分接种到3个培养瓶中,置于5% CO2、37℃培养箱中静止培养。
1.2.4人脐静脉内皮细胞的形态学鉴定原代培养的人脐静脉内皮细胞每隔24小时在倒置相差显微镜下观察并采集图片。传代培养的细胞每代生长至约80%融合时,用倒置相差显微镜观察并采集图片。
1.2.5人脐静脉内皮细胞的免疫荧光鉴定取生长至约80%融合的人脐静脉内皮细胞,按照传代培养的方法进行消化并收集细胞。取无菌6孔板,每孔加入少量ECM培养基,然后小心放入3张盖玻片(盖玻片之间不可重叠,且与孔板底部紧密接触)。将细胞悬液缓慢滴在盖玻片上。盖上盖子,将6孔板放到5% CO2、37℃培养箱中培养。待细胞长至约80%融合时,将6孔板取出,弃培养基后用PBS溶液轻柔洗涤3次,每次5 min。加入冰乙醇(提前预冷至4℃),在4℃条件下静置30 min,以固定细胞。吸去乙醇,加入PBS溶液洗涤3次,每次5 min。加入3% BSA(PBS溶液配制),37℃条件下封闭1 h。取出6孔板,吸去BSA溶液,加入Ⅷ因子(5% BSA稀释100倍)或CD31(5% BSA稀释200倍)一抗,4℃孵育盒内结合过夜。次日,将6孔板置室温下再结合1 h,回收一抗。加入PBS溶液洗涤3次,每次5 min。加入FITC-羊抗小鼠二抗(5% BSA稀释20倍),37℃条件下结合1 h,回收二抗。加入PBS溶液洗涤3次,每次5 min。加入DAPI染核剂覆盖细胞表面,室温下静置5 min。吸去DAPI,加入PBS溶液洗涤3次,每次5 min。滴加10 μL抗荧光衰减封片剂在干净载玻片上,将细胞爬片面扣于其上,轻压盖玻片,用滤纸吸去多余的封片剂,用无色指甲油封闭盖玻片周围,防止封片剂挥发。激光共聚焦显微镜下观察并采集图片。
1.2.6人脐静脉内皮细胞的western blotting鉴定取生长至约80%融合的人脐静脉内皮细胞,用细胞刮将细胞刮下,离心收集细胞,并用PBS洗涤3次。用裂解液[100 mM Tris-Cl(pH7.5), 150 mM NaCl, 2 mM EDTA,0.5% Triton X-100]重悬细胞,并在冰上放置30 min,以彻底裂解细胞。4℃条件下,12 000 r/min离心10 min,取上清。用Bradford法测定蛋白浓度后,取30 μg总蛋白进行Western blotting检测。
2结果
2.1Ⅰ型胶原酶和Ⅱ型胶原酶对人脐静脉内皮细胞分离的作用在已有的人脐静脉内皮细胞分离方法中,大多数研究者选择胶原酶消化法,但所用胶原酶的亚型却不一致,主流亚型是Ⅰ型和Ⅱ型胶原酶。为此进行了比较实验。如图1所示,Ⅰ型胶原酶消化得到的细胞数量更多,而且细胞的形态特征也更均一。因此,认为Ⅰ型胶原酶更适合人脐静脉内皮细胞的分离。

a: Ⅰ型胶原酶分离到的原代HUVEC细胞(×100)

b: Ⅱ型胶原酶分离到的原代HUVEC细胞(×100)
图1不同亚型胶原酶分离的人脐静脉内皮细胞的形态特征
2.2人脐静脉内皮细胞的形态学鉴定结果原代分离的HUVEC绝大多数成团聚集,有少数细胞散在分布。散在分布的细胞形态上呈典型的鹅卵石样。聚团细胞中有很多细胞呈长梭形,从中间往外爬,细胞首尾相连或旋窝状排列,每个细胞团呈菊花状(图2a)。培养24 h后进入快速生长期,约72 h进入稳定期,4 d可达到80%融合。在融合状态时,细胞形态均一,呈典型的鹅卵石样,细胞核清晰(图2b)。传代培养的细胞,在第6代后细胞间连接增多, 第10代以后有些细胞体积明显变大(图2c)。

a:培养24 h后的原代HUVEC细胞(×100)
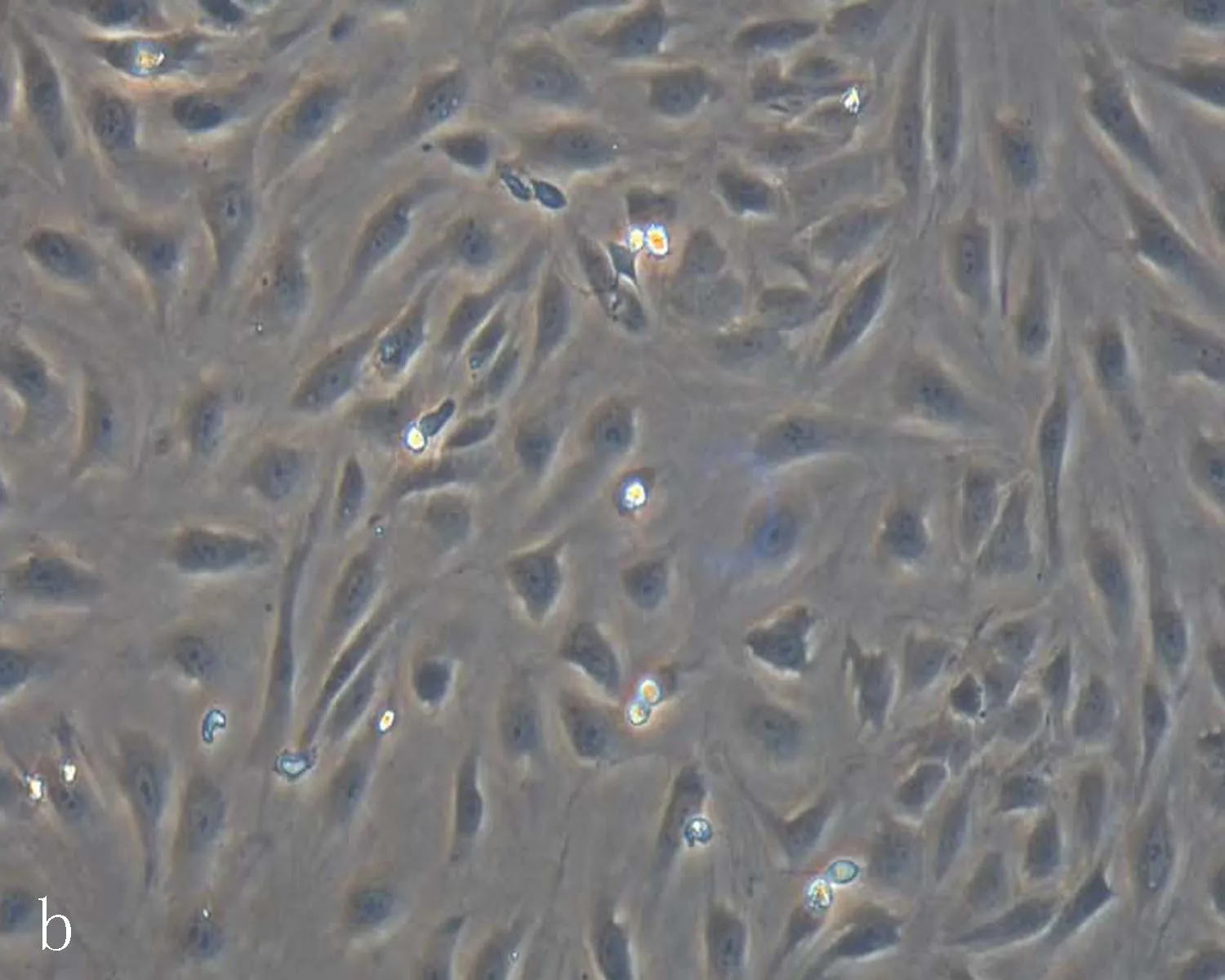
b:生长至融合状态的原代HUVEC细胞(×200)
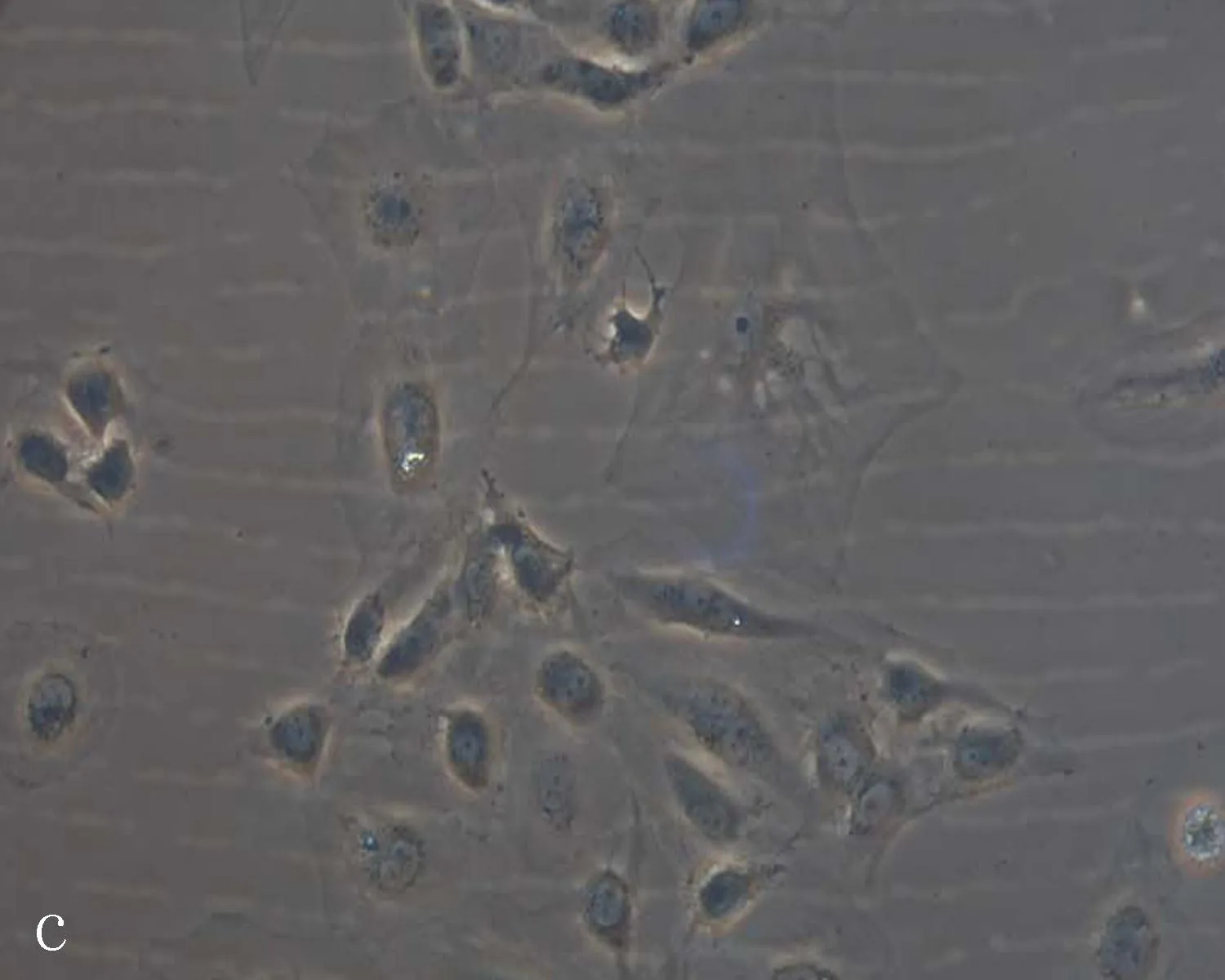
c: 第12代传代培养的HUVEC细胞(×200)
图2人脐静脉内皮细胞的形态学特征
2.3人脐静脉内皮细胞的免疫荧光鉴定结果Ⅷ因子和CD31的免疫荧光结果显示,95%的细胞呈荧光阳性。被Ⅷ因子抗体染色的细胞胞浆中均匀地分布着绿色荧光颗粒,细胞核被DAPI染成蓝色(图3a)。CD31阳性细胞的荧光主要集中在细胞膜和胞间连接上,与CD31的细胞膜蛋白身份相一致(图3b)。与阳性细胞相反,未加一抗的空白对照细胞中,几乎无可见荧光或只有少数的点状杂质(图3c)。证明所获得的细胞是高纯度的人脐静脉内皮细胞。

a: Ⅷ因子的免疫荧光检测(×200)

b: CD31的免疫荧光检测(×200)
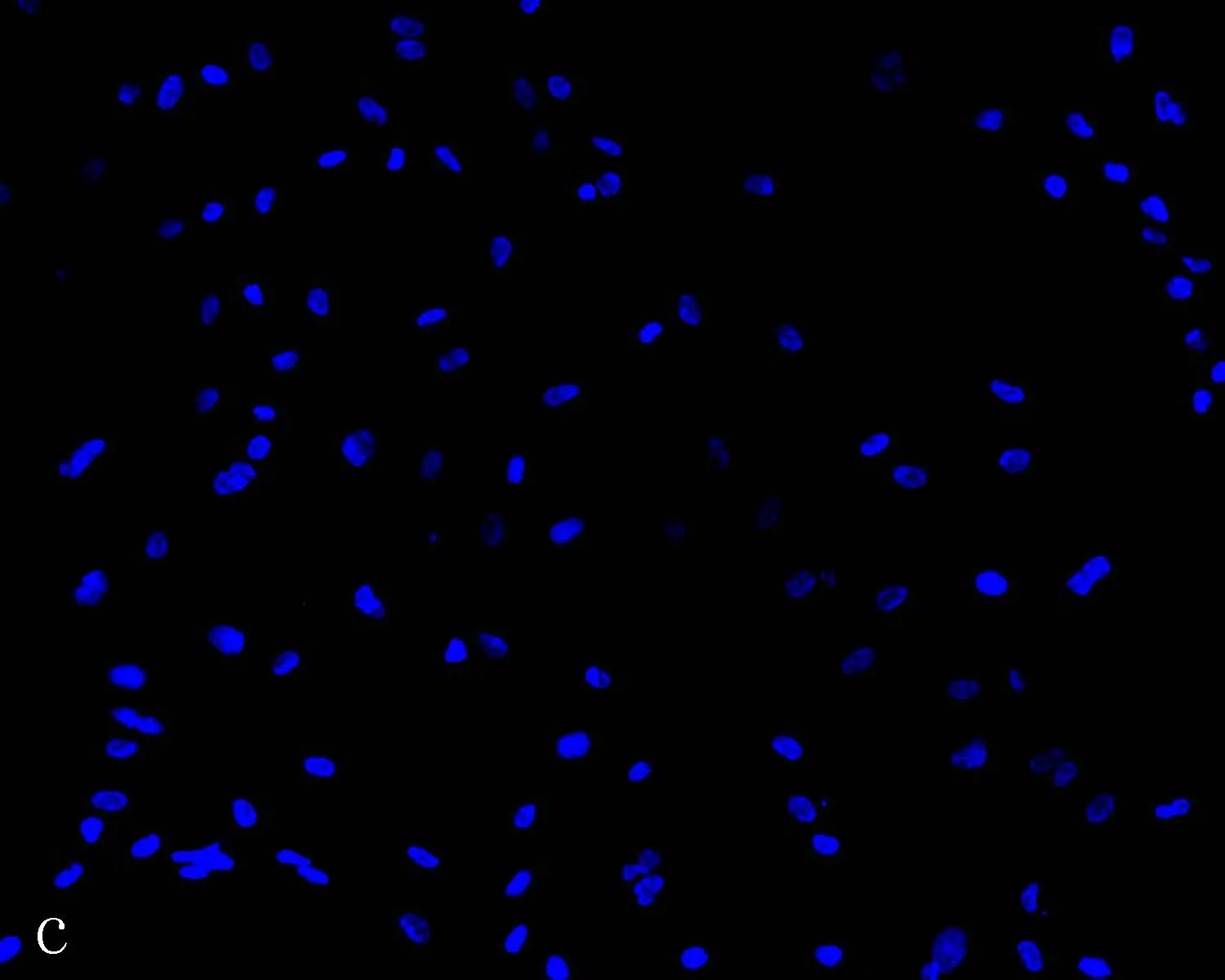
c: 空白对照(未加一抗)的免疫荧光结果(×200)
图3人脐静脉内皮细胞的免疫荧光鉴定
2.4人脐静脉内皮细胞的Western blotting鉴定结果利用Western blotting法,对原代和传代的人脐静脉内皮细胞表达eNOS的情况进行了检测。原代和第10代以内的细胞中均可检测到eNOS的表达,且表达量无明显改变,见图4。
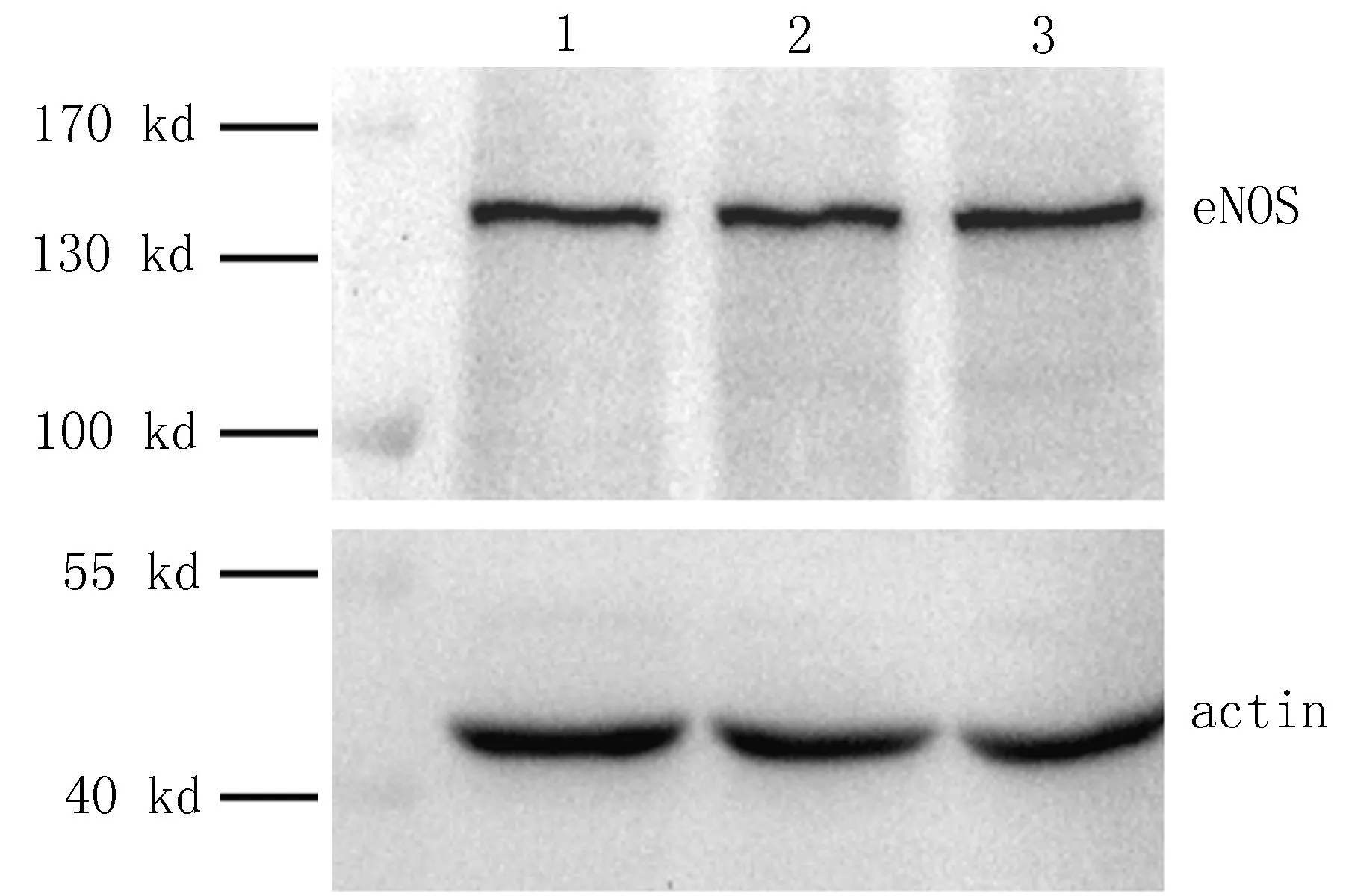
1:来自原代HUVEC细胞的样品;2:来自第5代HUVEC细胞的样品;3:来自第10代HUVEC细胞的样品。
图4人脐静脉内皮细胞的Western blotting鉴定
3讨论
原代细胞的分离方法主要有组织块移植、机械刮取和酶消化3种[16]。组织块移植法所得的细胞成分复杂,无法达到科研需求的纯度。机械刮取法对细胞损伤极大,所获得的细胞数量偏少且生命力弱[14]。因此,本研究旨在建立一个详尽且易于重复的人脐静脉内皮细胞原代培养操作流程,并在形态、标志分子和关键性标志酶3个方面提供细胞鉴定的方法和参考数据。本实验采用相对优越的酶消化法进行研究。综合国内外的相关报道 ,主要消化酶有胰蛋白酶和胶原酶两类。由于胰蛋白酶为实验室常用试剂,本实验首先尝试了胰蛋白酶消化法,经过多次重复,未成功获得状态良好的人脐静脉内皮细胞,所获得的细胞纯度和活力较差。于是本实验采用胶原酶消化法进行人脐静脉内皮细胞的分离。常见胶原酶有Ⅰ~Ⅴ5种亚型,各相关文献中使用的胶原酶亚型并无统一。本实验对使用较多的Ⅰ型和Ⅱ型胶原酶进行了比较实验。通过对比实验,发现Ⅰ型胶原酶消化得到的细胞数量更多,而且细胞的纯度也更高。因此,认为人脐静脉内皮细胞分离的最佳选择是Ⅰ型胶原酶。
人脐静脉内皮细胞分离和培养的步骤繁琐,成功的关键在于一些细节。本研究通过反复的操作比较,总结出以下对人脐静脉细胞原代培养成功具有决定性的细节:(1)消化酶用胶原酶比胰酶好,且Ⅰ型胶原酶可提高细胞数量和纯度,胶原酶的最适浓度为0.2%。(2) 脐带离体2 h内完成细胞分离,超过2 h细胞的存活率迅速下降。(3)如果低温条件下将脐带从医院带回实验室,在清洗脐带内残存血液时,要用室温下的PBS而不是预热至37℃的PBS,迅速升高的温度会使细胞存活率降低。(4)胶原酶在灌注到脐带前,新鲜添加终浓度为1 mM的CaCl2。(5)胶原酶的消化时间与酶的批次等因素有关,如果是新购的酶则需要对消化时间进行梯度摸索。(6)胶原酶消化过程中进行适度的揉搓可以使细胞数量更多,且状态均一。(7)操作过程一定做到严格的无菌,实验相关的器械和试剂都要严格灭菌。
本研究显示,在倒置相差显微镜下,原代人脐静脉内皮细胞大多数成团聚集,有少数细胞散在分布。散在分布的细胞形态上呈典型的鹅卵石样。聚团细胞中有很多细胞呈长梭形,从中间往外爬,细胞首尾相连或旋窝状排列。传代培养的细胞则呈典型的鹅卵石样且大小均匀,胞间连接丰富。在传代细胞中有些细胞体积变大,而且传代到第10代后,细胞体积变大的细胞比例增高,细胞内泡状化严重,因此建议采用第10代以内的细胞进行实验。
Ⅷ因子是内皮细胞中位于Weibel-Palade小体的标志分子,常用于内皮细胞鉴定[16]。本实验免疫荧光鉴定结果表明,分离的细胞纯度高达95%以上。由于Ⅷ因子不仅存在于内皮细胞中,还存在于血小板和巨噬细胞中,并且在分离自微循环区血管的内皮细胞中常常缺失,本实验还增加了另一个内皮细胞中普遍存在的标志分子——CD31的检测[16]。CD31的免疫荧光阳性率也高达95%以上,与Ⅷ因子的检测结果一致。
NO合成减少是高血压、动脉粥样硬化及糖尿病继发性血管病变的病理机制[17]。负责内皮细胞中NO合成的eNOS是心血管疾病的病理检测靶标之一,在相关研究中也应该作为HUVEC的常规检测指标。本研究结果表明,即使传代至第14代也可检测到HUVEC中有eNOS表达,但结合形态学上的变化,为了得到可靠的研究数据,建议采用第10代以内的细胞开展研究。
本研究通过反复摸索,建立了一个对初学者来说简单易学的人脐静脉内皮细胞原代培养和鉴定的操作流程,且在形态、标志分子和关键性标志酶3个方面提供了细胞鉴定的方法和参考数据。
参考文献:
[1]Bouïs D, Hospers GAP, Meijer C, et al. Endothelium in vitro:a review of human vascular endothelial cell lines for blood vessel-related research[J]. Angiogenesis, 2001,4(2):91-102.
[2]Brown J, Reading SJ , Jones S, et al. Critical evaluation of ECV304 as a human endothelial cell model defined by genetic analysis and functional responses:a comparison with the human bladder cancer derived epithelial cell line T24/83[J].Lab Invest, 2000,80(1):37-45.
[3]Edgell CJ, McDonald CC, Graham JB. Permanent cell line expressing human factor VIII-related antigen established by hybridization[J]. Proc Natl Acad Sci U S A, 1983,80(12):3734-3737.
[4]Thornhill M, Li J, Haskard DO. Leucocyte endothelial cell adhesion:a study comparing human umbilical vein endothelial cells and the endothelial cell line EA-hy-926[J]. Scand J Metall, 1993, 38(3):279-286.
[5]JonesMK, Sarfeh IJ, Tarnawski AS. Induction of in Vitro Angiogenesis in the Endothelial-Derived Cell Line, EA hy926, by Ethanol Is Mediated through PKC and MAPK[J]. Biochem Biophys Res Commun, 1998,249(1):118-123.
[6]Huang JJ, Thomas DP, James MM. May. Antioxidant effects of dihydrocaffeic acid in human EA. hy926 endothelial cells[J]. J Nutr Blochem, 2004, 15(12):722-729.
[7]Song YH, Neumeister MW, Mowlavi A, et al. Tumor necrosis factor-alpha and lipopolysaccharides induce differentially interleukin 8 and growth related oncogene-alpha expression in human endothelial cell line EA. hy926[J]. J Plast Surg, 2000,45(6):681-683.
[8]Yu Chang, Liu XH, Zhang Yi. Effects of fluid shear stress on the expression of IL-8 receptor mRNA in EA. Hy926 cell[J]. J Biomed Eng, 2007, 24(2):303-307.
[9]路静,白睿华,杨洪艳,等. 原代脐静脉内皮细胞与脐静脉内皮细胞株的生物学特性比较[J]. 第四军医大学学报, 2008,29(20):1888-1891.
[10]Eric AJ, Ralph LN, Carl GB, et al. Culture of human endothelial cells derived from umbilical veins identification by morphologic and immunologic criteria.[J]. J Clin Invest, 1973, 52:2745-2756.
[11]卞杰勇,周岱. 人脐静脉内皮细胞体外培养的影响因素[J]. 细胞生物学杂志, 1997,19(22):66-69.
[12]魏少敏, 任文华, 王振义. 人脐静脉内皮细胞的培养与鉴定[J]. 中国病理生理杂志, 1987, 3(3):188-191.
[13]杜利君,蒋兴亮. 人脐静脉内皮细胞的分离及原代培养体会[J]. 川北医学院学报, 2013,28(1):48-51.
[14]李琴山,冯赞杰,刘洋,等. 一种改进的人脐静脉内皮细胞的培养方法[J]. 第四军医大学学报, 2007,28(3):276-278.
[15]洪华山,陈文列.人脐静脉内皮细胞的培养[J]. 福建医学院学报, 1996, 30(1):7-9.
[16]Tiziana B, Lucia. M. Endothelial Cells in Culture:A Model for Studying Vascular Functions[J]. Pharmacol Res Commun, 2000, 42(1):9-19.
[17]Gewaltig MT, Kojda G. Vasoprotection by nitric oxide:mechanisms and therapeutic potential[J]. Cardiovasc Res, 2002, 55(2):250-260.
(本文编辑杨晨晨)
A detailed protocol to cultivate and identify human umbilical endothelial cells
YAN Jianghong1, WU Qianyi2, LUO Suxin2, XIA Yong1
(1InstituteofLifeScience,ChongqingMedicalUniversity,Chongqing400010,China;2DepartmentofCardiology,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China)
Abstract:ObjectiveTo establish a detailed protocol to cultivate and identify human umbilical endothelial cells. MethodsHUVECs were harvested by type Ⅰ collagenase digestion at 37℃ and then cultured in ECM. Morphology of HUVECs was observed with a inverted phase-contrast microscope. The cellular marker-Ⅷ factor and CD31 were detected by immunofluorescence method. We detected endothelial isoform of nitric oxide synthase (eNOS) expression using western blotting. ResultsHighly pure HUVEC (95%) can be obtained by 0.2% type Ⅰ collagenase digestion. Under the inverted phase-contrast microscope, HUVECs presented a cobblestone shape. By immunofluorescence method, we detected both Ⅷ factor and CD31 antigens in HUVECs. Western blotting results showed that HUVECs expressed eNOS. ConclusionProtocol we′ve established is easy to acquire. we have also built a standard method to identify HUVEC using morphology, marker molecule and key enzyme.
Keywords:human umbilical endothelial cells; primary culture; identification
[收稿日期:2015-12-18]
doi:10.3969/j.issn.1009-5551.2016.05.008
中图分类号:R329.2
文献标识码:A
文章编号:1009-5551(2016)05-0555-05
作者简介:阎江洪(1981-),女,博士,助理研究员,研究方向:心血管疾病糖生物学 。通信作者:夏勇,男,硕士,教授,博士生导师,研究方向:心血管疾病分子机制,E-mail: yong.xia@osumc.edu。
基金项目:国家重点基础研究发展计划(973计划, 2014CB542400); 国家自然科学基金面上项目(31400999,81170112); 重庆医科大学优秀青年学者资助项目(CYYQ201307)
·基础医学研究·
