细粒棘球绦虫PI3K P110亚基酪氨酸激酶区蛋白原核表达及其多克隆抗体制备
2016-05-30赵辉,刘辉
赵 辉, 刘 辉
(新疆医科大学第一附属医院1医学检验中心, 2临床医学研究院, 新疆重大疾病医学重点实验室, 乌鲁木齐 830054)
细粒棘球绦虫PI3K P110亚基酪氨酸激酶区蛋白原核表达及其多克隆抗体制备
赵辉1, 刘辉2
(新疆医科大学第一附属医院1医学检验中心,2临床医学研究院, 新疆重大疾病医学重点实验室, 乌鲁木齐830054)
摘要:目的制备细粒棘球绦虫PI3K P110亚基酪氨酸激酶区(EgPI3K P110RTK)蛋白的多克隆抗体,为进一步研究EgPI3K P110蛋白的功能提供检测抗体。方法将EgPI3K P110RTK(1-352 aa)基因序列克隆至原核表达载体pGEX-4T-1,转化E. coliROSETTA(DE3)株,IPTG诱导蛋白表达,以GST亲和层析纯化EgPI3K P110RTK蛋白,免疫家兔,收集免疫血清,采用ELISA法测定抗体效价,Western blotting检测所制备抗体与EgPI3K P110RTK蛋白的反应性。结果经0.8 mmol/L IPTG诱导,表达出约66 ku的EgPI3K P110RTK重组蛋白,制备获得效价在5.12×105以上的多克隆抗体,该抗体能够与EgPI3K P110RTK重组蛋白发生特异性反应。结论成功制备获得兔抗EgPI3K P110亚基多克隆抗体,为研究EgPI3K激酶在Eg中的功能和作为药物靶标等研究奠定基础。
关键词:细粒棘球绦虫; PI3K P110亚基酪氨酸激酶区; 蛋白表达; 抗体制备
细粒棘球绦虫(Echinococcusgranulosus, Eg)的蚴虫感染人、羊等中间宿主,所致的囊型包虫病(Cystis Echinococcosis, CE)是一种呈全球分布的人畜共患寄生虫病[1]。在我国,该病主要流行于新疆、青海、四川、西藏等省的牧区,严重危害牧民的身体健康,并对畜牧业造成经济损失。随着城市中宠物犬数量的增多及牲畜产品的流通,该病的流行区正在扩大[2]。目前,包虫病的治疗缺乏高效的药物,亟需研发新型的治疗药物[3]。
PI3K是一种高度保守的胞内磷脂酰肌醇激酶,由调节亚基P85和催化亚基P110构成,具有丝氨酸/苏氨酸(Ser/Thr)激酶和磷脂酰肌醇激酶的活性,是PI3K/AKT信号通路的关键成员,参与调节细胞生长、细胞周期进入、细胞迁移、细胞代谢和细胞存活等多种生物学过程[4-5]。近年来,有关研究发现PI3K激酶与卵巢癌、肝癌和白血病等疾病的发生与发展相关[6-8];针对PI3K的抑制剂是潜在的药物分子,例如XL147、CAL-101等PI3K抑制剂已进入临床实验,治疗卵巢癌和白血病等疾病具有一定的疗效[6,9]。
PI3K激酶在寄生虫的存活和代谢等基本生理功能方面也具有重要的作用。Daher等[10]研究表明刚地弓形虫(Toxoplasma gondii)中存在PI3K激酶家族成员,负责磷脂酰肌醇PI(3,5)P2的合成,参与了顶质体内稳态的调节。Mott等[11]研究发现PI3K激酶的抑制剂能够在体内有效地抑制疟原虫的活性,是潜在的治疗疟疾的药物。然而,尚未在棘球绦虫中鉴定发现PI3K的功能及其可作为治疗包虫病的药物靶点。本课题组前期研究利用组学技术在细粒棘球绦虫中发现了PI3K的基因序列[12]。本实验通过原核表达EgPI3K P110亚基的酪氨酸激酶区(EgPI3K P110RTK)蛋白,制备其多克隆抗体,为研究其生物学功能奠定基础。
1材料与方法
1.1材料
1.1.1菌种、质粒及实验动物大肠杆菌E.coli[DH5α和Rosetta(DE3)]及质粒(pMD18-T-EgPI3K P110和pGEX-4T-1)由新疆重大疾病医学重点实验室-省部共建国家重点实验室培育基地提供;新西兰大白兔,体质量2.0~2.5 kg,购于新疆医科大学实验动物中心。
1.1.2主要试剂DNA gel Extraction Kit、T4 DNA 连接酶、DNA Marker、限制性内切酶和Ex Taq酶均购自大连宝生物工程有限公司,IPTG购自Promega公司,羊抗兔IgG-HRP、弗氏完全佐剂和不完全佐剂购自Sigma公司,PVDF膜购自Millipore公司,其他常用试剂为国产分析纯。
1.2方法
1.2.1pGEX-4T-1-EgPI3K P110RTK(酪氨酸激酶区)原核表达质粒构建以pMD18-T-EgPI3K P110为模板,上游引物为p110-F-4T(5′-GGAATTCATGCCTCCAATCACATTGGA-3′),下游引物为p110-R-4T(5′-GTCGACGCTTGCCTCCATCGCCTCAT-3′)。纯化后的PCR产物和原核表达载体pGEX-4T-1分别经EcoRⅠ和SalⅠ双酶切之后回收,连接,转入E. coli DH5α,获得的重组质粒pGEX-4T-1-EgPI3K P110RTK通过限制性内切酶进行酶切鉴定和序列测定,筛选出阳性克隆。
1.2.2重组蛋白GST-EgPI3K P110RTK的表达及纯化经鉴定正确的重组质粒pGEX-4T-1-EgPI3K P110RTK转化E.coli Rosetta(DE3),其菌液按1∶100的比例接种于含卡那霉素(100 μg/mL)LB 培养基中,37℃振荡培养至OD600值约为0.6,再加入异丙基硫代-β-D-半乳糖苷(IPTG)使其终浓度达到0.8 mmol/L。20℃培养12 h后,离心收集菌体,经PBS洗涤后,超声裂解细菌。4℃、12 000 r/min离心10 min。收集上清,按照美国GE公司的Glutathione Sepharose 4B亲和柱纯化蛋白说明书进行蛋白纯化,纯化的蛋白通过SDS-PAGE进行检测。1.2.3抗体制备选取新西兰大白兔,免疫前耳静脉取血,分离血清作为对照。将纯化的GST-EgPI3K P110RTK融合蛋白与等体积弗氏完全佐剂充分乳化后, 背部皮下多点注射, 以后每隔20天取抗原与等体积的弗氏不完全佐剂充分乳化后加强免疫1次, 共3次, 加强免疫的抗原剂量约为首次剂量的50%。最后一次免疫10 d后,进行心脏采血,置于无菌的试管中,室温放置1 h,4 ℃过夜, 4 000 r/min 离心10 min,吸取血清于无菌的EP 管中,-20℃保存。
1.2.4间接ELISA检测纯化重组蛋白GST-EgPI3K P110RTK(0.2 μg/孔)4℃包被ELISA板过夜,1% BSA 37 ℃封闭2 h,一抗为按1∶1 000、1∶4 000、1∶8 000、1∶16 000、1∶32 000、1∶64 000、1∶128 000、1∶256 000、1∶512 000进行稀释的免疫后兔血清,37℃孵育2 h。二抗为HRP标记的羊抗兔IgG(1∶50 000),37℃温育1 h。四甲基联苯胺(TMB)显色后,2 mol/L H2SO4终止反应。使用酶标仪检测,以免疫前血清为阴性对照。
1.2.5Western blotting检测纯化的GST-EgPI3K P110RTK融合蛋白经SDS-PAGE分离并电转移至PVDF膜。以5%脱脂牛奶37℃封闭2 h。依次用His-Egp38蛋白免疫兔血清(4℃孵育过夜,PBST 洗膜3 次)及羊抗兔IgG-HRP(用PBST 按1∶1 000稀释,室温反应2 h,PBST 洗膜4 次)处理,最后加底物二氨基联苯胺显色并拍照。
2结果
2.1重组质粒GST-EgPI3K P110RTK的鉴定重组质粒经PCR鉴定,得到约1 000 bp的EgPI3K P110RTK基因片段(图1),与预计大小相符。测序结果表明,pGEX-4T-1-EgPI3K P110RTK载体构建正确。

M:DNA分子量标准;1:PCR去离子水对照; 2:pGEX-4T-1-EgPI3K P110RTK重组质粒PCR产物
图1重组质粒pGEX-4T-1-EgPI3K P110RTK的PCR鉴定
2.2EgPI3K P110RTK融合蛋白的诱导表达和纯化经鉴定正确的重组质粒pGEX-4T-1-EgPI3K P110RTK转化至Rosetta(DE3)表达菌中,经0.8 mmol/L IPTG 37℃诱导,在诱导菌总蛋白中检测到,在66 ku处有一特异性条带(图2),未诱导组无此条带。超声后该重组蛋白以包涵体形式表达于沉淀中,经亲和层析纯化获得相对分子量约为66 ku的重组蛋白EgPI3K P110RTK(图2)。
2.3ELISA法测定结果以免疫前的血清为对照,间接ELISA法测定本实验制备的EgPI3K P110RTK抗体的效价在1∶512 000以上(图3)。
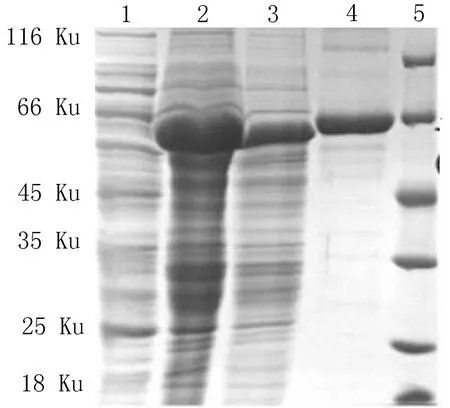
1:诱导前菌液;2:诱导后菌液;3:包涵体沉淀;4: 纯化后EgPI3K P110RTK融合蛋白;5:蛋白marker
图2SDS-PAGE分析亲和层析纯化的EgPI3K P110RTK融合蛋白的ELISA分析

2.4Western blot鉴定结果鉴定纯化蛋白以兔抗EgPI3K P110RTK抗体为一抗的western blot实验结果表明,阳性血清与10、5、1 ng和500 pg等浓度的EgPI3K P110RTK重组蛋白在66 ku左右处均有清晰的特异性结合条带(图4)。EgPI3K P110RTK重组蛋白浓度为500 pg的蛋白条带较弱,提示该抗体检测抗原的最低浓度为500 pg左右,说明已成功制备获得EgPI3K P110RTK重组蛋白的特异性抗体。

图4 不同浓度EgPI3K P110RTK蛋白的western blotting检测
3讨论
PI3K激酶作为AKT信号通路中的关键成员,在疟原虫等寄生虫侵染宿主过程中具有重要功能[13],并可作为潜在的药物靶标。为了研究细粒棘球绦虫EgPI3K的功能,本研究将EgPI3K激酶的P110亚基的酪氨酸激酶区(1-352 aa)构建到pGEX-4T-1载体上,原核表达并纯化获得了相对分子量66 ku的EgPI3K P110RTK重组蛋白,利用该蛋白免疫新西兰大白兔,获得了效价在1∶512 000以上的兔抗EgPI3K抗体。Western blot实验表明,该抗体能够识别EgPI3K P110RTK重组蛋白,本实验成功制备获得了兔抗EgPI3K P110RTK的抗体。
为了检测该抗体的灵敏度,本实验将EgPI3K P110RTK重组蛋白梯度稀释。实验结果显示,该抗体能够识别500 pg以上剂量的EgPI3K P110RTK蛋白,具有较高的检测灵敏度。当EgPI3K P110RTK蛋白量较高(10 ng和5 ng)时,可以检测到65~35 ku分子量的区域存在一些特异性条带,推测这是由于纯化的蛋白发生轻微的降解,产生的EgPI3K P110RTK蛋白片段,由于含有该蛋白的抗原决定簇,因而能够被本抗体检测发现。
本实验制备获得的兔抗EgPI3K P110RTK抗体,为下一步通过免疫组化和Western 印迹实验分别定位和定量检测EgPI3K P110RTK在细粒棘球绦虫发育不同阶段蚴虫(囊泡、原头蚴、六钩蚴和成虫)中的表达情况及细粒棘球绦虫被PI3K抑制剂干预后EgPI3K P110RTK的表达变化,奠定重要的物质基础。本研究制备获得了兔抗EgPI3K P110RTK抗体,对于研究EgPI3K P110RTK在细粒棘球蚴虫的功能及以AKT信号通路研发包虫病新药具有重要意义。
参考文献:
[1]Mcmanus DP, Zhang W, Li J, et al. Echinococcosis[J]. Lancet,2003, 362(9392): 1295-1304.
[2]王立英,伍卫平,朱雪花. 2004-2008年全国包虫病疫情分析[J]. 中国人兽共患病学报,2010, 26(7):699-702.
[3]郭莉,阳爱国,侯巍. 四川省家畜包虫病防治现状及防控对策探讨[J]. 草业与畜牧. 2011, 192(11): 52-54.
[4]Cantley LC. The phosphoinositide 3-kinase pathway[J]. Science,2002, 296(5573):1655-1657.
[5]Engelman JA, Luo J, Cantley LC. The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism[J]. Nat Rev Genet,2006, 7(8):606-619.
[6]Li H, Zeng J, Shen K. PI3K/AKT/mTOR signaling pathway as a therapeutic target for ovarian cancer[J]. Arch Gynecol Obstet,2014, 290(6):1067-1078.
[7]Whittaker S, Marais R, Zhu AX. The role of signaling pathways in the development and treatment of hepatocellular carcinoma[J]. Oncogene,2010, 29(36):4989-5005.
[8]Steelman LS, Pohnert SC, Shelton JG, et al. JAK/STAT, Raf/MEK/ERK, PI3K/Akt and BCR-ABL in cell cycle progression and leukemogenesis[J]. Leukemia,2004, 18(2):189-218.
[9]Willems L, Tamburini J, Chapuis N, et al. PI3K and mTOR signaling pathways in cancer: new data on targeted therapies[J]. Curr Oncol Rep,2012, 14(2):129-138.
[10]Daher W, Morlon-Guyot J, Sheiner L, et al. Lipid kinases are essential for apicoplast homeostasis in Toxoplasma gondii[J]. Cell Microbiol,2015, 17(4):559-578.
[11]Mott BT, Eastman RT, Guha R, et al. High-throughput matrix screening identifies synergistic and antagonistic antimalarial drug combinations[J]. Scientific Reports,2015, 5:13891.
[12]Lu G, Zhang W, Wang J, et al. Application of a cDNA microarray for profiling the gene expression of Echinococcus granulosus protoscoleces treated with albendazole and artemisinin[J]. Mol Biochem Parasitol,2014, 198(2):59-65.
[13]Vaid A, Ranjan R, Smythe WA, et al. PfPI3K, a phosphatidylinositol-3 kinase from Plasmodium falciparum, is exported to the host erythrocyte and is involved in hemoglobin trafficking[J]. Blood,2010, 115(12):2500-2507.
(本文编辑王艳)
Expression of PI3K P110 tyrosine kinase domian protein of Echinococcusgranulosus and preparation of its polyclonal antibody
ZHAO Hui1, LIU Hui2
(1LaboratoryMedicineDiagnosticCentre,2StateKeyLaboratoryIncubationBaseofXinjiangMajorDiseasesResearch,ClinicalMedicalResearchInstitute,theFirstAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830054,China)
Abstract:ObjectiveTo generate the polyclonal antibody against the PI3K P110 subunit protein of Echinococcus granulosus (Eg) for further study on the function of Eg PI3K P110 protein. MethodsThe expressing sequence of EgPI3K P110 subunit tyrosine kinase protein (1-352 AA) was subcloned into the prokaryotic expression vector pGEX-4T-1 and transformed into E. coli ROSETTA (DE3) strain. The recombinant protein expression was induced by 0.8 mmol/L IPTG, followed by purification using GST affinity chromatography and vaccinated New Zealand rabbits. The titers and reactivity of antibody was evaluated by ELISA and Western blotting. ResultsThe recombinant prokaryotic expression vector was successfully constructed, verified by restriction endonuclease digesting and DNA sequencing. Then, recombinant GST-Eg PI3K P110a was successfully expressed in E.coli ROSETTA(DE3) after induction by 0.8 mmol/L IPTG, the recombinant GST-EgPI3K P110RTK protein was 66 KD. The rabbit was vaccinated with the GST-EgPI3K P110RTK protein purified by affinity chromatography. ELISA showed that the titer of the anti-serum we′ve generated was above 5.12×105, and western-blotting result showed that the anti-serum could specifically recognize recombinant EgPI3K P110RTK. ConclusionThe polyclonal antibody against the EgPI3K P110 was successfully generated, which could lay a foundation for further study on the function of EgPI3K kinase.
Keywords:Echinococcus granulosus; EgPI3K P110; protein expression; antibody preparation
[收稿日期:2015-07-10]
doi:10.3969/j.issn.1009-5551.2016.05.011
中图分类号:Q78
文献标识码:A
文章编号:1009-5551(2016)05-0569-04
作者简介:赵辉(1982-),男,主管技师,研究方向:医学检验。通信作者:刘辉,女,学士,实验师,研究方向:寄生虫分子致病机制,E-mail:liuhui_xjmu@163.com。
基金项目:新疆维吾尔自治区包虫病基础医学重点实验室开放课题(XJDX0202-2013-10)
