POLD3在胃腺癌中的表达及临床意义分析
2016-05-13陆茵茵吴雪铭黄小英姚金光龙喜带
陆茵茵,王 超,吴雪铭,黄小英,姚金光,夏 强,马 韵,龙喜带,▲
(1.广西医科大学附属第一医院病理科,南宁 530021;2.广西医科大学附属肿瘤医院
病理科,南宁 530021;3.右江民族医学院附属医院病理科,百色 533000;
4.上海交通大学医学院附属仁济医院肝脏外科,上海 200127)
论著
POLD3在胃腺癌中的表达及临床意义分析
陆茵茵1,2,王超3,吴雪铭3,黄小英3,姚金光3,夏强4,马韵1,2▲,龙喜带3,4▲
(1.广西医科大学附属第一医院病理科,南宁 530021;2.广西医科大学附属肿瘤医院
病理科,南宁 530021;3.右江民族医学院附属医院病理科,百色 533000;
4.上海交通大学医学院附属仁济医院肝脏外科,上海 200127)
【摘要】目的探讨DNA聚合酶δ 3(eukaryote DNA polymerase δ 3,POLD3)在胃腺癌(gastric adenocarcinoma,GA)中的表达情况及临床意义。方法收集进行了根治性切除的GA患者82例,并收集相应手术切除标本。通过免疫组织化学、蛋白印迹、体外细胞学、实时定量PCR等技术检测GA组织与细胞株中POLD3的表达,分析POLD3表达对GA增殖、分化及预后等的影响。结果①与肿瘤旁组织相比,POLD3在GA肿瘤组织中的核酸及蛋白表达水平均明显下调(P<0.01),体外细胞学实验有类似结果;②低POLD3表达水平促进肿瘤去分化及增殖;③POLD3表达水平影响GA患者的预后,高表达和低表达对应的中位总体生存期分别为34个月和16个月(P<0.01),低POLD3表达者其总体死亡风险为高表达者的2.43倍(95%可信区间为1.25~4.71)。结论POLD3在GA肿瘤中表达下调,这种下调与肿瘤的增殖、分化及预后相关。
【关键词】POLD3;胃腺癌;表达;临床意义
在我国,胃腺癌(gastric adenocarcinoma,GA)是一种常见的严重危害生命健康的恶性肿瘤,是第三位癌症相关性致死原因[1]。由于国内大多数GA患者确诊时病程已处于进展期,且多数合并有局部或远处转移,故而5年存活率仅为20%左右。因此,寻求早期诊断和判断预后的标志物依然是该研究领域的重要科学问题[1]。而DNA聚合酶δ 3(DNA polymerase δ 3,POLD3)是一种重要的DNA修复功能基因,在染色体复制过程中扮演重要角色,研究已证明POLD3表达紊乱影响基因组的结构稳定性,并参与结肠癌等肿瘤的发生与发展[2~5],但POLD3在GA中的表达及临床意义如何,至今未见报道。
1材料与方法
1.1研究对象与生存随访本研究开展前获得了医院伦理委员会的关于同意开展本研究的相关伦理审批。研究对象的入选标准为:病理诊断确认的GA患者、TNM分期属于Ⅰ~Ⅱ期、接受了根治性手术切除、术前无放疗与化疗史、具有完整临床病理及生存随访资料、知情并同意参与;排除标准为:未经病理确诊、TNM分期在Ⅲ期以上、未进行根治性治疗、术前具有放疗与化疗史、临床病理及生存随访资料不全者、不同意参与者。根据以上标准,本研究共入选82例GA患者,所有研究对象均为2005年1月~2008年12月期间在右江民族医学院附属医院住院治疗的GA患者,其中男58例(70.7%),女24例(29.3%),平均年龄(53.17±11.19)岁,有抽烟或酗酒史者分别为58.5%(48/82)和56.1%(46/82)。肿瘤局限于黏膜层与黏膜下层者(即早期胃癌)4例(4.9%)、达到肌层及以外者(即进展期胃癌)78例(95.1%),这些肿瘤患者中,高分化者占65.9%(54/82),而低分化或未分化者占34.1%(28/82)。收集所有患者外科手术切除标本(含肿瘤组织与肿瘤旁组织)用于POLD3的免疫组织化学分析;此外,为分析POLD3的mRNA表达水平,我们也收集了10例新鲜标本。同时,收集所有研究对象的相关临床病理资料,包括性别、年龄、民族、吸烟史、饮酒史及肿瘤病理特征等。在本研究中,我们定义连续或累积吸烟6个月及以上者为阳性吸烟者,连续或累积酗酒3个月及以上者为阳性酗酒者。此外,我们也对所有病例进行了生存随访,随访截止日期为2014年12月,我们定义总体生存时间为根治性手术治疗后至患者死亡或至随访截止日期仍存活所经历的时间。
1.2细胞与细胞培养胃腺癌细胞株(包括高分化癌细胞株MKN-28和低分化癌细胞株MKN-45)和非肿瘤胃黏膜细胞株GES-1均购自中国科学院上海细胞生物学研究所细胞库,细胞培养于含10%胎牛血清和1%青链素的DMEM培养基中,于37℃、5%CO2的条件下培养。
1.3POLD3表达载体的构建采用PCR技术结合双酶切技术以pcDNA3.0为载体构建POLD3表达载体,具体方法参见我们以前的报道[6]。
1.4POLD3蛋白表达水平的检测采用免疫组化SABC法检测GA肿瘤组织及肿瘤旁组织中的POLD3蛋白表达水平,表达水平通过阳性细胞数与强度的乘积(即IRS评分法)确定,更为详细的方法与评分参见我们以前的报道[7]。在当前研究,为便于分析,我们定义IRS≤3分为低POLD3表达,>3分为高POLD3表达。POLD3蛋白在细胞株中的表达则通过蛋白印迹法进行检测,具体方法参见我们以前的报道[8]。
1.5POLD3核酸表达水平的检测通过Life公司生产的PureLink®RNA Mini Kit(产品编号:12183018A)和High Capacity cDNA Reverse Transcription Kit(产品编号:4368814)来抽提组织及细胞总RNA和合成cDNA,使用SYBGreen染料法实时定量PCR技术来检测POLD3 mRNA在组织或细胞株中的表达水平,以β-ACT为内参,POLD3引物为:5’-GTCTA CGAGA GTGAA TCCTG CACA-3’和5’-GGAAC TCCAA CCAAC ACCAG AA-3’,β-ACT引物为:5’-ATGGA TGATG ATATC GCCGC GC-3’和5’-ATCCA CACGG AGTAC TTGCG CTCA-3’。25 μL PCR反应体系含1×UltraSYBR Mixture(产品编号:CW2601,康维世纪)、200 nM引物,以及约50 ng的逆转录产物,PCR反应条件如下:95℃预变性2 min,95℃变性30 s,60℃退火70 s,重复50个循环。所有样本定量实验重复三次,取平均值为最终值,采用2-ΔΔCT进行线性化后分析POLD3的相对表达水平。
1.6细胞增殖分析取1000个对数期细胞种植于96孔培养板,经培养细胞分裂达60%培养板面积时,通过LipofectamineTM2000按标准流程将POLD3表达载体、空载或生理盐水转染细胞株,在转染后第1~4天,使用CCK-8增殖检测试剂盒(产品编号:CK04, DojindoCorp)检测分析细胞的OD250值,所有试验重复3次,取平均值用于计算增殖指数(proliferation index, PI),增殖指数按如下公式计算:PI=OD250Time/OD250Ref,其中OD250Time为检测时间点的OD250值,OD250Reg为转染第一天的OD250值[9]。
1.7统计学方法用SPSS 18.0统计软件进行统计学处理,组间差异采用t检验、单因素方差分析来分析,采用Spearman等级相关评价POLD3表达与肿瘤分化的相关性,通过Kaplan-Meier法绘制生存曲线与计算中位生存期(median survival time, MST),使用多因素Cox风险比例回归模型分析与计算相关变量的风险值(hazard ratio, HR)和95%的可信区间,在该模型中,我们采用退步法并结合Likelihood Ratio检验法筛选变量是否纳入模型,检验水准:α=0.05。
2结果
2.1POLD3在GA中表达下调免疫组化分析结果显示:在GA肿瘤组织中,POLD3蛋白表达水平比肿瘤旁组织明显减少(P<0.01,图1A),代表性免疫组化染色图显示了这种差异(图1B),这种差异性的POLD3表达在mRNA也存在(图1C)。体外细胞学分析亦有类似的发现(图1D和E)。
2.2POLD3表达与GA预后相关Kaplan-Meier生存分析表明:与低POLD3表达者相比,肿瘤组织中高POLD3表达的GA患者具有更长的MST,分别为16个月和34个月(P<0.01,图2);采用多因素Cox回归模型经其他风险因素如肿瘤分型、分期等的校正后,低POLD3表达者的死亡风险是高表达者的2.43倍(95%可信区间为1.25~4.71)。
2.3POLD3表达与GA肿瘤分化相关体外细胞学分析结果显示:与高分化的胃癌细胞株MKN-28相比,低分化的胃癌细胞株MKN-45其POLD3蛋白与核酸表达水平均更低(图1D和E),提示POLD3表达水平与GA肿瘤分化程度相关。GA临床样本的Spearman等级相关分析进一步证实POLD3表达水平与肿瘤分化程度呈正相关(相关系数为0.331,P=0.01)。
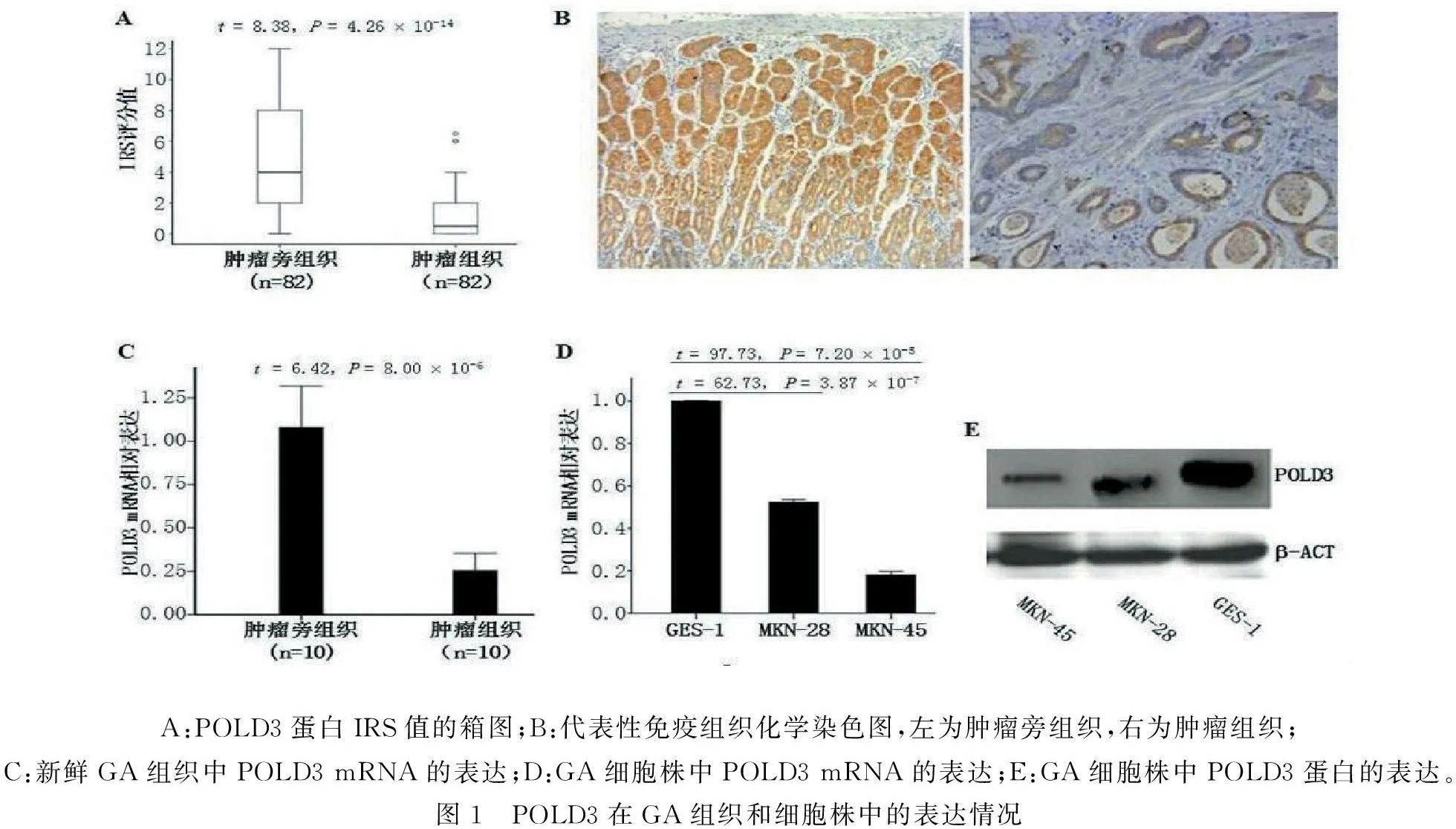
A:POLD3蛋白IRS值的箱图;B:代表性免疫组织化学染色图,左为肿瘤旁组织,右为肿瘤组织;C:新鲜GA组织中POLD3mRNA的表达;D:GA细胞株中POLD3mRNA的表达;E:GA细胞株中POLD3蛋白的表达。图1 POLD3在GA组织和细胞株中的表达情况

图2 POLD3表达与GA预后
2.4POLD3表达与GA增殖相关体外细胞学实验表明:具有低POLD3表达的MKN-45细胞株在POLD3过表达的条件下,其增殖能力明显受到抑制(表1和图3A);GA临床样本分析也发现大肿瘤具有更低的POLD3表达(图3B)。

表1 POLD3表达与GA增殖比较
注:表中F值和P值为单因素方差分析结果。

A:MKN-45细胞株中POLD3过表达对MKN-45细胞增殖的影响,图中条带为转染1天后蛋白印迹结果,*和**分别代表P<0.05和0.01;B:GA组织样本中POLD3表达与肿瘤直径的关系。图3 POLD3表达与GA增殖
3讨论
GA是一种常见的恶性肿瘤,其发生机制的研究进展缓慢,可用于早期诊断与判断预后的可信标志物依然处于艰难的探索中[1,10]。我们当前的研究显示POLD3在GA中表达紊乱,并影响GA的临床病理特征如肿瘤分化、增殖等,也许是一种有价值的研究与治疗靶点。
POL δ是DNA聚合酶B族中的重要成员,包含p125、p50、p66和p12四个亚基;在功能上,主要通过与增殖细胞核抗原的相互调节作用而涉及DNA错配修复及碱基切除修复等过程[11]。其中p66由POLD3基因编码,因其充当POL δ与增殖细胞核抗原发生交互作用的直接功能结合域,因此,POLD3对于POL δ是十分必要的,它不仅能提高POL δ与增殖细胞核抗原的亲和力,而且能增加POL δ复合体的稳定性[12]。研究表明:POLD3的表达紊乱不仅影响机体DNA错配修复及碱基切除修复的能力,而且与一些疾病的发生发展相关[2~5]。如Dunlop等[3]通过一个大样本病例-对照研究分析了POLD3的突变体与大肠癌的关系,结果显示POLD3突变体增加大肠癌的发病风险,但他们并没有能分析POLD3在肿瘤组织中的表达情况及意义。我们的研究结果显示,POLD3在GA肿瘤组织中存在表达紊乱,与非肿瘤组织或细胞相比,肿瘤组织和肿瘤细胞的POLD3核酸与蛋白水平均存在明显的下调;体外细胞学实验与GA临床样本分析均证实这种下调的POLD3表达影响肿瘤的增殖及分化,起到了类似癌基因的作用。而且,我们的研究也发现GA肿瘤组织中的POLD3表达下调与GA不良预后相关,增加死亡风险约1.4倍,这些结果提示POLD3表达紊乱也许涉及了肿瘤如胃癌的演进,是一个有待深入研究的、也许具有重要价值的潜在肿瘤标志物或治疗靶点。
总之,我们当前的研究提示POLD3在GA中表达下调,这种表达下调影响GA肿瘤生物学行为和预后,涉及GA的演进。但是,我们当前的研究仅仅包括了82例符合要求的GA样本,主要为进展期GA,也许存在一定的选择性偏倚;同时,由于样本大小的限制,基于临床病理特征的生存分层分析未能进行;尽管对POLD3表达紊乱与GA生物学行为如增殖、分化等进行了初步的探讨,但并未涉及细胞凋亡、细胞周期等的分析,基于一个大样本并结合体内外实验的研究与分析将有助于增加本研究结果的可信度与科学性。
参考文献
[1] Zang L. Laparoscopic radical gastrectomy for gastric cancer: traps and strategies[J]. Ann Transl Med,2015,3(9):125.
[2] Ogi T, Limsirichaikul S, Overmeer RM, et al. Three DNA polymerases, recruited by different mechanisms, carry out NER repair synthesis in human cells[J]. Mol Cell,2010,37(5):714-727.
[3] Dunlop MG, Dobbins SE, Farrington SM, et al. Common variation near CDKN1A, POLD3 and SHROOM2 influences colorectal cancer risk[J]. Nature genetics,2012,44(7):770-776.
[4] Pohler JR, Otterlei M, Warbrick E. An in vivo analysis of the localisation and interactions of human p66 DNA polymerase delta subunit[J]. BMC Mol Biol,2005(6):17.
[5] Kim MS, Machida Y, Vashisht AA, et al. Regulation of error-prone translesion synthesis by Spartan/C1orf124[J]. Nucleic Acids Res,2013,41(3):1661-1668.
[6] Long XD, Yao JG, Zeng Z, et al. Polymorphisms in the coding region of X-ray repair complementing group 4 and aflatoxin B1-related hepatocellular carcinoma[J]. Hepatology, 2013,58(1):171-181.
[7] Long XD, Ma Y, Zhou YF, et al. Polymorphism in xeroderma pigmentosum complementation group C codon 939 and aflatoxin B1-related hepatocellular carcinoma in the Guangxi population[J]. Hepatology,2010,52(4): 1301-1309.
[8] Li J, Xu Y, Long XD, et al. Cbx4 governs HIF-1alpha to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity[J]. Cancer Cell,2014,25(1):118-131.
[9] Liu YX,Long XD,Xi ZF, et al. MicroRNA-24 Modulates Aflatoxin B1-Related Hepatocellular Carcinoma Prognosis and Tumorigenesis[J]. BioMed research international, 2014,2014:482926.
[10] Lordick F, Allum W, Carneiro F, et al. Unmet needs and challenges in gastric cancer: the way forward[J]. Cancer Treat Rev,2014,40(6): 692-700.
[11] Baranovskiy AG,Lada AG,Siebler HM,et al. DNA polymerase delta and zeta switch by sharing accessory subunits of DNA polymerase delta[J]. J Biol Chem,2012,287(21):17281-17287.
[12] Shikata K,Ohta S,Yamada K,et al. The human homologue of fission Yeast cdc27, p66, is a component of active human DNA polymerase delta[J]. J Biochem,2001,129(5):699-708.
(编辑:潘明志)
An analysis of POLD3 expression in the gastric adenocarcinoma and its clinical significance
LUYinyin1,2,WANGChao3,WUXueming3,HUANGXiaoying3,YAOJinguang3,XIAQiang4,MAYun1,2▲,LONGXidai3,4▲
(1.DepartmentofPathology,TheFirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China;2.DepartmentofPathology,CancerHospitalAffiliatedtoGuangxiMedicalUniversity,Nanning530021,China; 3.DepartmentofPathology,AffiliatedHospitalofYoujiangMedicalUniversityforNationalities,Baise533000,China; 4.DepartmentofLiverSurgery,RenjiHospitalAffiliatedtoSchoolofMedicineofShanghaiJiaotongUniversity,Shanghai200127,China)
【Abstract】ObjectiveTo explore the expression levels of eukaryote DNA polymerase δ 3(POLD3) in the gastric adenocarcinoma (GA) and its clinical significance. MethodsA total of 82 patients with GA undergoing radical resection were selected and the corresponding surgical resection samples were collected. The expression levels of POLD3 in the tissular samples and cell lines of GA were evaluated by immunohistochemistry, western blotting, in vitro cells analysis and real-time quantitative PCR, etc. Next, influence of POLD3 expression levels on tumor proliferation, differentiation and prognosis of GA was analyzed. Results ①Expression levels of POLD3, including mRNA and protein levels, significantly decreased compared with adjacent tumor tissues(P<0.01), and similar results were also found in the in vitro cytology experiments. ②This down-regulating expression of POLD3 promoted tumor dedifferentiation and proliferation.③The levels of POLD3 expression affected GA prognosis, with 34 months and 16 months of middle overall survival time for high and low POLD3 expression, respectively(P<0.01). Overall risk of death of patients with low POLD3 expression levels was 2.43 times (95% confidence interval 1.25~4.71) higher than that of patients with high POLD3 expression. ConclusionPOLD3 expression is down-regulated in the GA, and this down-regulation may be associated with GA proliferation, differentiation and prognosis.
【Key words】POLD3; GA; expression; clinical significance
(收稿日期:2015-12-22修回日期:2016-02-26)
中图分类号:R735.2
文献标识码:A
DOI:10.3969/j.issn.1003-1383.2016.01.001
作者简介:陆茵茵,女,病理学专业硕士研究生。E-mail: luyinyin611@qq.com▲通信作者:龙喜带。E-mail: sjtulongxd@263.net
基金项目:国家自然科学基金资助项目(81572353,81372639,81160255,81472243,81460423);广西自然科学基金资助项目
(2013GXNSFAA019251,2014GXNSFDA118021,2014GXNSFAA118144,2015GXNSFAA139223);上海市曙光学者资助计划
(13SG19)
马韵。E-mail: yunandama@hotmail.com
