纯化功能性大豆低聚糖酵母菌的筛选及发酵特性初步应用
2016-05-09陆薇帏汪立平
陆薇帏,汪立平
(上海海洋大学 食品学院,上海水产品加工及贮藏工程技术研究中心,上海,201306)
纯化功能性大豆低聚糖酵母菌的筛选及发酵特性初步应用
陆薇帏,汪立平*
(上海海洋大学 食品学院,上海水产品加工及贮藏工程技术研究中心,上海,201306)
摘要采用改良的WL培养基,运用DNS和HPLC相结合的方法检测酵母菌对大豆乳清低聚糖的利用情况,从自然界中筛选和分离出能够选择性降解大豆乳清中蔗糖的酵母菌。试验结果表明,酵母菌PL08对蔗糖具有极强的降解作用,发酵后所得功能性低聚糖的纯度达到96.70%,是理想的目的菌种。通过18S rDNA序列对比对微生物种属进行鉴定酵母菌PL08为异常威克汉姆酵母(Wickerhamomyces anomalus)。同时研究了酵母菌PL08发酵大豆乳清废水的动态过程表明,发酵30 h时,棉籽糖和水苏糖的保留率分别为87.90%和82.16%,蔗糖的降解率为93.46%,功能性低聚糖的纯度达到94.12%,确定为最适发酵周期。
关键词大豆低聚糖;序列分析;酵母菌发酵
大豆乳清是工业上生产大豆分离蛋白(SPL)和大豆浓缩蛋白(SPC)的副产物,含有相当丰富的大豆低聚糖,但由于处理费用高昂等原因多直接排放到外界,对环境造成严重的污染[1],如果能够采取低成本处理再利用方法,将是一个变废为宝的过程。大豆低聚糖主要由棉籽糖、水苏糖和蔗糖组成,其中棉籽糖和水苏糖是具有功能性的糖类,属于功能性低聚糖,其功能特性主要表现在:促进双歧杆菌的增殖,防止腹泻和便秘,改善血清脂质的作用,抗肿瘤等[2]。蔗糖为非功能性低聚糖。为了除去蔗糖,提高功能性低聚糖的纯度,目前常规的分离方法[3]有:色谱柱分离法、膜分离法、酶法、微波提取法和酵母发酵法。
酵母发酵法即考虑微生物对底物利用的选择性,筛选出优先利用蔗糖、最大限度保留功能性低聚糖的菌种[3]。酵母发酵法是一种绿色环保的制备方法,具有方便,周期短,成本低等优点,有望投放于工业化大生产,为实现生产方法的简捷化提供基础。EGOUNLETY和AWORH[4]通过实验发现,经过发酵处理的大豆低聚糖,其蔗糖含量降低,棉籽糖的含量则基本稳定无变化,但水苏糖在48 h完全降解。本文主要通过把WL培养基的碳源替换为蔗糖,从自然界分离出可利用蔗糖的酵母菌,进一步采用DNS、HPLC相结合的方法筛选出能够高强度降解蔗糖而基本不利用功能性低聚糖的酵母菌,并对其鉴定,确定种属。同时采用HPLC跟踪测糖法对不同发酵时间各组分糖浓度进行分析,根据非功能性低聚糖最高降解率和功能性低聚糖最高保留率的原则确定最适发酵周期。
1材料与方法
1.1材料与仪器
1.1.1酵母来源
土壤(葡萄根系周围);水果(市售苹果、生梨、葡萄、桂圆等)。
1.1.2培养基
筛选培养基:改良的WL分离培养基[5]:酵母浸膏5 g,蛋白胨5 g,蔗糖50 g,琼脂20 g,KH2PO40.55 g,KCl 0.425 g,CaCl20.125 g,MgSO40.125 g,FeCl30.002 5 g,MnSO40.002 5 g,蒸馏水1 000 mL。调pH值至6.5,121 ℃高压灭菌20 min后每1 L培养基分别加1 mL储液A和储液B。储液A:0.44 g溴甲酚绿溶于10 mL水和10 mL酒精中;储液B:250 mg氯霉素溶于10 mL酒精中。
种子培养基:酵母膏3 g,胰蛋白胨10 g,蔗糖20 g,麦芽浸膏3 g,蒸馏水1 000 mL,121 ℃高压灭菌20 min。
发酵培养基:实验室收集大豆浓缩蛋白乳清,外观糖浓度8 °Brix,121 ℃高压灭菌20 min。
1.1.3主要设备及试剂
3.加快有关权证审批,缩短申贷时限。针对土地、规划、环评等证照审批慢的问题,建议政府有关部门加快建设用地、项目规划、环评批复等审批效率,并加强各环节相互衔接,帮助企业早日达到融资条件,获得信贷支持。
DKY控温调速摇床,上海杜科设备公司;Epichemi 3 凝胶成像仪,美国 UVP 公司;Waters 2695-2489 HPLC (示差折光检测器),日本waters公司;氨基柱(Hanbon,型号:5 μm,250×4.6 mm)。DP307酵母菌DNA提取试剂盒,天根生物技术公司;实验用引物,上海生工生物技术公司合成。液相用标准品:蔗糖(分析纯),棉子糖(α-A18313),国药集团化学试剂有限公司;水苏糖(S120981),上海晶纯生化科技股份有限公司,纯度均大于98%。
1.2方法
1.2.1酵母菌筛选方法
将预处理的样品稀释涂布于改良的WL培养基上,25 ℃培养箱中培养2~3 d,观察菌落颜色及形态并进行革兰氏染色用于镜检,按照颜色及形态的不同分离酵母菌,记录并标号。将挑选所得的酵母菌于种子培养基中纯化,以8%的接种量接种于发酵培养基,每8 h DNS跟踪测糖,保留样品进行HPLC检测各组分糖含量。
1.2.2酵母菌的鉴定
DP307试剂盒提取 DNA,采用酵母菌18S rRNA基因引物OY1 (5’-AATAACTTTTCGAATCGCAT-3’)和OY2 (5’-AAGACTTTGATTTCTCGTA-3’)进行PCR扩增,PCR体系为30 μL:上下引物各1 μL(50 pmol/μL),模板DNA 3 μL,Taq mix 15 μL,无菌双蒸水补齐至30 μL。PCR扩增条件:94 ℃预变性2 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸5 min。
取3 μL的PCR产物于0.8%琼脂糖凝胶中进行电泳检测。将PCR产物纯化后送至上海生工生物技术有限公司测序,将测序结果在NCBI数据库进行Blast检索在线比对分析,并通过 MEGA5 软件构建系统发育树。
1.2.3目的酵母菌的发酵方法
种子培养:将目的菌种活化后,转接入种子培养基中,25 ℃、150 r/min培养24 h。
1.2.4分析检测方法
发酵液总糖的测定:初筛按照DNS法测定总糖含量[6]。
发酵液各组分糖的定量测定:高效液相色谱分析法[7]。V(乙腈)∶V(超纯水)=70∶30;流动相流速:1.00 mL/min;样品进样量:10 μL;柱温:40 ℃;检测器温度:40 ℃;检测时间20 min。按照外标法计算发酵液中大豆低聚糖的含量。
酒精含量的测定:采用比重密度法测定。
菌体干重检测:将发酵液离心,沉淀用蒸馏水洗涤两次,所得菌体用2 mL蒸馏水悬浮后移至干燥皿,65 ℃下烘干至恒重,所得净重即为细胞干重(g/L)。
2结果与分析
2.1分离的酵母菌表型特征
WL培养基广泛用于酵母菌的快速鉴别中[5]。根据改良WL培养基菌落颜色和菌落形态,从自然界分离纯化出能够利用蔗糖的19株天然酵母。结果如表1。革兰氏染色观察19株菌落形态分为纺锤形和椭圆形。
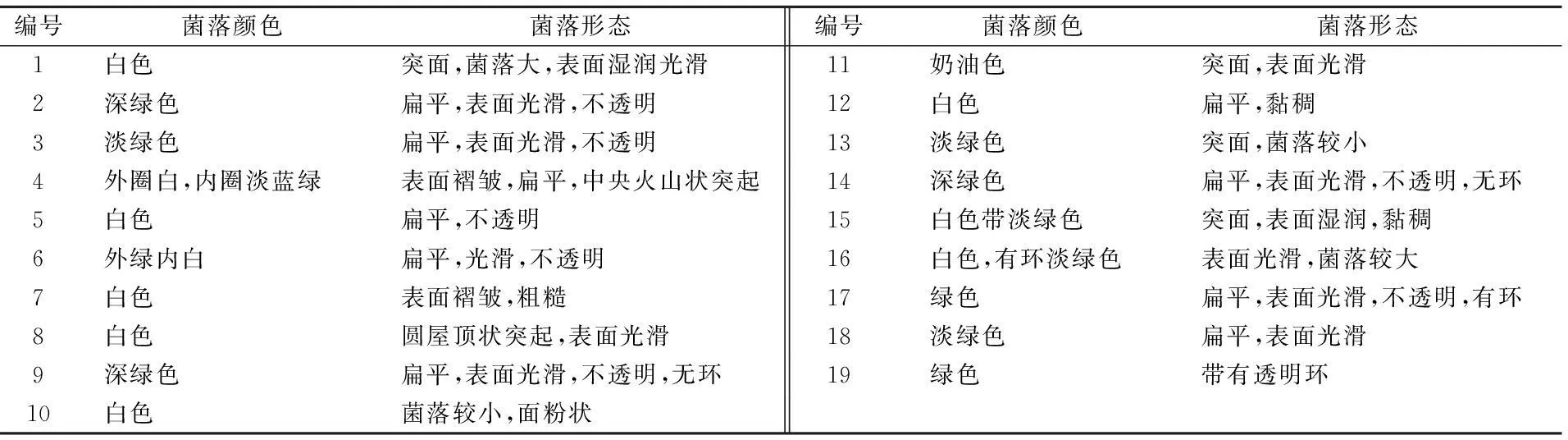
表1 不同酵母菌株的菌落颜色与菌落形态
2.2DNS法测不同酵母发酵过程中总糖的变化
将大豆乳清发酵液水解后,根据葡萄糖标准曲线计算总糖含量并绘制菌体降糖曲线,见图1,结果表明,自然界筛选的菌种对大豆乳清低聚糖的利用程度有明显区别,有一部分能够很好的利用大豆乳清废水中的碳源,其中1号、8号、9号、14号4株菌种随着发酵时间的延长,总糖浓度明显降低,具有较强的降糖能力,保留样液进行HPLC色谱分析。

图1 菌体降糖曲线Fig.1 The curve of saccharide reducing for the yeasts
2.3HPLC法测酵母发酵过程中各组分糖的变化
根据图1 DNS的测定结果,32 h总糖含量下降稳定,采用HPLC外标法测定出该时段4株酵母发酵液所含蔗糖、棉籽糖、水苏糖的浓度,如表2。试验结果表明,1号、14号、9号虽然有明显的耗糖能力,但对于功能性低聚糖的消耗能力也很强,不符合目的菌种的特性;而8号既可以极大程度的利用大豆乳清废水中的非功能性成分,利用率达到96.4%,而对于功能性成分没有明显的消耗作用,对棉籽糖和水苏糖的降解率分别为12%和9.7%,功能性糖的纯度高达96.7%,符合目的菌种的特性,标记为PL08。

表2 发酵32 h各组分糖的含量
2.4真菌 18S rDNA 的PCR扩增及测序结果分析
PCR扩增获得约900 bp的特异性条带,见图2。将PCR扩增后的产物纯化后送上海生工生物技术公司测序,得到的基因片段序列在NCBI数据库中进行Blast检索,最终结果为:PL08酵母与异常威克汉姆酵母(W. anomalus)序列相似,同源性为99%。将各序列与其相似度较大的基因序列载入MEGA5中,进行多重序列比较分析,构建系统发育树的结果如图3所示,PL08酵母与异常威克汉姆酵母(KP027011.1)基因相似度为100%。根据形态学及18S rDNA序列比对综合分析,鉴定PL08为酵母与异常威克汉姆酵母,将该菌株18S rDNA序列上传到Genbank,得到登陆号KT003715。相关文献记载,该菌株是一种兼具了酿酒酵母和产酯酵母双重特性的功能菌,常用于酿酒工业,安全无毒,对于以后应用到大豆乳清制备功能性低聚糖的安全性提供了保障。

1~5-PL08的PCR产物;6-Marker图2 目标酵母菌PL08提取的18S rDNA的PCR电泳图Fig.2 Gel electrophoresis analysis of 18S rDNA amplification

图3 菌株PL08的 18S rDNA 系统发育进化树Fig.3 Phylogenetic trees for 18S rDNA sequence of the strain PL08
2.5大豆乳清发酵过程分析
进行3次平行发酵实验,根据酵母菌PL08纯化功能性大豆低聚糖的发酵实验数据,绘制细胞干重、蔗糖含量、酒精产量随时间的变化曲线,如图4所示。

图4 酵母菌PL08发酵大豆乳清主要指标变化趋势Fig.4 The metabolic curves of fermentation process
由图4可知,6~21 h为对数生长期,随着酵母菌PL08的生长,酒精产量逐渐升高,蔗糖大幅度消耗,是纯化功能性大豆低聚糖的关键时期。21 h之后进入稳定期,细胞干重基本恒定,酒精产量快速积累,蔗糖含量消耗速率减缓,达到24 h时蔗糖含量基本保持稳定。
2.6最适发酵周期的确定
根据HPLC测得的酵母菌PL08在发酵过程中蔗糖、棉籽糖、水苏糖3种主要糖浓度的变化,所绘曲线如图5所示。由图5可知,发酵初始,6 h蔗糖的降解率仅为3.52%,随着发酵时间延长蔗糖含量降低,30 h时蔗糖浓度低至0.93 mg/mL,降解速率逐步减缓,此时棉籽糖和水苏糖的保留率分别为87.90%和82.16%,功能性低聚糖的纯度达到94.12%,蔗糖的降解率为93.46%。 30 h之后,由于糖供应量的不足,酵母PL08逐步开始利用功能性低聚糖,直至50 h,蔗糖被完全消耗,降解率达到100%,但棉籽糖和水苏糖的保留率仅有9.88%和33.83%,不符合最大程度纯化功能性低聚糖的目的,故确定30 h为最佳发酵周期。

图5 发酵过程中各组分糖的变化Fig.5 The curves of the concentration of sugars in fermentation process
3结论
本研究通过采用改良WL培养基的方法,从自然界筛选出可纯化功能性大豆低聚糖的优良酵母菌种PL08,所得功能性低聚糖纯度达到96.7%,并通过18S rDNA 序列比对综合分析鉴定该酵母菌PL08为异常威克汉姆酵母(W.anomalus)。根据实验结果得,异常威克汉姆酵母菌PL08发酵大豆乳清30 h就可达到最佳的纯化目的,此时棉籽糖和水苏糖的保留率分别为87.90%和82.16%,功能性低聚糖的纯度
达到94.12%,蔗糖的降解率为93.46%。继续发酵跟踪测糖发现,酵母菌PL08开始利用功能性低聚糖,其功能性低聚糖的保留率逐渐降低,故为符合高效率纯化大豆低聚糖的目的,确定30 h为最佳发酵周期。综上,所筛酵母菌PL08异常威克汉姆酵母较目前相关报道的文献,具有纯化力强,周期短的特点,此外该酵母菌兼具了酿酒酵母和产酯酵母双重特性,对于以后应用到大豆乳清制备功能性低聚糖的安全性提供了保障。
参考文献
[1]张闪闪,汪立平,王锡昌.利用大豆浓缩蛋白乳清制备水苏糖的发酵条件[J].大豆科学,2008,27(1):137-140.
[2]卢义伯,潘超.大豆功能因子的研究进展[J].现代食品科技,2006,22(2):105-108.
[3]武嘉文,孔凡宾.从大豆乳清水中提取大豆低聚糖的方法[P].中国专利:CN1364763.2002.08.21.
[4]EGOUNLETY M,AWORH O C.Effect of soaking,dehulling,cooking and fermentation with Rhizopus oligosporus on the oligosaccharides,trypsin inhibitor,phytic acid and tannins of soybean (Glycine max Merr.),cowpea (Vigna unguiculata L. Walp) and groundbean (Macrotyloma geocarpa Harms)[J].Journal of Food Engineering,2003,56(2):249-254.
[5]PALLMANN C L,BROWN J A,OLINEKA T L,et al. Use of WL medium to profile native flora fermentations[J].American Journal of Enology and Viticulture,2001,52(3):198-203.
[6]韩德权,章佳佳.DNS法在普鲁兰多糖发酵液中糖测定的研究[J].食品工业科技,2008,29 (2):285-286.
[7]王玉军,纪伟东,李永平,等.高效液相色谱法测定大豆低聚糖中的棉籽糖和水苏糖[J].现代食品科技,2010,26(7):750-752.
Isolation and identification of yeasts for purification of soy oligosaccharides and preliminary application of its fermentation characteristics
LU Wei-wei, WANG Li-ping*
(College of Food Science and Technology, Shanghai Ocean University, Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China)
ABSTRACTOne strain of yeast with high consumption ability to sucrose and high retention rate to stachyose and raffinose was isolated from nature through WL medium using DNS combined with HPLC. Rresults showed that strain PL08 had higher utilization ability for sucrose. The consumption rate for sucrose after fermentation reached 96.7%, while it almost could not utilize the raffinose and stachyose, which meet the requirements for the ideal strains. Through 18S rDNA partial gene sequence analysis, the strain PL08 was identified as Wickerhamomycesanomalus. The analysis on dynamic process of soybean whey fermented with yeast PL08 showed that fermentation time of 30h was determined as the optimum fermentation period. At this time point, the retention rate of raffinose and stachyose was 87.76% and 82.07% respectively, and that the degradation rate of sucrose was 93.46%.
Key wordssoybean oligosaccharides; 18S rRNA; yeast fermentation
收稿日期:2015-10-13,改回日期:2015-12-04
基金项目:上海市科委工程中心建设(11DZ2280300)
DOI:10.13995/j.cnki.11-1802/ts.201603029
第一作者:硕士研究生(汪立平教授为通讯作者,E-mail:lpwang@shou.edu.cn)。
