盐胁迫对发菜胞外多糖结构及其理化性质的影响
2016-05-09路苗陈雪峰赵秀霞王宁王贵春孙玉姣
路苗,陈雪峰,赵秀霞,王宁,王贵春,孙玉姣
(陕西科技大学 食品与生物工程学院,陕西 西安, 710021)
盐胁迫对发菜胞外多糖结构及其理化性质的影响
路苗,陈雪峰*,赵秀霞,王宁,王贵春,孙玉姣
(陕西科技大学 食品与生物工程学院,陕西 西安, 710021)
摘要对液体培养的发菜细胞进行盐胁迫处理,研究盐胁迫对发菜胞外多糖结构及其部分理化性质的影响。提取纯化正常及盐胁迫培养下的发菜胞外多糖(分别命名为NEPS、YEPS),测定糖含量、单糖组成、糖苷键类型、保湿性、吸湿性、热稳定性等,分析发菜胞外多糖对盐胁迫的响应。结果表明:NEPS与YEPS单糖组成种类一致,但含量发生明显变化;红外光谱、高碘酸氧化分析可知,两者特征吸收峰基本一致,均有β-D-吡喃葡萄糖及糖醛酸,糖苷键键型主要以1—6为主,可能存在1—2、1—4键;原子力显微镜观察显示NEPS与YEPS的分子微观结构存在明显差异,NEPS呈尖锥状结构,YEPS呈棒状结构;YEPS的吸湿性及热稳定性均高于NEPS。
关键词发菜;胞外多糖;盐胁迫;化学结构;理化性质
发菜,学名发状念珠蓝细菌(Nostocflagelliforme),是一种光合自养型陆生蓝细菌。发菜胞外多糖(extracellular polysaccharide, EPS)是发状念珠藻分泌到细胞外的长链多糖,包裹于细胞及藻丝体外,对细胞起保护作用,使其能抵御外部恶劣的生长环境。此外,发菜多糖还具有抗肿瘤、抗病毒、抗氧化等生物活性[1],具有极高的药用价值和开发潜力。
近年来,发状念珠蓝细菌对逆境胁迫的响应备受国内外学者的关注,藻细胞在逆境胁迫条件下,形态、功能及抗逆活性物质等产生了相应变化[2-4]。陈雪峰[5]等研究了发菜细胞在不同浓度盐胁迫下胞外多糖的分泌量,结果发现处于0.3 mol/L NaCl胁迫环境时,EPS的分泌量较正常培养细胞增加了50.3%。本课题重点研究了盐胁迫对多糖的结构和部分理化性质的影响,系统分析比较了2种培养环境下发菜多糖的单糖组成、糖苷键键型、微观结构及部分物化性质(保湿性、吸湿性和热稳定性能)的变化。
1材料与方法
1.1材料与试剂
发菜,宁夏银川贺兰山东部;乙腈,色谱纯;BG-110培养基、1-苯基-3-甲基-5-吡唑啉酮(PMP)、咔唑、浓硫酸、三氟乙酸(TFA)、单糖标准品、高碘酸钠、碘酸钠、二甲基亚砜、壳聚糖、甘油,均为分析纯。
1.2仪器与设备
Waters1525-2487高效液相色谱系统,美国Waters公司;紫外-可见分光光度计,上海美谱达仪器有限公司;VERTE70傅立叶红外光谱分析仪,德国Bruker公司;SPA400原子力显微镜,日本精工株式会社;STA449 F3热重分析仪,德国Bruker公司。
1.3实验方法
1.3.1发菜细胞盐胁迫处理
无菌条件下离心收集指数生长末期的发菜细胞,重新接种于NaCl浓度为0.3 mol/L的BG-110培养液中,对照组不含NaCl,在光照强度60 μmol/(m2·s),光暗比12∶12,温度白天25℃,夜晚10℃,连续培养10 d。发菜胞外多糖的提取纯化参照陈雪峰等[6]的研究方法,培养液离心(10 000 r/min,10 min)去除藻细胞,浓缩上清液,采用Sevage法去除蛋白后加4倍体积分数95%乙醇沉淀12 h,沉淀物加水溶解后透析48h,干燥得粗多糖。粗多糖经DEAE-52离子交换柱层析分离得到多糖纯化物,冷冻干燥后用于结构鉴定及理化性质测定,正常环境及盐胁迫环境下发菜胞外多糖纯化物分别命名为NEPS、YEPS。
1.3.2总糖及糖醛酸含量分析
以葡萄糖为标准,采用苯酚-硫酸法测定多糖中总糖的含量。以葡萄糖醛酸为标准,采用硫酸-咔唑法测定多糖中糖醛酸的含量[7]。
1.3.3单糖组成分析
采用柱前衍生高效液相色谱法测定发菜胞外多糖的单糖组成。色谱条件:色谱柱:Waters Symmetry C18(4.6 mm×250 mm,5.0 μm);流动相:乙腈(A)-0.05 mol/L pH 6.9磷酸盐缓冲液(B);洗脱模式:梯度洗脱,时间梯度为0 min→10 min→20 min→35 min→40 min,对应流动相体积分数梯度20%→20%→23%→25%→20%(A);流速:1 mL/min;柱温:30℃;检测波长:245 nm;进样体积:20 μL。
1.3.4红外光谱分析
分别称取NEPS与YEPS样品,与充分干燥的溴化钾混合压片,在4 000~600 cm-1区间内进行红外光谱扫描。
1.3.5高碘酸氧化分析
参照孙利芹等[8]的研究方法。分别称取4 mg NEPS与YEPS样品,溶于4 mL 15 mmol/L的高碘酸钠溶液中,在低温、避光条件下进行氧化。间隔12 h取样,测定223 nm处的吸光值。通过标准曲线计算每摩尔糖基消耗高碘酸的量。同时取样2.5 mL反应液,滴加2滴乙二醇终止反应,放置20 min后以溴甲酚紫为指示剂,用0.010 15 mol/L NaOH(用邻苯二甲酸氢钾标定)标准液滴定甲酸生成量。
1.3.6原子力显微镜观测
分别配制10 μg/mL 的NEPS、YEPS多糖溶液。大气环境中、室温下采用SPA400多功能扫描探针显微镜对发菜多糖的分子形态进行扫描观测。图像均在contact模式下进行,微悬臂长200 pm,探针为Si3N4,弹性系数0.2 N/m。AFM图像的形态学特征均采用原子力显微镜附带软件进行分析。
1.3.7吸湿性测定
参照刘红辉等[9]的研究方法。将待测样品及对照品置于真空干燥箱内,50℃干燥24 h,准确称取干燥后的NEPS、YEPS、甘油和壳聚糖30 mg于称量瓶中,控制环境温度20℃,将200 mL饱和NaCl溶液倒入干燥器底部,保持环境密闭性。每隔10 h称重1次,计算吸湿率(式1)。

(1)
式中:mn为放置n小时后样品及称量瓶总质量,mg;mo为放置前样品及称量瓶总质量,mg;m为样品的质量,mg。
1.3.8保湿性测定
将变色硅胶、待测样品及对照品置于真空干燥箱内,50℃干燥24 h,将200 g变色硅胶放入干燥器底部,控制环境温度为20℃。准确称取干燥后的NEPS、YEPS、甘油和壳聚糖30 mg于称量瓶中,分别加入2滴蒸馏水充分混匀,放入干燥器中,保持环境密闭性。每隔10h取出称重,计算保湿率(式2):
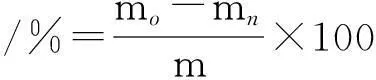
(2)
式中:mn为放置n小时后样品、蒸馏水及称量瓶总质量,mg;mo为放置前样品、蒸馏水及称量瓶总质量,mg;m为样品与蒸馏水的质量,mg。
1.3.9热稳定性测定
采用综合热分析仪检测发菜胞外多糖样品的热力学特性曲线。测定条件:样品用量为8 mg,氮气氛围中测试,气体流速20 mL/min;升温程序为室温~800 ℃,升温速率10 ℃/min。
2结果与分析
2.1盐胁迫对发菜胞外多糖化学结构的影响
2.1.1总糖及糖醛酸含量分析
对不同环境培养的发菜胞外多糖理化性质分析具体数据见表1,结果表明,NEPS与YEPS的总糖含量分别为73.43%、75.48%,糖醛酸含量分别为6.37%、7.39%。

表1 含量分析
2.1.2单糖组成分析
如图1所示,NEPS与YEPS均由甘露糖、鼠李糖、葡萄糖醛酸、葡萄糖、半乳糖、木糖等单糖组成,NEPS单糖对应摩尔比为0.71∶0.37∶0.44∶1.53∶1.03∶0.40,YEPS单糖对应摩尔比为1.02∶0.48∶0.57∶1.47∶1.40∶0.34。2种培养环境下的胞外多糖单糖组成种类一致,但对应的比例发生了明显的变化,盐胁迫环境下甘露糖、鼠李糖、葡萄糖醛酸以及半乳糖的含量明显高于正常环境,而葡萄糖与木糖的含量有所降低。有其他藻类的研究证实,微生物胞外多糖的合成分泌与生长环境有着密切联系[10-11]。
2.1.3红外光谱分析
图2为2种培养条件下发菜胞外多糖的红外光谱图,其分析结果示于表2。NEPS与YEPS在4 000~500 cm-1内具有多糖性质的一般特征吸收, 其中1 630 cm-1处的吸收峰是羧酸离子伸缩振动,可以断定含有糖醛酸,867 cm-1处是β-D-吡喃葡萄糖的特征吸收峰,该结论与单糖组成的测定结果一致[12-14]。

图1 混合标准单糖(A)、NEPS水解物(B)和YEPS水解物(C)HPLC色谱图Fig.1 HPLC chromatograms of mixed standard monosaccharides and the hydrolyzate of NEPS and YEPS

图2 NEPS(A)与YEPS(B)红外光谱图Fig.2 The IR spectrum of NEPS and YEPS

吸收波数/cm-1NEPSYEPS特征官能团振动方式3539/33393552/3405O—H键的伸缩振动2923/28462915/2864C—H键的伸缩振动16301621CO键的伸缩振动14191431C—H键的变角振动11451136醇羟基—OH键的变角振动867867β-D-吡喃葡萄糖
2.1.4高碘酸氧化反应
高碘酸反应是一种选择性氧化反应,可以选择性地断裂糖分子中连二羟基或三羟基处,产生相应多的糖醛、甲醛或甲酸。反应定量进行,每断开1 mol C—C键消耗1 mol高碘酸,生成1 mol甲酸消耗2 mol高碘酸。根据高碘酸氧化标准曲线及样品高碘酸氧化曲线(图3),计算得高碘酸氧化数据,结果列于表3。
由表3可知,低温下避光处反应168 h后,高碘酸氧化反应完全, NEPS与YEPS均有甲酸生成,说明存在1-6键型,而两者高碘酸消耗量均大于甲酸生成量的2倍,说明其中有C—C键消耗了高碘酸却不产生甲酸,很有可能存在1—2,1—4键型[8]。

图3 高碘酸钠消耗量标准曲线(A)与样品高碘酸氧化曲线(B)Fig.3 The sample curve of periodate oxidation
2.1.5原子力显微镜观测结果
NEPS与YEPS原子力显微镜观测结果如图4所示。图4-a′是NEPS的3D地形图, 可看到分子形貌如尖锥状结构,高度约5~20nm,直径约50~300 nm。图4-a中可看到单独游离于溶液的糖链结构,直径约20 nm,长度约2 000 nm。说明尖锥结构是由多个糖链缠绕形成,这可能是由于多糖分子间的相互作用以及糖醛酸形成的链间氢键所致。YEPS分子形貌呈现棒状结构,高度约60 nm,长度约1 200~2 000 nm,以及糖链旋转缠绕形成的聚集体,未见单独的糖链结构。造成发菜胞外多糖分子微观结构差异的原因可能是由于YEPS含有较多的糖醛酸,氢键及分子间作用力增大,从而形成更为紧密的聚集体[15]。

表3 高碘酸氧化结果分析

图4 NEPS(a-a′)与YEPS(b-b′)AFM图Fig.4 AFM images of NEPS and YEPS
2.2盐胁迫对发菜胞外多糖理化性质的影响
2.2.1盐胁迫对发菜胞外多糖吸湿性的影响
以甘油和壳聚糖为对照品,考察NEPS、YEPS及对照品的吸湿性能(图5)。由图5可知,多糖样品及甘油的吸湿率在10 h内迅速增长,10 h后甘油的吸湿率继续增强,30 h后趋于饱和,多糖样品的吸湿率10 h后基本趋于饱和,壳聚糖吸湿率较弱,维持在5%以下。 50 h,样品的吸湿率分别为甘油63.6%、YEPS 31.0%、NEPS 15.5%和壳聚糖3.7%。结果表明,YEPS、NEPS和壳聚糖的吸湿率均明显小于甘油,而YEPS的吸湿率比NEPS明显提高。吸湿率的增强与样品所含亲水性基团数量息息相关,YEPS吸湿率的增强,说明盐胁迫处理致使单糖组成发生变化,增加了糖链中亲水基团的数量。
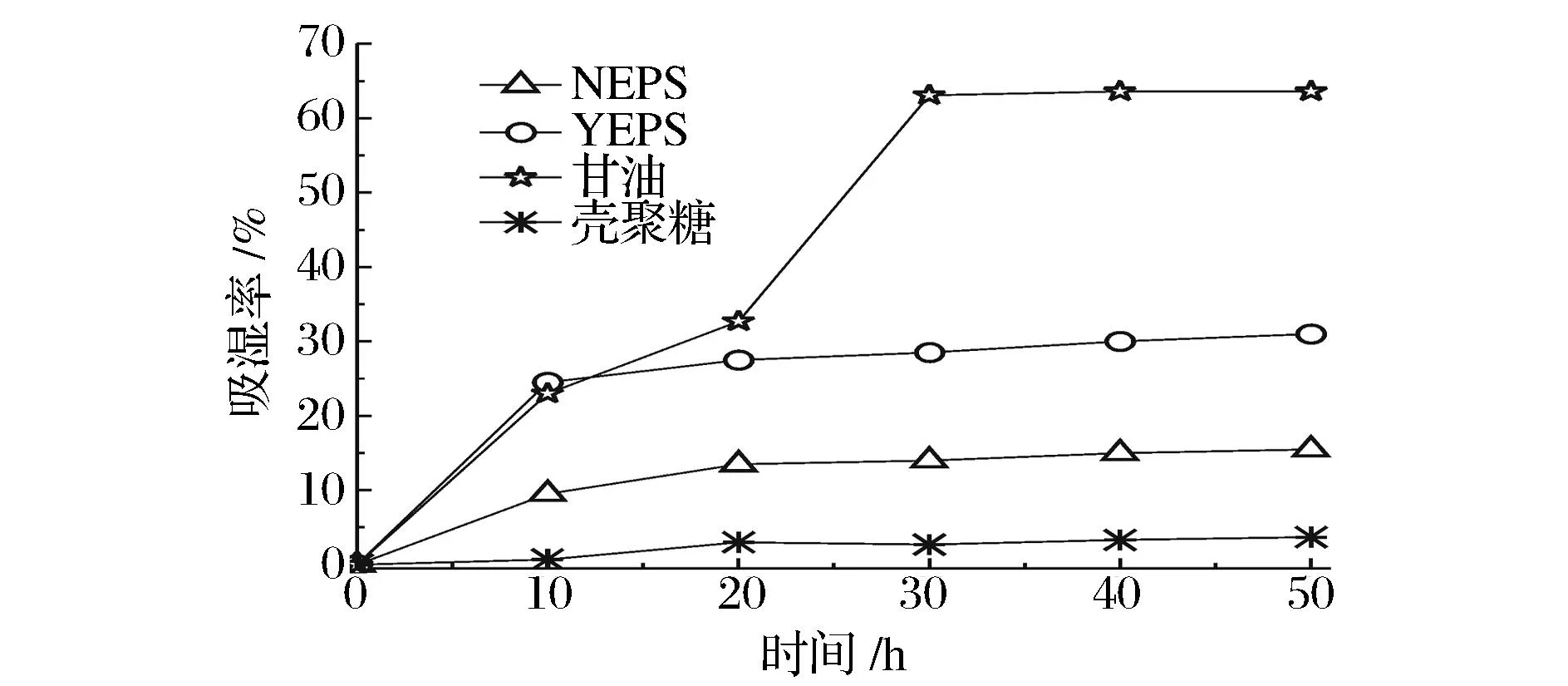
图5 NEPS、YEPS、甘油、壳聚糖吸湿性能Fig.5 Moisture absorption rate of NEPS,YEPS,glycerin and chitosan
2.2.2盐胁迫对发菜胞外多糖保湿性的影响
以甘油和壳聚糖为对照品,考察NEPS、YEPS及对照品的保湿性能(图6)。由图6可知,各样品的保湿率随着时间的推移而减小,其保湿率大小的顺序为:壳聚糖>YEPS>NEPS>甘油。造成这种结果的原因可能是甘油是小分子,在干燥环境中其小分子结构限制了其与水结合的能力。2种发菜胞外多糖均具有良好的保湿性,保湿率均在40%以上,YEPS保湿率略高于NEPS。

图6 NEPS、YEPS、甘油、壳聚糖保湿性能Fig.6 Moisture retention rate of NEPS,YEPS,glycerin and chitosan
2.2.3盐胁迫对发菜胞外多糖热稳定性的影响
从TG/DTG曲线(图7)得知,NEPS和YEPS热分解曲线分为3个阶段,两者具有相似的热力学性质,但也存在不同之处(表4)。40~170 ℃是降解的第一阶段,失重主要是失去多糖物理作用吸附的水分;200~350 ℃是降解的第二阶段,样品在高温下分子内部化学键断裂,YEPS与NEPS分别于260 ℃、269 ℃达到降解最大速率;700~800 ℃是降解的第三阶段,降解结束后NEPS失重比率明显高于YEPS,说明盐胁迫使发菜胞外多糖结构更加稳定,具有更高的热稳定性。
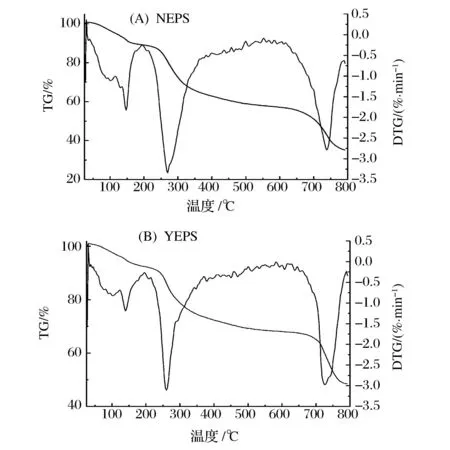
图7 NEPS(A)与YEPS(B)的TG/DTG曲线Fig.7 TG-DTG curves of NEPS(A) and YEPS(B)

单位:%
3结论
盐胁迫是存在于干旱、半干旱和灌溉地的一种主要的胁迫形式。蓝藻分布范围极广,具有很好的耐盐性,目前已有大量关于蓝藻对盐胁迫响应的报道,但其代谢产物对盐胁迫的响应未见深入研究。本课题以正常环境和盐胁迫环境培养所得的胞外多糖为材料,通过分析发现两者单糖种类、糖苷键类型等化学结构基本一致,但单糖组成、微观结构及部分理化性质有明显的差异。NEPS呈规则的尖锥状结构,YEPS则呈棒状结构,体积约为前者的6~8倍 ,YEPS的吸湿性及热稳定性也高于NEPS。盐胁迫下的发菜胞外多糖对环境产生了一定的响应,可见次级代谢产物的合成受到了逆境的影响,产生了相应的变化,但逆境下的合成规律仍需进一步研究,为逆境响应机制提供数据基础。
参考文献
[1]苏振宏,王芳,尹美珍,等. 发状念珠藻胞外聚合物分离纯化及抗肝癌活性初步研究 [J]. 时珍国医国药,2012(11):2 788-2 789.
[2]郭金英,史明科,赵艳丽,等. 发状念珠蓝细菌细胞对Cu2+、Cr2+和Pb2+胁迫的响应 [J]. 微生物学报,2013,53(6):553-560.
[3]HAN Pei-pei,SUN Ying,JIA Shi-ru,et al. Effects of light wavelengths on extracellular and capsular polysaccharide production byNostocflagelliforme[J]. Carbohydrate Polymers,2014,105:145-151.
[4]赵学敏,毕永红,秦山,等. 发菜细胞培养物对盐胁迫的响应 [J]. 西北植物学报,2005,25(11):2 234-2 239.
[5]陈雪峰,王贵春,刘宁,等. 盐胁迫发菜胞外多糖的抗氧化活性 [J]. 陕西科技大学学报:自然科学版,2015(01):122-125+135.
[6]陈雪峰,李一当,贾士儒. 发菜多糖的提取、纯化鉴定及理化特性研究 [J]. 食品与发酵工业,2008,34(10):174-177.
[7]方东军,赵润琴,张晓娟. 茯苓多糖的总糖含量及糖醛酸含量测定 [J]. 中医药信息,2011,28(4):42-44.
[8]孙利芹,王凌,马翠华,等. 紫球藻多糖化学结构解析 [J]. 天然产物研究与开发,2012(5):569-574.
[9]刘红辉,李敏,汲红丽,等. 紫球藻胞外多糖抗氧化和保湿性能的研究 [J]. 食品研究与开发,2014,35(5):1-5.
[10]BRÜLL L P,HUANG Z B,THOMAS-OATES J E,et al. Studies of polysaccharides from threeedible species of Nostoc (Cyanobacteria) with different colony morphologies:structural characterization and effect on the complement system ofpolysaccharides from Nostoc commune [J]. J Phycol,2000,36:871-881.
[11]AVINASH M,BHAVANATH J. Isolation and characterization of extracellular polymericsubstances from micro-algae Dunaliellasalina under salt stress [J]. BioresourceTechnology,2009,100(13): 3 382-3 386.
[12]梁燕茹,李文权,刘四光. 自养小球藻硫酸多糖的红外光谱分析 [J]. 海洋科学,2007,31(11):1-4.
[13]CHEN Yin,MAO Wen-jun,YANG Yu-pin, et al. Structure and antioxidant activity of an extracellular polysaccharide fromcoral-associated fungus, Aspergillus versicolor LCJ-5-4 [J]. Carbohydrate Polymers,2012,87(1):218-226.
[14]闫景坤. 抗氧化型冬虫夏草胞外多糖的制备、结构与溶液特征研究 [D]. 广州:华南理工大学,2010:63-64.
[15]窦佩娟,张静,吕青青,等. 碱提工艺对茶树菇多糖形貌特征和构象及其生物活性的影响 [J]. 生物加工过程,2013,11(4):22-30.
Effects of salt stress on structural characteristics and functional properties of extracellular polysaccharide fromNostocflagelliforme
LU Miao, CHEN Xue-feng*, ZHAO Xiu-xia, WANG Ning,WANG Gui-chun, SUN Yu-jiao
(College of Food and Biological Engineering, Shaanxi University of Science and Technology, Xi’an 710021,China)
ABSTRACTNostoc flagelliforme cells were cultured under salt stress to explore the changes in structural characteristics and physicochemical properties of extracellular polysaccharide. Monosaccharide composition, glycoside bond, moisture absorption and moisture resistance changes were discussed to analysis the response of extracellular polysaccharide to salt stress. The results indicated that the monosaccharide composition of NEPS and YEPS changed significantly. IR, periodate oxidation analysis showed that NEPS and YEPS, which were basically the same characteristic absorption peaks, both contained β-D-glucopyranose and uronic acid. Glycoside bond type was mainly dominated 1—6, but 1—2, 1—4 may exist. Atomic force microscopy images showed that there were obvious differences of NEPS and YEPS, the former formed pyramid structure, and the latter formed rod-like structure. YEPS showed better moisture absorption and thermal stability than NEPS.
Key wordsNostoc flagelliforme;extracellular polysaccharide;salt stress;structural characteristics; physicochemical properties
收稿日期:2015-08-28,改回日期:2015-11-04
基金项目:国家青年科学基金项目(31401633);陕西科技大学科学基金后补助项目(2014XHBZ-10)
DOI:10.13995/j.cnki.11-1802/ts.201603021
第一作者:硕士研究生(陈雪峰教授为通讯作者,E-mail:chenxf@sust.edu.cn)。
