肉桂酸钾对柑橘采后主要病原真菌的抑制作用
2016-05-09盖智星王日葵贺明阳周炼韩冷黄小兰
盖智星,王日葵,2,3,贺明阳,2,3*,周炼,2,3,韩冷,2,3,黄小兰
1(西南大学柑桔研究所,重庆, 400712) 2(中国农业科学院柑桔研究所,重庆, 400712) 3(国家柑桔工程技术研究中心,重庆, 400712)
肉桂酸钾对柑橘采后主要病原真菌的抑制作用
盖智星1,王日葵1,2,3,贺明阳1,2,3*,周炼1,2,3,韩冷1,2,3,黄小兰1
1(西南大学柑桔研究所,重庆, 400712)2(中国农业科学院柑桔研究所,重庆, 400712)3(国家柑桔工程技术研究中心,重庆, 400712)
摘要探讨了肉桂酸钾对柑橘意大利青霉、指状青霉、胶孢炭疽菌生长的抑制作用。采用生长速率法测定肉桂酸钾对致病真菌菌丝生长、产孢及孢子萌发的抑制作用,并通过细胞膜通透性及细胞膜完整性试验阐述肉桂酸钾对3种致病真菌的作用方式。结果表明:肉桂酸钾对3种病原真菌表现出不同程度的生长抑制作用,由大至小依次为指状青霉、意大利青霉、胶孢炭疽菌,肉桂酸钾质量浓度为4 mg/mL时,3种病原真菌的菌丝生长抑制率分别为100%、53.88%、45.29%。肉桂酸钾作用于病原真菌,菌悬液的相对电导率升高,DNA和蛋白质等內溶物释放,表明细胞膜通透性及完整性发生改变。肉桂酸钾对柑橘采后主要病原真菌具有较强的抑制作用,甚至是杀伤作用,适于作为柑橘保鲜剂。
关键词柑橘;采后病原真菌;肉桂酸钾;抑菌活性
柑橘采后贮运期间的主要侵染性病害包括由意大利青霉(Penicillium italicum)引起的青霉病、由指状青霉(Penicillium digitatum)引起的绿霉病[1]、由胶孢炭疽菌 (Colletotrichum gloeosporioides)引起的炭疽病[2]等,由此造成的柑橘采后腐烂损失十分严重。传统化学药剂[3-4]保鲜效果良好且操作简单,因此在柑橘采后大规模应用,但易产生药剂残留及耐药性问题。为此,寻找高效、安全的保鲜方法已成为柑橘采后贮运中亟待解决的问题。
肉桂酸钾是天然肉桂酸的钾盐,具有很好的可溶性与防腐性能,对人体无毒无害,是一种优良的食品防腐剂[5]。肉桂酸钾在酸性条件下可转化为肉桂酸,肉桂酸对多种革兰氏阳性菌、革兰氏阴性菌及真菌均有较好的抑制效果。已报道肉桂酸对枯草杆菌、金黄色葡萄球菌、大肠杆菌、绿脓杆菌、白色假丝酵母、面包酵母、黑曲霉、腐霉菌均有抑菌活性[6-8],如周梦娇等[9-10]报道了桂枝提取液对柑橘指状青霉与意大利青霉具有较好的抑菌效果。但目前肉桂酸系列防腐剂在果蔬保鲜方面的研究总体较少,且抑菌试验的对象多集中于食品腐败菌,而对果蔬采后病原真菌的抑制作用鲜有报道。本试验以柑橘意大利青霉、指状青霉、胶孢炭疽菌等柑橘采后主要致病菌为供试菌,通过测定菌丝生长速率、产孢量、孢子萌发率、电导率及內溶物释放量,探究肉桂酸钾对指状青霉、意大利青霉、胶孢炭疽菌的抑制作用。
1材料与方法
1.1材料与仪器
意大利青霉、指状青霉、胶孢炭疽菌,中国农业科学院柑桔研究所贮藏课题组保存;肉桂酸钾,湖北运成药业有限公司,为分析纯;马铃薯葡萄糖琼脂培养基(potato dextrose agar, PDA),北京奥博星生物技术有限责任公司。
SPX-150-Z生物恒温培养箱,上海博泰实验设备有限公司;SW-CJ-1F超净工作台,苏净集团苏州安泰空气技术有限公司;LDZX-50FBS高压灭菌锅,上海申安医疗器械公司;MS2000生物显微镜,重庆赛奥光电有限公司;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;DDS-307电导率仪,上海精密科学仪器有限公司;H1850R高速冷冻离心机,湘仪离心机仪器有限公司。
1.2试验方法
1.2.1肉桂酸钾对致病真菌菌丝生长的抑制作用
将3种真菌在PDA培养基培养5 d后,用打孔器制成直径为7.5 mm、厚度为2 mm的菌饼。制作含药培养基方法:向PDA培养基中加入肉桂酸钾,使肉桂酸钾的最终质量浓度为0.125、0.25、0.5、1、2、4 mg/mL。以不含药的PDA平板为空白对照,将菌饼反接到培养皿中央,每个处理3个重复。28 ℃恒温培养,十字交叉法测量菌落直径(mm),按公式(1)计算菌丝生长抑制率;以肉桂酸钾浓度的对数值(x)与菌丝生长抑制率的概率值(y)计算毒力回归方程及抑制中浓度(EC50)。

(1)
1.2.2肉桂酸钾对致病真菌产孢的抑制效果
意大利青霉、指状青霉、胶孢炭疽菌分别在肉桂酸钾质量浓度为0.125、0.25、0.5、1、2、4 mg/mL的PDA培养基上28 ℃培养7 d,纯PDA培养基为对照组。意大利青霉、胶孢炭疽菌用10 mL无菌水清洗培养基,指状青霉用5 mL无菌水清洗,洗液用10层纱布过滤获得全部孢子,以血球计数板计数,按式(2)计算产孢抑制率。

(2)
1.2.3肉桂酸钾处理对致病真菌孢子萌发的抑制作用
将不同浓度的含药培养基制做成直径为7.5 mm的小饼,按照藏睿等[11]描述的方法制成保湿小室,将小饼置于其中,滴加20 μL孢子悬浮液(105spores/mL)。26 ℃恒温培养7 h,记录孢子萌发率。以纯培养基作为对照,每个处理检查孢子数大于200个,孢子的萌发以芽管的长度超过孢子直径(长径)的一半为标准。

(3)
孢子萌发抑制率/%=
(4)
1.2.4肉桂酸钾对病原真菌最小抑制浓度(MIC)和最小杀菌浓度(MFC)的测定
采用倍半稀释法制成不同浓度梯度的含药平板,接种20 μL浓度为1×105spores/mL的孢子悬浮液,均匀涂布。28 ℃培养48 h后进行观察,以完全无菌生长的最低药剂浓度为MIC。继续培养7 d,以完全无菌生长的最低药剂浓度为MFC。
1.2.5细胞膜通透性测定
采用电导率法测定细胞膜的通透性。称取菌丝1 g(湿重),加入15 mL无菌水,配制1 mg/mL肉桂酸钾溶液,测定电导率的本底值J0。分别在5、15、30、60、120、180、240 min后取出离心(4 000 r/min、10 min),测定上清液的电导率J1。最后将菌丝煮沸处理15 min,冷却后离心,测定电导率为J2。计算每个时间段的相对电导率。
(5)
1.2.6细胞膜完整性测定
根据LV等[12]的方法略有改进。称取菌丝0.5 g(湿重),加入20 mL磷酸缓冲液(0.1 mol/L,pH=7.0),加入肉桂酸钾使得最终质量浓度为0、1、4 mg/mL,28 ℃下培养3 h。离心取上清液测定260 nm与230 nm下的吸光度,根据公式(6)、公式(7)计算菌液中DNA与蛋白质的浓度。
DNA浓度=49.10×A260-3.48×A230
(6)
蛋白质浓度=183.00×A230-75.80×A260
(7)
以上各项测定均为3重复,取平均值。
2结果与分析
2.1肉桂酸钾对致病真菌菌丝生长的抑制作用
如图1所示,肉桂酸钾对意大利青霉、指状青霉、胶孢炭疽菌菌丝表现出不同程度的生长抑制作用。随着浓度的提高,其对3种真菌菌丝的生长抑制作用也随之增强,但当肉桂酸钾质量浓度达到2 mg/mL后,抑制率增长速度降低。质量浓度为4 mg/mL的肉桂酸钾对意大利青霉、指状青霉及胶孢炭疽菌的菌丝生长抑制率分别为53.88%,100%和45.29%,对指状青霉的生长抑制作用最明显。
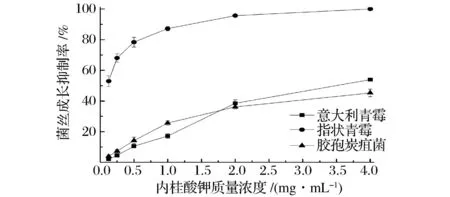
图1 肉桂酸钾质量浓度对致病真菌菌丝生长抑制率的影响Fig.1 Effects of potassium cinnamate with different concentrations on inhibitory rate of mycelium growth of fungal pathogens


表1 肉桂酸钾对致病真菌菌丝生长的抑制作用
2.2肉桂酸钾对致病真菌产孢量的抑制作用
真菌产生孢子是由它的遗传特性决定的,同时受环境条件的影响很大。如图2所示,随着肉桂酸钾浓度的提高,其对指状青霉、意大利青霉、胶孢炭疽菌的产孢抑制作用增强。当肉桂酸钾质量浓度在0.125~1 mg/mL时,指状青霉产孢抑制率的增速较快,当肉桂酸钾质量浓度大于1 mg/mL时,指状青霉产孢抑制率变化缓慢;肉桂酸钾对3种菌的产孢抑制率变化趋势虽然一致,但抑制程度有明显差异,对意大利青霉与胶孢炭疽菌产孢的抑制作用要小于对指状青霉的抑制作用,当肉桂酸钾质量浓度为4.0 mg/mL时的抑制率分别为93.18%、74.18%和60.75%。
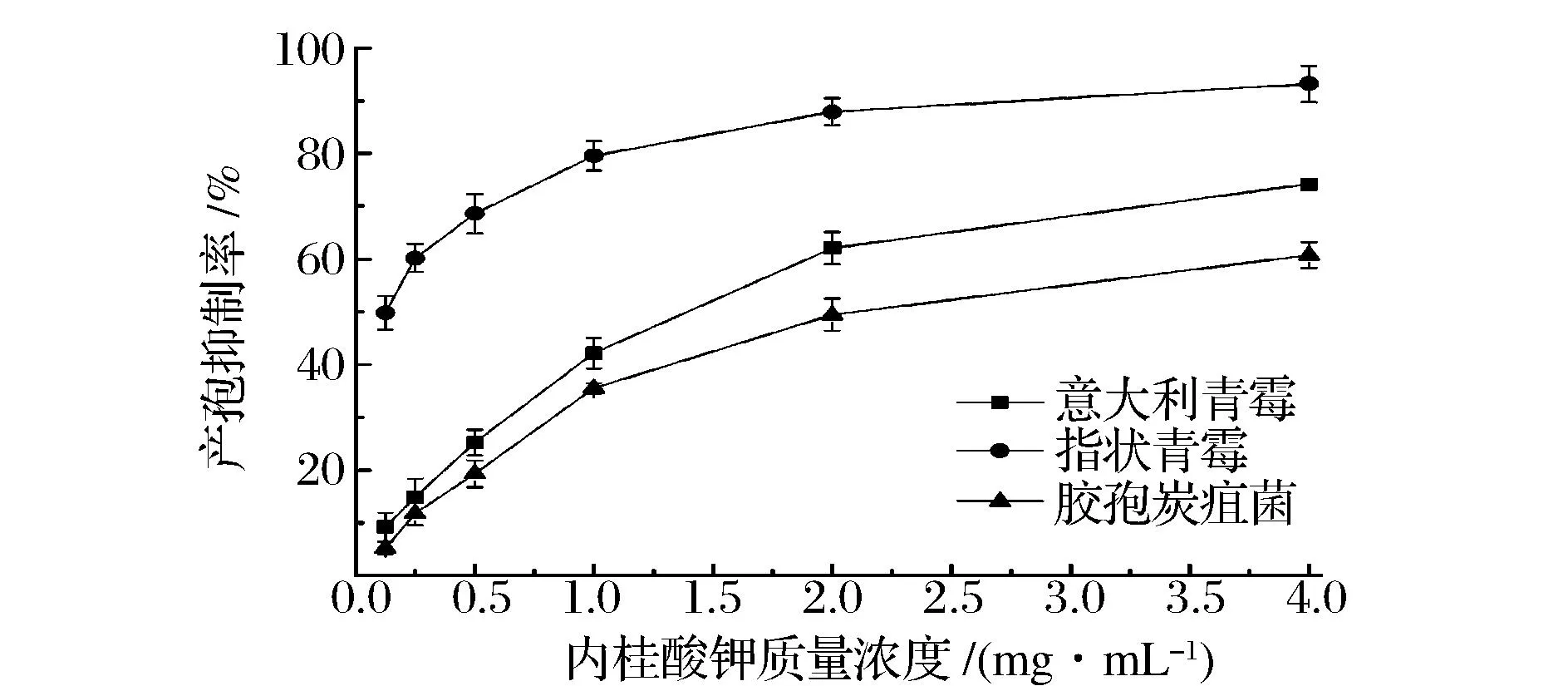
图2 肉桂酸钾浓度对致病真菌产孢抑制率的影响Fig.2 Effects of potassium cinnamate with different concentrations on inhibitory rate of conidia production of fungal pathogens
毒力回归方程直线斜率可以反映病原菌对药剂的敏感性,斜率越大表明敏感性越强。由表2数据可知,意大利青霉与胶孢炭疽菌较指状青霉对肉桂酸钾更为敏感;由χ2和P值可知,该模型对肉桂酸钾浓度与病原菌产孢抑制率的模拟拟合度良好;由EC50可知肉桂酸钾对指状青霉产孢的毒性较大,其次是意大利青霉。
2.3肉桂酸钾对胶孢炭疽菌孢子萌发的抑制作用
如图3所示,不同浓度的肉桂酸钾对3种病原真菌孢子萌发均有一定的抑制作用,且随着肉桂酸钾浓度的增加,抑制率增大。当肉桂酸钾质量浓度大于1 mg/mL时,意大利青霉与指状青霉的孢子萌发抑制率为100%。肉桂酸钾质量浓度为2 mg/mL时,胶孢炭疽菌孢子萌发抑制率为100%。周灵灵等[15]对R-多糖对荔枝胶孢炭疽菌孢子萌发抑制作用进行研究,发现R-多糖浓度对数值与孢子萌发抑制率的几率值之间成线性相关,这与本研究结果不同。本研究中,肉桂酸钾质量浓度在1~2 mg/mL时,孢子萌发抑制率急速升高,使得肉桂酸钾浓度对数值与孢子萌发抑制率的几率值之间不存在线性相关,原因有待确认。

表2 肉桂酸钾对致病真菌产孢量的抑制作用
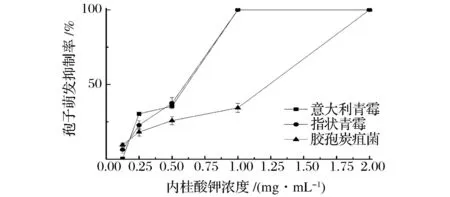
图3 肉桂酸钾浓度对致病真菌孢子萌发抑制率的影响Fig.3 Effects of potassium cinnamate with different concentrations on inhibitory rate of spore germination of fungal pathogens
2.4肉桂酸钾对3种病原真菌的MIC和MFC
由表3可知,肉桂酸钾对意大利青霉、指状青霉和胶孢炭疽菌的最低抑制质量浓度相同,均为0.5 mg/mL,最低杀菌浓度由小到大依次为指状青霉、意大利青霉、胶孢炭疽菌,这与肉桂酸钾浓度对致病真菌菌丝生长抑制率的拟合模型所得的EC50值大小排序结果相吻合。

表3 肉桂酸钾对3种病原真菌的MIC和MFC
2.5肉桂酸钾对胶孢炭疽菌细胞通透性的影响
菌悬液中相对电导率的变化反应肉桂酸钾对菌体膜通透性的影响。细胞膜是细胞与细胞环境间的半透膜屏障,对于细胞的物质进出具有选择性调节作用。

A-意大利青霉;B-指状青霉;C-胶孢炭疽菌图4 肉桂酸钾对致病真菌膜通透性的影响Fig.4 Effects of potassium cinnamate on permeability of the fungal pathogens cell membrane
如图4所示,3种菌悬液中的相对电导率随时间的延长总体呈上升趋势。意大利青霉在肉桂酸钾处理60 min内,菌液中相对电导率增长迅速;指状青霉在肉桂酸钾处理前120 min,菌液相对电导率处于上升趋势;胶孢炭疽菌与肉桂酸钾作用的前60 min,菌液中相对电导率迅速增大,随后,相对电导率值处于稳定状态,这与张赟彬等[16]研究肉桂醛对大肠杆菌和金黄色葡萄球菌抑制作用的结果相似。经1 mg/mL肉桂酸钾处理的菌悬液中相对电导率要远高于对照组。对照组相对电导率的升高可能与正常菌体的自溶和死亡有关。肉桂酸钾使得细胞膜透性增大,使离子稳态遭到破坏[17],从而影响菌体的正常代谢。
2.6肉桂酸钾对胶孢炭疽菌细胞膜完整性的影响
菌体DNA、蛋白质的释放可以表明肉桂酸钾对菌体细胞膜完整性的影响,测定结果如表3所示。随着肉桂酸钾浓度的增大,菌悬液中DNA与蛋白质的含量均呈增大趋势,其中胶孢炭疽菌悬液中的DNA浓度增幅最大,其次为指状青霉;胶孢炭疽菌悬液中的蛋白质浓度增幅最大,其次为意大利青霉。肉桂酸钾质量浓度为4 mg/mL时,胶孢炭疽菌悬液中的DNA和蛋白质浓度最高。试验结果表明肉桂酸钾对细胞膜完整性会造成破坏,引起细胞内含物质外流,严重影响了菌体的正常生长代谢,从而抑制了病原真菌的繁殖,此结果与刘淑宇等[18]的研究结果相符。

表3 肉桂酸钾对致病真菌內溶物释放的影响
3结 论
(1)肉桂酸钾对3种病原真菌均有抑菌效果,抑制作用由大到小依次为指状青霉、意大利青霉和胶孢炭疽菌;
(2)肉桂酸钾作用于病原真菌,可抑制孢子萌发,抑制作用由大到小依次为意大利青霉、指状青霉和胶孢炭疽菌;
(3)肉桂酸钾可改变病原真菌的细胞膜通透性,破坏细胞膜完整性,使得3种病原真菌新陈代谢紊乱直至死亡,可见肉桂酸钾不仅对致病菌具有抑制作用,还具有杀伤作用。
参考文献
[1]LOUW J P,KORSTEN L.Pathogenicity and host susceptibility of Penicillium spp. on citrus[J].Plant Disease,2015,99(1):21-30.
[2]CANNON PF,BUDDIE A G,BRIDGE P D.The typification of Colletotrichum gloeosporioides[J].Mycotaxon,2008,104:189-204.
[3]SCHIRRA M,D’AQUINO S,CABRAS P,et al. Control of postharvest diseases of fruit by heat and fungicides:efficacy,residue levels,and residue persistence.A review[J].Journal of Agricultural and Food Chemistry,2011,59(16):8 531-8 542.
[4]D’AQUINO S,PALMA A,ANGIONI A,et al. Residue levels and efficacy of fludioxonil and thiabendazole in controlling postharvest green mold decay in citrus fruit when applied in combination with sodium bicarbonate[J]. Journal of Agricultural and Food Chemistry,2013,61(2):296-306.
[5]李春发,徐峥嵘.肉桂酸钾在软饮料中的应用[J].宁夏农林科技.2012,53(6):117-118.
[6]梁盛年,段志芳,付莉,等.几种肉桂酸衍生物与肉桂酸的抑菌作用比较研究[J].食品科技,2005,26(9):71-73.
[7]张春乐,宋康康,陈祥仁,等.肉桂酸及其衍生物的抑菌活性研究[J].厦门大学学报:自然科学版, 2006,45(B05):16-18.
[8]SAID S,NEVES F M,GRIFFITHS A J F.Cinnamic acid inhibits the growth of the fungus Neurospora crassa,but is eliminated as acetophenone[J].International Biodeterioration & Biodegradation,2004,54(1):1-6.
[9]周梦娇,万春鹏,陈金印.柑橘绿霉病中草药高效抑菌剂的筛选及抑菌机理研究[J].现代食品科技,2014,30(3):144-149.
[10]周梦娇,万春鹏,陈金印.11种中草药提取物对柑橘意大利青霉抑菌活性及机理研究[J].食品与发酵工业,2014,40(4):37-41.
[11]藏睿,黄丽丽.苹果树腐烂病菌分生孢子萌发及其影响条件研究[J].西北农业学报,2007,16(1):64-67.
[12]LV F, LIANG H, YUAN Q,et al. In vitro antimicrobial effects and mechanism of action of selected plant essential oil combinations against four food-related microorganisms[J].Food Research International,2011,44(9):3 057-3 064.[13]周梦娇.桂枝提取物对柑橘采后主要病原真菌抑菌活性的研究[D].南昌:江西农业大学,2014.
[14]胡美姣,高兆银,李敏,等.72种中草药提取物对香蕉,芒果果实采后病害病原菌的抑菌活性[J].果树学报,2007,24(3):349-354.
[15]周灵灵,高海燕,李标,等.R-多糖对荔枝炭疽病菌的抑制作用研究[J].中国食品学报,2011,11(7):61-66.
[16]张赟彬,刘笑宇,姜萍萍,等.肉桂醛对大肠杆菌和金黄色葡萄球菌的抑菌作用及抑菌机理研究[J].现代食品科技,2015,31(5):006.
[17]COX S D,MANN C M,MARKHAM J L,et al. Determining the antimicrobial actions of tea tree oil[J].Molecules,2001,6(2):87-91.
[18]刘淑宇,于新,陈发河,等.绿色木霉菌发酵液对杧果炭疽菌的生长抑制及细胞损伤作用[J].果树学报,2012,29(6):1 097-1 102.
Antifungal acitivity of potassium cinnamate against the main postharvest fungal pathogens of citrus fruits
GE Zhi-xing1, WANG Ri-kui1,2,3, HE Ming-yang1,2,3*,ZHOU Lian1,2,3, HAN Leng1,2,3, HUANG Xiao-lan1
1(Citrus Research Institute, Southwest University, Chongqing 400712, China)2(Citrus Research Institute, Chinese Academy of Agricultural Sciences, Chongqing 400712, China)3(National Citrus Engineering Research Center, Chongqing 400712, China)
ABSTRACTThe antifungal activities of potassium cinnamate against the growth of Penicillium italicum, Penicillium digitatum and Colletotrichum gloeosporioides were evaluated. Agar plate test was conducted to test the inhibitory effect of potassium cinnamate on mycelium growth, conidia production and spore germination of fungal pathogens. Furthermore, the antifungal mechanism was explored by assay on cell membrane permeability and integrity. The results showed that potassium cinnamate displayed strong antifungal activity to Penicillium digitatum, Penicillium italicum, Colletotrichum gloeosporioides from high to low. When the concentrations of potassium cinnamate was 4mg/mL, the inhibitory rate of mycelium growth of three fungal pathogens were 100%, 53.88% and 45.29%, respectively. After treatment with potassium cinnamate, the relative electric conductivity increased rapidly and the cellular constituent released, indicating that the permeability and integrity of the cell membrane was affected. Consequently, potassium cinnamate had a strong inhibitory action and lethal effect on postharvest pathogens of citrus, and was suitable to be used as a citrus preservative to inhibit the growth of fungal pathogens.
Key wordscitrus; postharvest fungal pathogens; potassium cinnamate; antifungal activity
收稿日期:2015-10-10,改回日期:2015-11-16
基金项目:公益性行业(农业)科研专项经费项目(201203034);中央高校基本科研业务费专项(XDJK2013C014);重庆市应用开发计划项目(cstc2013yykfA80008);重庆市科技支撑示范工程项目(cstc2014fazktjcsf80007)
DOI:10.13995/j.cnki.11-1802/ts.201603019
第一作者:硕士研究生(贺明阳博士为通讯作者,E-mail:hemingyang@cric.cn)。
