实时荧光定量PCR定量检测山核桃干腐病病菌潜伏侵染量方法的建立
2016-04-27朱致翔时浩杰雷飞斌张传清浙江农林大学农业与食品科学学院浙江临安311300
朱致翔,时浩杰,雷飞斌,张传清(浙江农林大学农业与食品科学学院,浙江临安311300)
实时荧光定量PCR定量检测山核桃干腐病病菌潜伏侵染量方法的建立
朱致翔,时浩杰,雷飞斌,张传清
(浙江农林大学农业与食品科学学院,浙江临安311300)
摘要:由茶麋子葡萄座腔菌Botryosphaeria dothidea引起的山核桃Carya cathayensis干腐病是山核桃栽培过程中的主要病害,该病菌表现明显的“潜伏侵染”特性。研究山核桃树体中干腐病菌的定量检测技术对山核桃干腐病的预测预报及科学防治具有重要的指导意义。根据茶麋子葡萄座腔菌的EF1α基因设计特异性引物,通过普通聚合酶链式反应(PCR)和实时荧光定量PCR(real-time PCR)扩增发现引物EFRT-F1/R1对山核桃干腐病病菌的特异性及扩增效率较高,可稳定扩增出230 bp的目标条带。应用此特异性引物建立的实时荧光定量PCR干腐病病菌检测方法能够定量检测出山核桃植株样品中的病菌含量,灵敏度要比普通PCR高100倍。图6参8
关键词:森林保护学;山核桃干腐病;实时荧光定量PCR;特异性引物;基因组DNA
山核桃Carya cathayensis又名核桃楸、胡桃楸,胡桃科Juglandaceae山核桃属Carya植物。山核桃的果实种仁极富营养价值和口感,深受消费者喜爱,具有很高的经济价值。山核桃干腐病是山核桃在栽培生产过程中一种常见的病害,染病植株产量会明显下降,严重时可造成植株死亡,影响农户收益[1]。山核桃干腐病菌Botryosphaeria dothidea属子囊菌纲Ascomycetes葡萄座腔菌科Botryosphaeriaceae葡萄座腔菌属Botryosphaeria[2]。葡萄座腔菌属的特性多为子座散生,内含多个子囊壳,壳壁黑褐色,子囊壳呈球形或近球形,顶端具乳头状突起,孔口外露;子囊黑褐色倒棒状,内含8个子囊孢子。子囊孢子梭形,无色透明,单胞,椭圆形,双列,大小(16.8~26.4)μm×(7.0~10.0)μm。山核桃干腐病的发病期为每年的3月下旬至11月下旬,以菌丝体在病组织周围越冬,具有明显的潜伏侵染特性[3]。干腐病菌全年存在于树体内,而明显症状需要等到4-5月才能表现出来,如果等出现症状时才开始进行防治,有可能达不到预期效果。实现山核桃干腐病的早期、准确、快捷地定量测定对山核桃干腐病病害的预测预报和防治有极其重要的意义。利用实时荧光定量聚合酶链式反应(real-time flurescent quantitive PCR)技术可以对DNA目的片段进行实时检测,在PCR体系中添加特定的荧光结合物质或者荧光探针,受体荧光染料发射出的荧光信号强度与DNA产量成正比,通过检测荧光信号的变化来监测PCR反应过程,从而达到定量目的[4-5]。通过实时荧光定量PCR技术可在病害的潜伏期准确确定病害的发生程度,以便做好防治措施,从而减轻危害,提高经济效益。潘娟娟等[6]运用实时荧光定量PCR对小麦条锈菌Puccinia striiformis进行了检测,其检测效果令人满意。本研究拟建立的实时荧光定量PCR检测方法能够用于监测山核桃树体内潜伏侵染期内的含菌量,对于做好早期预防,指导病害的适时防治具有重要意义。
1 材料与方法
1.1供试菌株
所用菌系为山核桃干腐病菌,均于2014年8月4日采集自浙江省临安市湍口镇的山核桃林,并经过多次培养、纯化得到。
1.2山核桃干腐病病菌DNA与无病山核桃植株及所有微生物总基因组DNA的提取
使用生工生物工程(上海)有限公司生产的真菌基因组DNA快速抽提试剂盒提取干腐病菌DNA(提取方法参照试剂盒使用说明书),并使用该公司生产的Ezup柱式基因组DNA抽提试剂盒(植物)提取无病山核桃植株及所有微生物总基因组DNA(提取方法参照试剂盒使用说明书)。其中提取无病山核桃植株及所有微生物总基因组DNA时,所有样品均随机取于5~10年生的山核桃植株主干未发病处树皮,具体见1.7。所有DNA样品置于-20℃保存备用。
1.3山核桃干腐病病菌特异性引物的设计
参考葡萄座腔菌EF1α(GenBank:HM176506.1,elongation factor 1 alpha(EF))基因的序列,使用Beacon Designer7软件各设计山核桃干腐病病菌特异性引物:EFRT-F1(5′>TTTGCCTTATCACTCTCT<3′)和EFRT-R1(5′>TACTTGAAGGAACCCTTG<3′),引物由杭州擎科梓熙生物技术有限公司合成。设计的引物能够精确区分葡萄座腔菌与引起山核桃病害的其他病原物。
1.4引物特异性检测
应用特异性引物对山核桃干腐病菌DNA和无病山核桃植株及所有微生物总基因组DNA进行普通PCR扩增和实时荧光定量PCR扩增,测定引物特异性。
普通PCR反应体系为:25.0 μL,其中2×PCR缓冲液12.5 μL(生工生物),上述合成的引物各1.0 μL,灭菌蒸馏水10.0 μL,模板0.5 μL。反应程序为:95℃5 min;94℃30 s,56℃30 s,72℃30 s;30个循环;72℃延伸5 min。PCR产物经质量浓度为1.5%琼脂糖凝胶电泳(140 V,14 min),经过嗅化乙锭(EB)染色后,用天能2200凝胶成像系统成像。
实时荧光定量PCR反应体系为:25.0 μL,其中,SYBR 12.5 μL(TAKARA,Premix EX TaqTMⅡ),引物各1.0 μL,模板为2.0 μL,灭菌蒸馏水8.5 μL。反应程序为:95℃5 min;95℃5 s,56℃30 s,72℃25 s;40个循环;65℃延伸5 s。通过溶解曲线判断是否有唯一的产物峰。
1.5引物灵敏度检测
将制备的山核桃干腐病菌DNA稀释为100 000.0,10 000.0,1 000.0,100.0,10.0,1.0,0.1 μg·L-1等不同的质量浓度梯度,用该引物进行普通PCR扩增与实时荧光定量PCR扩增,测定该引物的灵敏度(反应体系和条件同1.4所述)。
1.6特异性引物的实时荧光定量PCR标准曲线的绘制
将山核桃干腐病菌DNA用EASY Dilution(TAKARA)定量后梯度稀释(同1.5所述),用特异性引物使用CFX96TMreal-time PCR Detection System(Bio-Rad)进行实时荧光定量PCR扩增,重复3次,用Excel软件生成标准曲线。
1.7实时荧光定量PCR定量检测山核桃样品中的病原菌含量
于2014年10月6日正浙江省临安市湍口镇采集山核桃样品6份,其中发病部位样品3份,无病健康样品3份,提取总基因组DNA(总量为100.0 μL),进行实时荧光定量PCR检测其中山核桃干腐病病菌的含量。DNA提取方法参照Ezup柱式基因组DNA抽提试剂盒(植物)说明书。
2 结果与分析
2.1山核桃干腐病病菌特异性引物的测定
应用引物EFRT-F1/R1分别以山核桃干腐病病菌DNA和无病山核桃植株及所有病原物总DNA为模板进行PCR扩增,结果表明:应用该引物能够扩增出以山核桃干腐病病菌DNA为模板的目标条带,而以山核桃健康无病植株及所有微生物总基因组DNA为模板的均未扩增出目标条带(图1)。实时荧光定量PCR扩增结果同样表明:该对引物对山核桃干腐病菌只有唯一的产物吸收峰(图2)。因此该引物相对于山核桃干腐病病菌具有特异性,可用于后续试验。
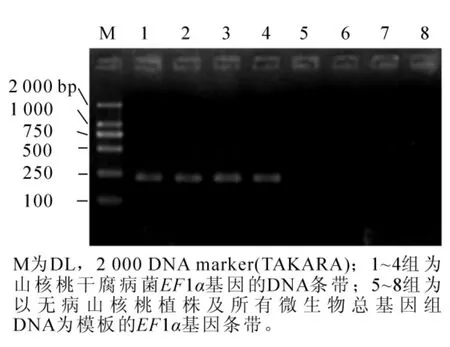
图1 引物EFRT-F1/R1对山核桃干腐病病菌的特异性电泳图谱Figure 1 Specificity of the selected primer pair EFRT-F1/R1 to Botryosphaeria dothidea
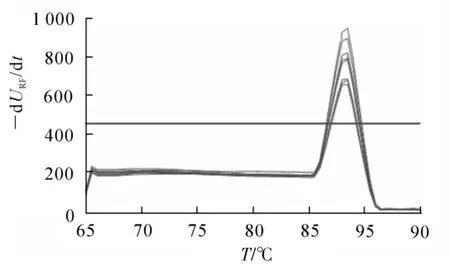
图2 应用引物EFRT-F1/R1对山核桃干腐病病菌实时荧光定量PCR扩增的溶解曲线Figure 2 Melting curves of real-time PCR amplification of Botryosphaeria dothidea based on primer pair EFRT-F1/R1
2.2引物在常规PCR及实时荧光定量PCR下的灵敏度测定
利用梯度稀释的山核桃干腐病病菌DNA对特异性引物分别做普通PCR与实时荧光定量PCR的灵敏度测定。普通PCR电泳结果显示到第2条,所对应的模板浓度为10 000.0 μg·L-1,表明在普通PCR条件下,应用该引物最低可以检测到10 000.0 μg·L-1的病原菌DNA量(图3)。在实时荧光定量PCR条件下,应用该引物对不同浓度梯度的模板DNA进行检测,重复3次,发现第1~4条的cq值呈线性关系,所对应的模板DNA质量浓度分别为100 000.0,10 000.0,1 000.0,100.0 μg·L-1,自第5条起无线性关系,因此可确定在普通实时荧光定量PCR条件下,应用该引物最低可以检测到100.0 μg·L-1的病原菌DNA(图4)。运用实时荧光定量PCR的检测灵敏度是普通PCR的100倍。
2.3实时荧光定量PCR定量检测山核桃样品中的菌量
2.3.1标准曲线将山核桃干腐病病菌DNA用EASY Dilution梯度稀释后(同1.5所述),用引物EFRTF1/R1扩增建立标准曲线(图5)。线性方程为y=-3.262 0x+27.106(R2=0.997 0),其中y为cq值,x为山核桃干腐病菌DNA质量浓度常用对数(lg)值。
2.3.2山核桃样品中病原菌的实时荧光定量PCR定量测定应用特异性引物EFRT-F1/R1以1.7的样品DNA为模板进行实时荧光定量PCR检测,结果显示:样品1,样品2和样品3的山核桃干腐病病菌含量是可以检测出的,由回归曲线可算得,样品1中病菌质量分数为2 493.5 ng·g-1,样品2中病菌质量分数为587.2 ng·g-1,样品1中病菌质量分数为744.1 ng·g-1。
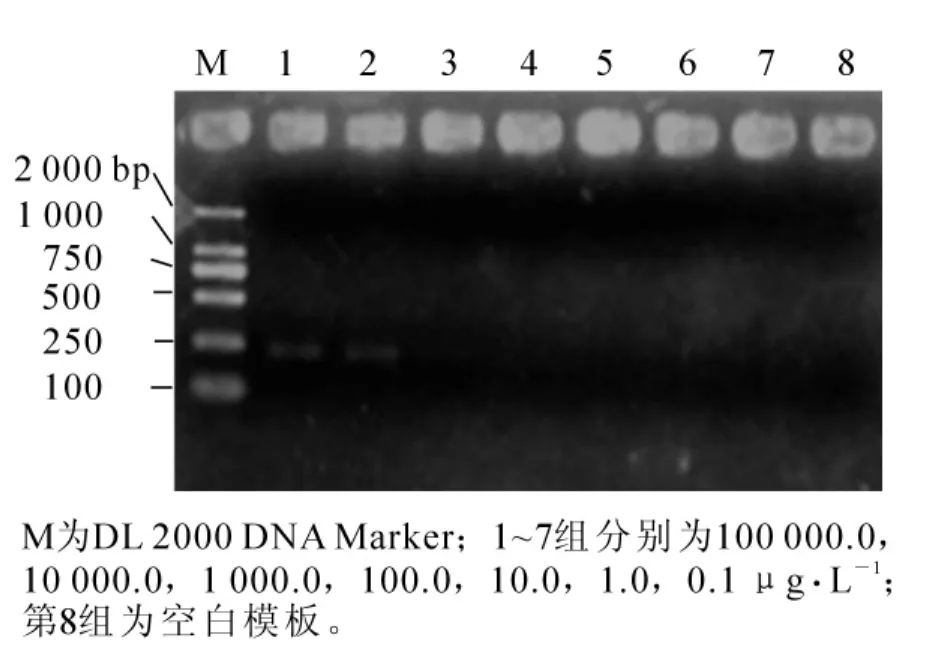
图3 运用普通PCR探测引物EFRT-F1/R1的灵敏度Figure 3 Sensitivity of PCR detection using primer pairEFRT-F1/R1

图4 运用实时荧光定量PCR探测引物EFRT-F1/R1的灵敏度Figure 4 Sensitivity of real-time PCR detection using primer pair EFRT-F1/R1
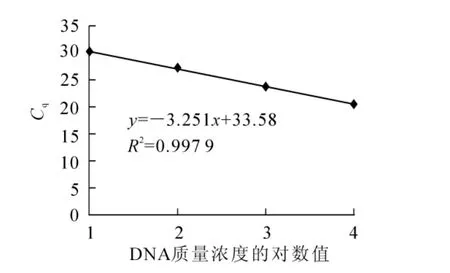
图5 质量浓度从100.0~100 000.0 μg·L-1的10倍稀释液的回归曲线Figure 5 Standard curve developed by using 10-fold dilutionsof DNA of 100.0-100 000.0 μg·L-1
3 讨论

图6 运用实时荧光定量PCR检测样品的cq值Figure 6 Detection of sample cqby using real-time PCR
INDERBITZIN等[7]对常见的葡萄座腔菌科7种病原真菌进行了研究,比较了ITS,EF1α,GPD,His,Hsp,Tublin,Combened基因片段的可变序列。结果表明:它们的EF1α基因片段的可变序列的比例相对较高。EF1α是葡萄座腔菌属真菌常见的保守基因,由于该基因片段在同属真菌中可变序列比例相对较高,因此同属不同种的真菌的EF1α基因片段差异较大,根据EF1α基因设计的引物更具特异性。本研究以此为参照,根据EF1α基因设计出特异性引物。山核桃主要病害有干腐病、枝枯病、膏药病等,本研究所设计的引物可以扩增出山核桃干腐病病菌的目的基因片段,以区别其他病原物。
目前,实时荧光定量PCR技术已经非常成熟,能够有效地应用于病原菌等微生物的检测,并且灵敏度非常高[8]。应用实时荧光定量PCR对小麦条锈病病菌DNA进行定量检测,其灵敏度约为100.0 ng· L-1,比普通PCR高出100倍[6]。本研究对比了普通PCR和实时荧光定量PCR的扩增结果可得后者的扩增灵敏度比普通PCR高100倍。普通PCR在电泳过程中受外界干扰较大,进而导致低的扩增产物在凝胶成像仪中无法成像,灵敏度相对较低。
山核桃干腐病是山核桃生产中重要的病害,具有明显的潜伏侵染特性。因此,山核桃干腐病的早期监测和病菌的定量分析具有重要意义。本研究运用上述建立的方法对多个山核桃样品进行检测,再通过标准曲线的线性回归方程可以准确计算出这些样品中的病原菌含量,并且,制定出了山核桃干腐病的经济阈值,对农业生产和化学农药合理使用的意义也十分重大。
4 参考文献
[1]郑宏兵,束庆龙,丁之恩.山核桃溃疡病与营养元素的关系[J].经济林研究,2007,25(3):19 - 23.ZHENG Hongbing, SHU Qinglong, DING Zhien.Relationship between nutrient elements in bark and canker of Carya cathayensis[J].Nonwood For Res, 2007, 25(3): 19 - 23.
[2]ZHANG Chuanqing, XU Bingchao.First report of canker on Chinese hickory(Carya cathayensis)caused by Botryosphaeria dothidea in China[J].Plant Dis, 2011, 95(10): 1319.
[3]杨淑贞,丁立忠,楼君芳,等.山核桃干腐病发生发展规律及防治技术[J].浙江林学院学报,2009,26(2):228 - 232.YANG Shuzhen,DING Lizhong,LOU Junfang,et al.Qccurrence regularity of Carya cathayensis canker disease and its control[J].J Zhejiang For Coll, 2009, 26(2): 228 - 232.
[4]郑亚明.小麦叶片中潜伏侵染白粉菌的Real-time PCR检测技术的研究[D].北京:中国农业科学研究院,2010.ZHENG Yaming.Detection of Latent Infection of Wheat Leaves Caused by Blumeria graminis f.sp.tritici Using Realtime PCR[D].Beijing: Chinese Academy of Agricultural Sciences, 2010.
[5]王华,刘斌.PCR技术在食品微生物检测中的应用[J].生物技术通报,2010(2):63 - 67.WANG Hua, LIU Bin.Latest application of PCR technology in food microorganism inspection[J].Biotechnol Bull, 2010(2): 63 - 67.
[6]潘娟娟,骆勇,黄冲,等.应用real-time PCR定量检测小麦条锈菌潜伏侵染量方法的建立[J].植物病理学报,2010,40(5):504 - 510.PAN Juanjuan, LUO Yong, HUANG Chong, et al.Quantification of latent infections of wheat stripe rust by using realtime PCR[J].Acta Phytopathol Sin, 2010, 40(5): 504 - 510.
[7]INDERBITZIN P,BOSTOCK R M,TROUILLAS F P, et al.A six locus phylogeny reveals high species diversity in Botryosphaeriaceae from California Almond[J].Mycologia, 2010, 102(6): 1350 - 1368.
[8]闫佳会,骆勇,潘娟娟,等.应用real-time PCR定量检测田间小麦条锈菌潜伏侵染的研究[J].植物病理学报,2011,41(6):618 - 625.YAN Jiahui, LUO Yong, PAN Juanjuan, et al.Quantification of latent infection of wheat stripe rust in the fields using real-time PCR[J].Acta Phytopathol Sin, 2011, 41(6): 618 - 625.
Quantifying Botryosphaeria dothidea infection causing canker disease on Carya cathayensis using real-time PCR
ZHU Zhixiang, SHI Haojie, LEI Feibin, ZHANG Chuanqing
(School of Agricultural and Food Science, Zhejiang A & F University, Lin’an 311300, Zhejiang, China)
Abstract:Canker disease caused by Botryosphaeria dothidea is the most important disease that threaten the production of Chinese hickory and has the significant characteristics of“latent infection”.Therefore, the development of a quantitative detection technique of B.dothidea in hickory plants is the prerequisite for its forecasting and scientific management.In this study, specific primers were respectively designed based on the conserved regions of EF1α gene of B.dothiaea.Results of both real-time PCR and common PCR showed that the specificity and sensitivity of EFRT-F1/R1 was good primer pair.A band of 230 bp could be stably amplified by
the primers EFRT-F1/R1.Further study displayed that this real-time PCR technique is more sensitive(more than 100 fold)than the common one.Our molecular detection technique will provide scientific basis for fore
cast, and management of hickory canker disease.[Ch, 6 fig.8 ref.]
Key words:forest protection; comker disease; real-time PCR; specific primers; genome DNA
作者简介:朱致翔,从事植物病害治理研究。E-mail:zhuzhixiang@189.cn。通信作者:张传清,教授,从事杀菌剂与植物病害治理研究。E-mail:cqzhang@zafu.edu.cn
基金项目:国家林业局公益性行业科研专项(201304403)
收稿日期:2015-04-03;修回日期:2015-05-31
doi:10.11833/j.issn.2095-0756.2016.02.024
中图分类号:S718.83
文献标志码:A
文章编号:2095-0756(2016)02-0364-05
