生长抑制因子1在肝细胞肝癌中的表达及临床意义
2017-05-27张磊陈云志陈永平
张磊++陈云志++陈永平

[摘要] 目的 探討生长抑制因子ING1(inhibitor of growth1)在肝细胞肝癌(human hepatocellular carcinoma,HCC)中的表达情况及临床意义。 方法 采用定量RT-PCR方法,检测86例HCC组织及相应癌旁组织中ING1 mRNA的表达量,分别计算肿瘤组织和癌旁组织的△CT值,来计算△CT癌旁/△CT肿瘤的比值,以2为阈值,分成高表达组和低表达组,分析两组患者的临床资料及生存时间。 结果 ING1 mRNA在HCC组织中的表达水平明显低于癌旁肝组织(P<0.05)。高表达组48例,低表达组38例。两组患者的组织分化程度、淋巴结转移、肿瘤TNM分期以及门脉浸润等临床病理因素,差异有统计学意义(P<0.05);年龄、性别、HBV感染、AFP、肿瘤大小及肝硬化等因素,差异无统计学意义(P>0.05)。高表达组和低表达组患者的中位生存时间分别为34.5个月和19.5个月,高表达组明显长于低表达组(P<0.05)。 结论 ING1作为抑癌基因可能参与了HCC的发生发展过程,可作为判断HCC预后的重要分子标志。
[关键词] 抑癌基因;肝细胞肝癌;生长抑制因子1;实时荧光定量PCR
[中图分类号] R735.7 [文献标识码] A [文章编号] 1673-9701(2016)35-0001-04
Expression of inhibitor of growth 1 in human hepatocellular carcinoma and its clinical significance
ZHANG Lei1 CHEN Yunzhi2 CHEN Yongping1
1.Department of Infectious Diseases, the First Hospital Affiliated to Wenzhou Medical University, Wenzhou 325000,China;2.Department of Hepatobiliary Surgery, the First Hospital Affiliated to Wenzhou Medical University, Wenzhou 325000, China
[Abstract] Objective To discuss the expression and clinical significance of inhibitor of growth 1 (ING1) gene in human hepatocellular carcinoma(HCC). Methods There were 86 pairs of samples comprised of HCCs and their paracancerous tissues. The mRNA levels of ING1 in these samples were detected by quantitative RT-PCR. The △CT values and the ratio of △CT values within each pair were calculated respectively. The different pairs were grouped based on 2 as the cut-off value of the ratio. Correlations between clinicopathologic variables, over all survival and ING1 mRNA expression were analyzed. Results ING1 mRNA was significantly lower in HCC than that in the paired paracancerous tissues(P<0.05). 48 patients were classified as high expression group and the other 38 patients were categorized as low expression group. There were significant differences between the two groups in term of histological grade, lymphnode metastasis, TNM stage and portal vein invasion(P<0.05). The current study failed to find significant differences between the two groups in the following clinical characteristics: age, gender, hepatitis B virus(HBV) infection, α-fetoprotein (AFP) level,tumor size and liver cirrhosis (P>0.05). Survival time of high expression group was significantly longer than that of low expression group(median survival, 34.5 months vs 19.5 months,P<0.05). Conclusion ING1 as a tumor suppressor may contribute to the occurrence and development of HCC. Its expression level can be used to predict prognosis of HCC.
[Key words] Tumor suppressor gene; Human hepatocellular carcinoma; Inhibitor of growth 1; Quantitative RT-PCR
近年来发现生长抑制因子(inhibitor of growth,ING)家族能诱导细胞生长周期停滞、促进细胞衰老和凋亡、调控DNA复制及损伤应答、抑制肿瘤的发生与发展[1]。已有研究证实,此类基因在肿瘤组织中的表达大多呈下调状态[2]。生长抑制基因1(inhibitor of growth 1 gene,ING1)作为ING家族的第1个成员于1996年被 Garkavtsev I等[3]在乳腺上皮细胞中用改良的cDNA消减杂交方法成功克隆出来,之后被相关领域的学者广泛研究。
肝细胞肝癌(human hepatocellular carcinoma)是全世界范围内常见且预后差的恶性肿瘤之一。肝部分切除、肝移植是目前治愈肝癌的有效方法,但多数患者确诊时已处于进展期,失去手术机会。根据最新发布的全球癌症统计数据显示,2012年全球肝癌新发病例数超过78万人,而死亡病例数则接近75万人[4]。导致正常肝细胞发生恶性转化的分子机制至今尚未完全阐明。在与肝癌相关的抑癌基因研究中,除了被人们广泛关注的p53、Rb和APC等抑癌基因之外,候选抑癌基因生长抑制因子(ING)家族成员在肿瘤发生发展中的作用也越来越受到人们的关注。在ING家族与肿瘤发生发展关系的研究中,ING1是被研究最为广泛的成员。但是关于ING1基因与肝癌的相关研究报道并不多见,其中涉及到其表达与肝癌预后关系的研究更是少见。本研究采用qRT-PCR的方法,检测肝癌原发灶及其癌旁组织标本中抑癌基因ING1 mRNA的表达,探讨其与临床病理资料的相关性及对肝癌患者预后的影响,以期为临床肝癌的诊断与治疗提供新的分子靶点。
1 资料与方法
1.1一般资料
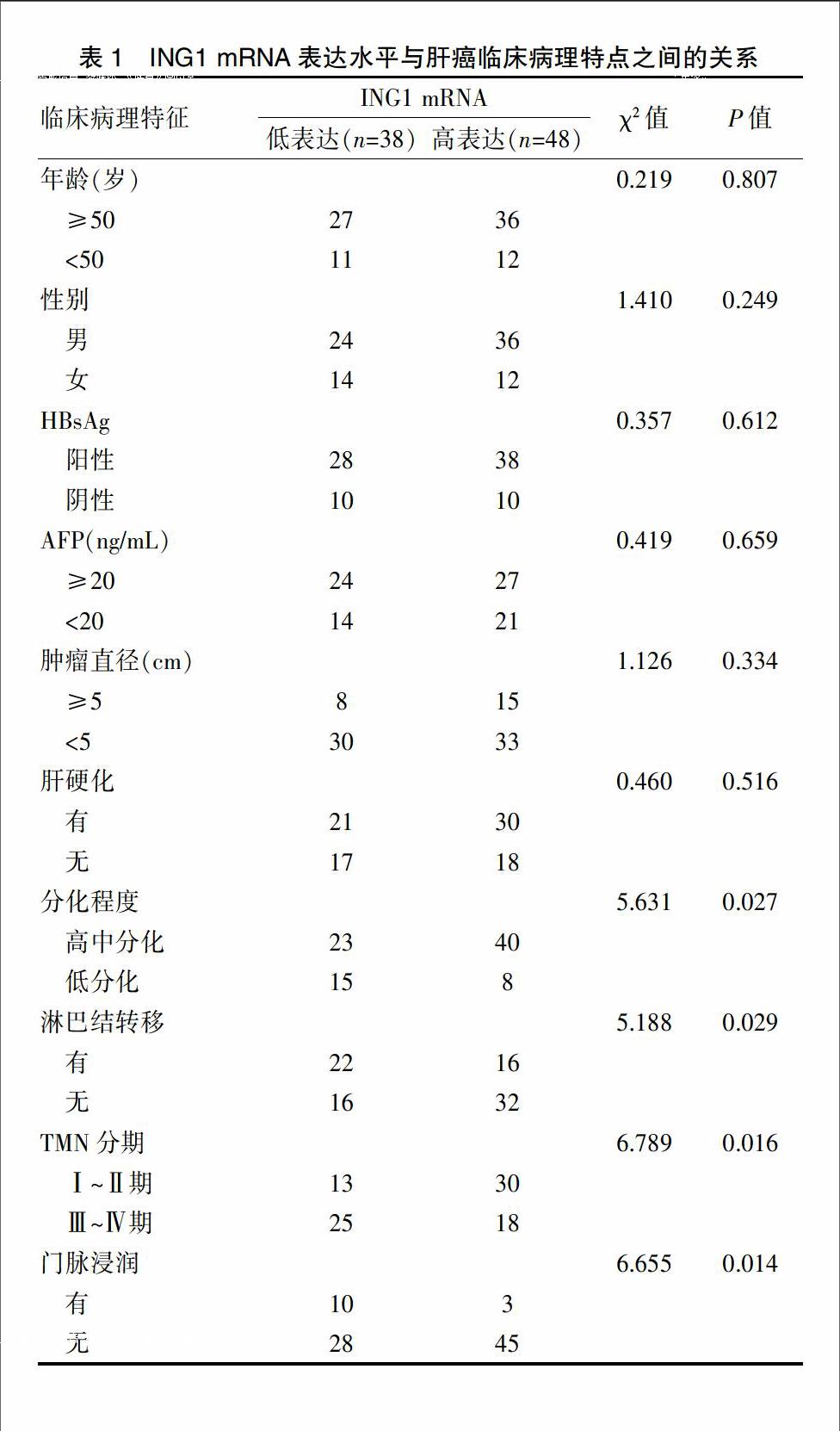
本研究经温州医科大学附属第一医院伦理委员会批准实施,所有研究对象均签署知情同意书。入组标准:首次就诊诊断为原发性肝癌并未接受任何治疗;无腹腔积液及肝性脑病;肝功能分级为Child-Pugh A或B级;术后病理证实为肝细胞肝癌。临床分期采用第七版TNM分期系统,病理分级则采用Edmondson-Steiner分级法。排除标准:转移性肝癌患者;术前肝功能Child-Pugh C级或术前接受TACE、射频等治疗;术后病理提示胆管细胞癌、混合细胞癌等非肝细胞肝癌。收集2006~2011年在温州医科大学附属第一医院接受手术治疗的资料完整的肝癌病例86例,其中男60例,女26例,年龄32~76岁,平均(54.4±10.6)岁,50岁及以上63例,50岁以下23例。留取术中切除的肝癌组织及癌旁肝组织标本。采用定量RT-PCR方法,检测HCC组织及相应癌旁组织中ING1 mRNA的表达量,分别计算肿瘤组织和癌旁组织的△CT值,计算△CT癌旁/△CT肿瘤的比值,以2为閾值,△CT癌旁/△CT肿瘤的比值≤2为高表达组,△CT癌旁/△CT肿瘤的比值>2为低表达组。入组患者的详细资料见表1。
1.2 qRT-PCR的主要试剂和方法
1.2.1 提取RNA 取肝癌组织和癌旁组织各100 mg,方法参照TRIzol reagent(Invitrogen,Carlsbad,CA)提供的操作说明提取样本总RNA,用核酸蛋白检测仪在260 nm和280 nm检测吸光度(A260/280)值,计算总RNA的含量及纯度。
1.2.2 逆转录 从总的RNA中提取2 μg进行逆转录以合成第一链cDNA,逆转录试剂盒采用ReverTra AceR qPCR RT Kit(TOYOBO, Japan)。
1.2.3 实时荧光定量PCR 操作流程按照ABI 7300实时定量PCR系统以及荧光定量试剂盒THUNDERBIRDRSYBRRqPCR Master Mix Kit(TOYOBO,Japan)所提供的说明进行。
1.2.4 目标基因ING1及内参基因GAPDH的引物序列 见表2。
1.2.5 扩增条件 扩增条件为95℃ 2 min,95℃ 15 s,60℃ 30 s,68℃ 30 s,共40个循环。结果分析软件采用ABI 7300 System SDS Versions 1.4,通过△Ct法分析real-time PCR结果。
1.3 统计学处理
所获数据应用SPSS 19.0软件对数据进行统计分析。正态分布计量资料以均数±标准差(x±s)表示,采用Kolmogorov-Smirnov检验来判断其是否符合正态分布,如果符合正态分布,则组间比较根据数据类型分别采用独立样本t检验;若不符合正态分布,则以中位数表示,采用非参数Mann-Whitney检验。计数资料以频数及率表示,组间比较根据数据类型采用χ2检验或Fisher精确概率检验。非参数秩和检验分析肝癌与癌旁肝组织ING1 mRNA表达差异。总生存时间(OS)应用生存曲线以图表的形式展现,并且应用Log-rank检验检测组间生存差异。显著性检验水平为P<0.05。
2 结果
2.1 ING1 mRNA在肝癌组织及癌旁组织的表达情况
qRT-PCR的结果显示,所有肿瘤组织和相应癌旁组织均有ING1 mRNA的表达,且癌组织中的表达水平明显低于相应的癌旁组织。癌组织为2.1115(0.6637~5.7722),癌旁组织为10.6089(3.1409~39.6602),差异有统计学意义(Z=-6.238,P<0.001),见封三图1。
2.2 ING1 mRNA表达与肝癌临床病理资料的关联分析
高表达组和低表达组在组织分化程度、淋巴结转移、肿瘤TNM分期以及门脉浸润等临床病理因素,差异有统计学意义(P<0.05);而在年龄、性别、HBV感染、AFP、肿瘤大小及肝硬化等因素方面,差异无统计学意义(P>0.05)(表1)。
2.3 ING1基因表达与HCC预后的关系
高表达组和低表达组患者的中位生存时间分别为34.5个月和19.5个月。两组差异有统计学意义(P=0.016,OR=2.199,95%置信区间:1.158~4.175,封三图2)。
3 讨论
ING1是新近发现的一种肿瘤抑制基因,定位于13号染色体的q33至q34区域,在人类中一共存在5种ING基因(ING1、ING2、ING3、ING4、ING5),ING1是ING家族最先发现的基因,它具有4种不同的剪接体形式,其中研究较多的为p33[5,6]。在对包括HCC在内的各种人类恶性肿瘤的多个研究中发现,ING1在恶性肿瘤组织及细胞系中的表达降低[7-9]。本研究结果提示,所有肿瘤组织和相应的癌旁组织都有ING1的表达,且肿瘤组织中ING1表达水平明显低于相应癌旁组织,这表明ING1基因低表达可能与原发性肝癌的发生、发展有密切关系。这一结果与Ohgi T等[10]关于ING1在HCC中表达缺失的结果相一致。
肝癌发生发展是一个涉及基因表达、表观遗传学变异的复杂过程,P53基因表达异常是肝癌发生中最常见的分子事件[11]。Garkavtsev I等[12]研究发现,ING1基因所编码的p33蛋白为p53结合蛋白,p53抑制细胞生长的作用需要有ING1参与。转染实验表明,p53的转录激活作用依赖于ING1,没有ING1的参与,p53的作用明显减弱。ING1被认为是一种与p53共同参与细胞信号通路,它的功能发挥部分依赖于p53的缴活,从而对细胞周期起负调控作用,故也称ING1为p53的分子伴侣。ING1与p300乙酰化酶的相互作用,可增加p53的乙酰化水平,从而促进与细胞周期停滞、凋亡和衰老等有关的基因如p21、bax等的翻译增加。而且,ING1可通过与去乙酰化酶SIRT1的作用阻止p53的去乙酰化,从而保持p53的乙酰化水平[12-14]。然而,Cheung KJ等[15]通过基因敲除小鼠實验发现,p33 ING1抑癌作用的发挥并不依赖于p53,提示有其他机制参与其肿瘤抑制作用。
抑癌基因ING1在各种恶性肿瘤中的表达水平与相关临床病理资料之间的关系已被广泛研究。ING蛋白在细胞凋亡、DNA修复、细胞衰老及癌细胞转移、血管再生等方面发挥重要作用[16]。当其作为二型肿瘤抑制基因时,控制了细胞增殖、凋亡和衰老,同时也可作为一型肿瘤抑制基因参与DNA的复制与修复[17]。目前认为,ING在癌细胞中的表达缺失或失调主要发生在RNA水平,但其具体机制尚不明确[18]。microRNA的作用可能是其机制之一,在一项胃癌的研究中发现,miR-622可以作用于ING1基因的 3‘UTR(即非翻译区)而使ING1的表达减少[19],而前者被证明在胰腺癌、食道癌中存在过分表达[20,21]。我国多位学者在胃癌、大肠癌方面,均指出淋巴结转移或远处转移者ING1 mRNA的表达水平显著下降[22,23]。但关于肝癌的此方面研究目前并不多见。本研究显示,ING1 mRNA低表达与肝癌组织分化程度、淋巴结转移、肿瘤TNM分期以及门脉浸润相关,从而提示ING1 mRNA的低表达可能参与了肝癌的发生发展过程。而性别、HBsAg、肿瘤大小、AFP、肝硬化情况等变量的差异与ING1的mRNA表达无关。同时,本研究亦显示ING1 mRNA高表达肝癌患者较低表达患者远期生存时间长,提示ING1 mRNA可能可作为预测肝癌预后的生物学指标。ING1蛋白的功能失调会导致肿瘤的发生,但是ING1蛋白表达下调与癌症发生之间的因果联系及其深层次的机制还不很清楚。在今后的研究中我们将进一步研究ING1低表达与肝癌发生发展的相关机制。
[参考文献]
[1] Jafarnejad SM,Li G. Regulation of p53 by ING family members in suppression of tumor initiation and progression[J]. Cancer Metastasis Rev,2012,31(1-2):55-73.
[2] Lu M,Chen F,Wang Q,et al. Downregulation of inhibitor of growth 3 is correlated with tumorigenesis and progression of hepatocellular carcinoma[J]. Oncol Lett,2012,4(1):47-52.
[3] Garkavtsev I,Kazarow A,Gudkov A,et al. Suppression of the novel growth inhibitor p33ING1 promotes neoplastic transformation[J]. Nat Genet,1996,14(4):415-420.
[4] Torre LA,Bray F,Siegel RL,et al. Global cancer statistics,2012[J]. CA Cancer J Clin,2015,65(2):87-108.
[5] Gong W,Suzuki K,Russell M,et al. Function of the ING family of PHD proteins in cancer[J]. Int J Biochem Cell Biol,2005,37(5):1054-1065.
[6] Satpathy S,Nabbi A,Riabowol K. RegulatING chromatin regulators:Post-translational modification of the ING family of epigenetic regulators[J]. Biochem J,2013,450(3):433-442.
[7] Luo ZG,Tang H,Li B,et al. Genetic alterations of tumor suppressor ING1 in human non-small cell lung cancer[J]. Oncol Rep,2011.,25(4):1073-1081.
[8] Borkosky SS,Gunduz M,Beder L,et al. Allelic loss of the ING gene family loci is a frequent event in ameloblastoma[J].Oncol Res,2010,18(10):509-518.
[9] Tallen G,Farhanqi S,Tamannai M,et al. The inhibitor of growth 1(ING1)proteins suppress angiogenesis and differentially regulate angiopoietin expression in glioblastoma cells[J]. Oncol Res, 2009,18(2-3):95-105.
[10] Ohgi T,Masaki T,Nakai S,et al. Expression of p33(ING1)in hepatocellular carcinoma:Relationships to tumour differentiation and cyclin E kinase activity[J]. Scand J Gastroenterol,2002,37(12):1440-1448.
[11] Aravalli RN,Steer CJ,Cressman EN. Molecular mechanisms of hepatocellular carcinoma[J]. Hepatology,2008, 48(6): 2047-2063.
[12] Garkavtsev I,Griqorian IA,Ossovskaya VS,et al. The candidate tumour suppressor p33ING1 cooperates with p53 in cell growth control[J]. Nature,1998,391(6664):295-298.
[13] Binda O,Nassif C,Branton PE. SIRT1 negatively regulates HDAC1-dependent transcriptional repression by the RBP1 family of proteins[J]. Oncogene,2008,27(24):3384-3392.
[14] Kataoka H,Bonnefin P,Vieyra D,et al. ING1 represses transcription by direct DNA binding and through effects on p53[J]. Cancer Res,2003,63(18):5785-5792.
[15] Cheung KJ, Bush JA,Jia W,et al. Expression of the novel tumour suppressor p33(ING1) is independent of p53[J]. Br J Cancer, 2000,83(11):1468-1472.
[16] Satpathy S,Guerillon C,Kim TS,et al. SUMOylation of the ING1b tumor suppressor regulates gene transcription[J].Carcinogenesis,2014,35(10):2214-2223.
[17] Guerillon C,Bigot N,Pedeux R. The ING tumor suppressor genes:status in human tumors[J]. Cancer Lett,2014, 345(1):1-16.
[18] Ythier D,Larrieu D,Brambilla,et al. The new tumor suppressor genes ING:genomic structure and status in cancer[J]. Int J Cancer,2008,123(7):1483-1490.
[19] Guo XB,Jing CQ,Li LP,et al. Down-regulation of miR-622 in gastric cancer promotes cellular invasion and tumor metastasis by targeting ING1 gene[J]. World J Gastroenterol,2011,17(14): 1895-1902.
[20] Schultz NA,Werner J,Willenbrock H,et al. MicroRNA expression profiles associated with pancreatic adenocarcinoma and ampullary adenocarcinoma[J]. Mod Pathol,2012,25(12):1609-1622.
[21] Odenthal M,Bollschweiler E,Grimminger PP,et al. MicroRNA profiling in locally advanced esophageal cancer indicates a high potential of miR-192 in prediction of multimodality therapy response[J]. Int J Cancer,2013, 133(10):2454-2463.
[22] 何向民,婁毅,宋清斌,等. 胃癌组织ING1抑癌基因表达及其生物学意义探讨[J]. 中华肿瘤防治杂志,2012, 19(15): 1153-1155.
[23] 薛伟男,张干,杨艳梅,等. 抑癌基因ING1在大肠癌中的表达及预后意义[J]. 实用肿瘤学杂志,2014,28(5):385-390.
(收稿日期:2016-09-04)
