鸡卵清蛋白启动子慢病毒载体构建及荧光定量PCR检测重组慢病毒滴度
2017-03-21吴志鹏刘健赵俊生
吴志鹏+刘健+赵俊生
摘要:构建鸡卵清蛋白启动子(OV 2.8kb)与含有eGFP基因的慢病毒表达载体,采用实时荧光定量PCR(QPCR)检测重组慢病毒滴度。将鸡卵清蛋白启动子基因OV连接到慢病毒载体pLVshRNA-eGFP中替换质粒上CMV promoter 元件,经酶切、测序鉴定获得携带OV与eGFP融合基因的重组慢病毒质粒,用QPCR检测病毒浓度滴定。结果显示,重组慢病毒质粒pLVshRNA-OV-eGFP酶切鉴定结果与目的基因条带吻合,克隆测序结果与NCBI收录的OV基因序列完全一致。在QPCR试验过程中,发现空白组和载体组的溶解曲线和扩增曲线较好,证明基因组抽提和QPCR过程无问题。最终测得病毒滴度约为1.6×107 IU/mL。成功构建了携带OV与eGFP融合基因的慢病毒表达载体,为进一步研究卵清蛋白启动子基因的相关功能提供了优质的稳定转染载体。
关键词:鸡卵清蛋白;慢病毒载体;实时荧光定量PCR;病毒滴度
中图分类号: S852.65 文献标志码: A
文章编号:1002-1302(2016)11-0038-02
近年来,通过利用禽类输卵管制作生物反应器以大规模生产药物已成为研究热点领域[1-2],而实现外源基因在禽类输卵管组织中的特异性表达必须有组织特性型的启动子参与。使用鸡卵清蛋白启动子构建禽输卵管生物反应器是1种很有前途的策略[3-5]。本研究拟构建卵清蛋白OV与绿色荧光蛋白eGFP融合基因的慢病毒载体,为进一步研究禽输卵管生物反应器提供试验基础[6-7]。
1 材料与方法
1.1 材料
1.1.1 细胞、菌株及质粒 大肠杆菌宿主菌DH5α来自浙江大学动物科学院动物遗传育种与繁殖实验室。HEK-293T细胞,慢病毒表达载体质粒pLVshRNA-eGFP。
1.1.2 主要试剂及药品 限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶、割胶回收试剂盒、Marker 1 kb。血液基因组DNA提取试剂盒、DNA快速纯化回收试剂盒、普通质粒提取试剂盒。DNaseⅠ;QPCR mix;BioTek ND5000。鸡卵清蛋白启动子OV和用Primer 5.0软件自行设计,由英潍捷基(上海)生物公司合成。新鲜鸡血20 mL。
1.2 重组慢病毒表达载体的构建与鉴定
1.2.1 鸡卵清蛋白启动子OV基因克隆 用DNA提取试剂盒从新鲜鸡血中提取鸡基因组DNA[8-9]。用Primer 5.0软件设计鸡卵清蛋白启动子OV引物,其中在OV引物上游F加上SpeⅠ酶切位点、下游R加上AgeⅠ酶切位点,OV-F:5′-ACACTAGTGTCCTCAGACTTGGC-3′,OV-R:5′-GCACCGGTTGAACTCTGAGTTGTCTAG-3′;用鸡基因组DNA做模板,设计OV的PCR反应体系,PCR扩增OV目的片段。用SpeⅠ和AgeⅠ双酶切OV基因和pLVshRNA-eGFP载体。酶切过后用1%低熔点琼脂糖凝胶电泳,切胶回收OV目的片段及线性化pLVshRNA-eGFP载体,4 ℃保存备用。
1.2.2 慢病毒克隆载体pLVshRNA-OV-eGFPP构建鉴定
连接OV目的基因和线性化载体pLVshRNA-ERE-eGFP:OV基因 2 μL、载体pLVshRNA-ERE-eGFP片段 1.5 μL、T4 DNA聚合酶 2 μL、10×ligation buffer 2 μL、ddH2O 12.5 μL (总体积20 μL),16 ℃连接过夜。连接后命名为pLVshRNA-OV-eGFP。重组质粒转化感受态大肠杆菌DH5a,随机挑取数个单菌落,分别摇菌过夜,小提重组质粒DNA。进行SpeⅠ和AgeⅠ双酶切鉴定,并将最终连接好的pLVshRNA-OV-eGFPP质粒载体送英潍捷基(上海)生物公司测序鉴定。
1.3 QPCR检测重组慢病毒滴度
1.3.1 病毒感染293T细胞 将状态良好的目的细胞接种到6孔板,待细胞长到50%、约1×106个/mL时加50 μL病毒感染细胞[10]。感染开始后20 h,除去培养上清,换为500 μL含DNaseI (TaKaRa Mirus Bio,终浓度为10 U/mL)的新鲜培养基。在37 ℃消化15 min,以除去残余的质粒DNA。然后换为2 mL正常的培养基,继续培养48 h。用0.5 mL 0.25%胰酶-EDTA溶液消化细胞,在37 ℃放置1 min。在培养基吹洗下,離心收集细胞[11-13]。
1.3.2 细胞DNA的提取 加入400 μL ACL Solution 和 10 μL Proteinase K。振荡混匀1 min,然后置于55 ℃水浴 10~20 min,在此期间可以适当取出混匀,有助于充分裂解。取出样品,待降至室温时轻轻振荡混匀。取预处理好的样品,依次加入 300 μL Ext solution 和 300 μL AB solution,用力摇匀,12 000 r/min 离心5 min。溶液将分层,上层为蓝色的抽提层,下层为透明水相,2层溶液中间可能会有部分沉淀层,DNA在下层水相中。将枪头穿过上层溶液,深入到下层溶液,将下层溶液仔细吸出至 GenClean Column 中,尽量避免吸到上层溶液及中间层的沉淀。8 000 r/min 离心1 min,取下层 GenClean Column倒掉收集管中废液。将 GenClean Column 放回收集管中,加入 500 μL Wash Solution,8 000 r/min室温离心1min。取下 GenClean 柱,弃去收集管中的废液。将柱放回收集管中,12 000 r/min室温离心1 min,以除去残留Wash Solution。将柱放入新的洁净1.5 mL 离心管中,在柱中央加入 50~100 μL ddH2O,室温或55 ℃放置2 min。然后 12 000 r/min室温离心1 min。离心管中的液体即为基因组 DNA[14-15]。
1.3.3 Real-time PCR 分析 Real-time PCR 反应体系:2×Real-time PCR Master Mix 10 μL、F/R(序列详见表1) Primer (10 μmol/L) 0.8 μL、 eachcDNA Template(1 ∶100 dilution)1 μL,ddH2O加至20 μL。
Real-time PCR反应条件:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 20 s,共40个循环。
2 结果与分析
2.1 鸡卵清蛋白启动子OV片段克隆
用鸡基因组DNA做模板,PCR扩增鸡卵清蛋白启动子OV,1%低熔点琼脂糖凝胶电泳鉴定(图1)。测序结果证明片段序列与NCBI收录的OV一致。
2.2 慢病毒克隆载体pLVshRNA-OV-eGFPP构建鉴定及QPCR滴度测定
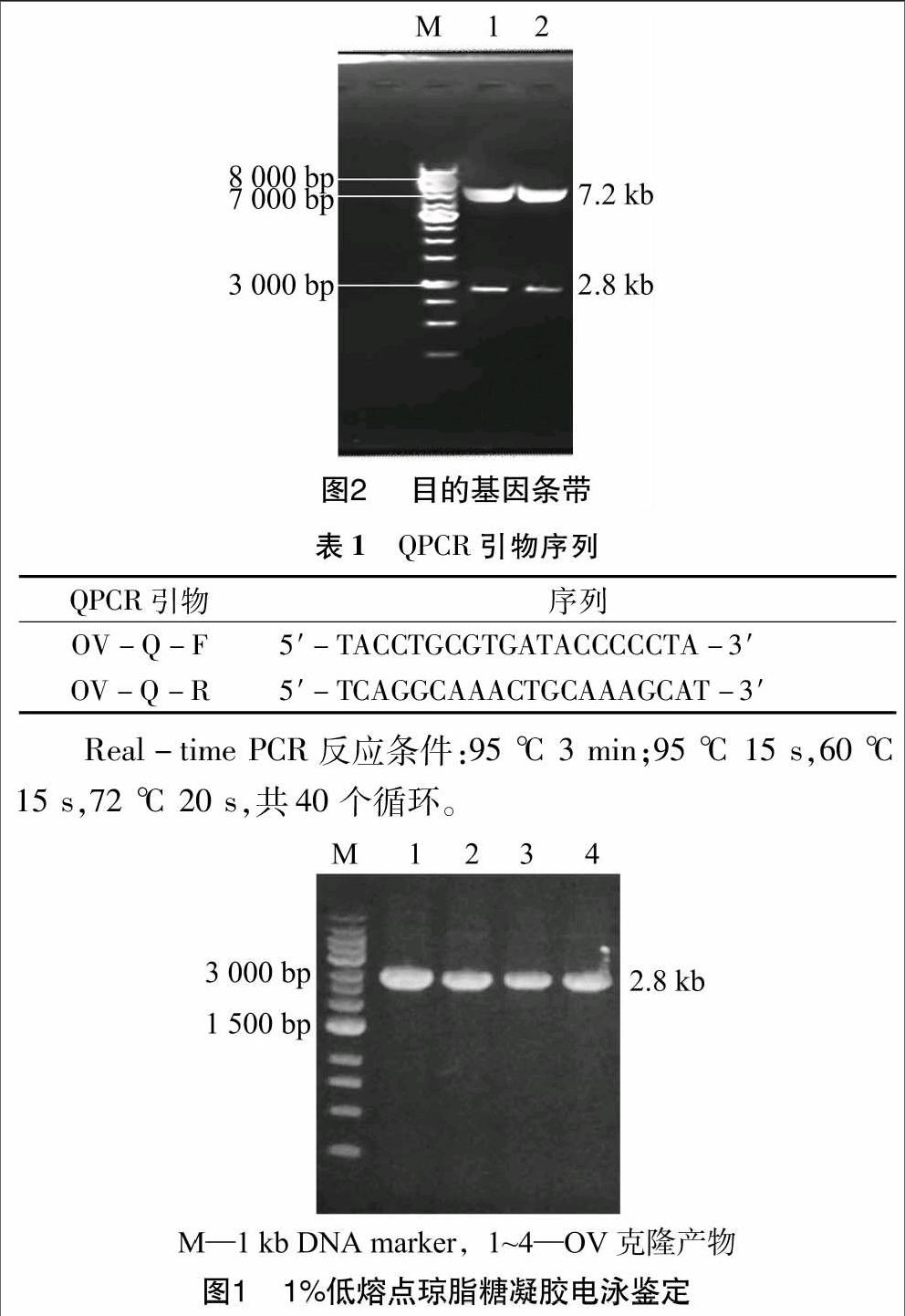
2.2.1 重组慢病毒质粒的鉴定 重组慢病毒质粒pLVshRNA-OV-eGFP 大小约为10 kb,通过限制性内切酶SpeI和AgeI双酶切后被切成2个片段:大片段约为7.2 kb,小片段约为2.8 kb。由图2可知,目的条带大小基本与预期一致。将阳性重组载体测序,证明外源基因片段成功插入慢病毒载体。
2.2.2 QPCR鉴定重组慢病毒滴度 QPCR分析中从扩增曲线和溶解曲线来看,blank组和vector组的OV几乎没有扩增,而过表达组的OV基因有显著扩增,证明基因组抽提和QPCR过程无问题。在试验中,细胞数为2×106个/皿,加病毒 50 μL/皿。根据慢病毒载体上自带的WPRE基因和对照组HGB基因的溶解曲线和扩增曲线较好,通过计算软件测得慢病毒载体滴度约为1.6×107 IU/mL。
3 讨论
慢病毒载体是近几年发展起来的基因工程载体,其最大的特点是能够在体内外转染分裂和非分裂的细胞,是1种具有自我失活功能、无免疫反应的高效基因传递工具,具有容纳外源目的基因片段大、宿主范围广、重组机会低、可将所携带的目的基因整合到宿主染色体中并穩定长期表达[16]、随亲本的繁殖将外源基因传递给子代发挥作用等优点。本试验中pLVshRNA-eGFP载体是基于HIV1的慢病毒RNA干扰载体,大小为7.8 kb,包含了生产慢病毒所必须的病毒元件、提高病毒滴度、基因表达效率的元件,具有载体结构紧凑、包装效果稳定、病毒滴度高等优点,并且pLVshRNA-eGFP载体表达eGFP荧光蛋白,可以方便地观测病毒感染效率以及用流式荧光分选方法筛选出的阳性细胞。
本研究不仅成功构建鹌鹑输卵管纳豆激酶慢病毒特异表达载体,并且所构建的慢病毒载体将质粒上原来的启动子CMV片段替换成卵清蛋白启动子(OV) [17]。而卵清蛋白启动子是特异性启动子,感染293T细胞效率低,荧光成像eGFP不表达,不能直接用于病毒滴度测定。使用较少采用的实时荧光定量PCR(QPCR)技术测定慢病毒载体滴度,为进一步利用慢病毒载体构建转基因鹌鹑奠定基础,同时也为进一步研究卵清蛋白启动子基因的相关功能提供了优质的稳定转染载体。
参考文献:
[1]Palmiter R D,Brinster R L,Hammer R E,et al. Dramatic growth of mice that develop from eggs microinjected with metallothionein-growth hormone fusion genes[J]. Nature,1982,300(5893):611-615.
[2]Clark A J,Burl S,Denning C,et al. Gene targeting in livestock:a preview[J]. Transgenic Research,2000,9(4/5):263-275.
[3]杨绍清. 鸡的基因转移及用于禽蛋生物反应器基因元件的制备[D]. 北京:中国科学院,1999:119-124.
[4]Love J,Gribbin C,Mather C,et al. Transgenic birds by DNA microinjection[J]. Biotechnology,1994,12(1):60-63.
[5]Borwompinyo S,Brake J,Mozdziak P E,et al. Culture of chicken embryos in surrogate eggshells[J]. Poultry Science,2005,84(9):1477-1482.
[6]李海昌. 鸡胚的体外培养和转基因鸡的研究[D]. 北京:北京农业大学,1995:22-24.
[7]刘凤军,庄益芬,张文昌. 鹅胚胎体外培养的研究[J]. 黑龙江畜牧兽医,2004(1):15-17.
[8]Ivarie R. Avian transgenesis:progress towards the promise[J]. Trends in Biotechnology,2003,21(1):14-19.
[9]Habets G G,Scholtes E H,Zuydgeest D,et al. Identification of an invasion-inducing gene,Tiam-1,that encodes a protein with homology to GDP-GTP exchangers for Rho-like proteins[J]. Cell,1994,77(4):537-549.
[10]于莉娜,张庆玲,李 新,等. Tiam1基因慢病毒表达载体构建及其在HT29细胞中的表达[J]. 实用医学杂志,2010,26(16):2895-2898.
[11]Lee S H,Kunz J,Lin S H,et al. 16-kDa prolactin inhibits endothelial cell migration by down-regulating the Ras-Tiam1-Rac1-Pak1 signaling pathway[J]. Cancer Research,2007,67(22):11045-11053.
[12]Valori C F,Ning K,Wyles M,et al. Development and applications of non-HIV-based lentiviral vectors in neurological disorders[J]. Current Gene Therapy,2008,8(6):406-418.
[13]Shagin D A,Barsova E V,Yanushevich Y G,et al. GFP-like proteins as ubiquitous metazoan superfamily:evolution of functional features and structural complexity[J]. Molecular Biology and Evolution,2004,21(5):841-850.
[14]王耀辉,王明丽,陈九格,等. 靶向TIPE2基因的shRNA慢病毒载体构建及病毒包装[J]. 河南大学学报:医学版,2014,33(2):120-122,134.
[15]黃学兰,徐广贤,贾 伟,等. 小鼠miRNA-203慢病毒过表达载体的构建及病毒包装与滴度测定[J]. 宁夏医科大学学报,2011,33(7):605-608.
[16]Nishitsuji H,Ikeda T,Miyoshi H,et al. Expression of small hairpin RNA by lentivirus-based vector confers efficient and stable gene-suppression of HIV-1 on human cells including primary non-dividing cells[J]. Microbes and Infection/Institut Pasteur,2004,6(1):76-85.
[17]Moffat J,Sabatini D M. Building mammalian signalling pathways with RNAi screens[J]. Nature Reviews Molecular Cell Biology,2006,7(3):177-187.
