丹参蛋白激酶SmSnRK2.4的克隆及表达分析
2017-03-25贾彦彦汝梅金伟波梁宗锁
贾彦彦+汝梅+金伟波+梁宗锁


[摘要]蔗糖非酵解型蛋白激酶家族2(SnRK2)在逆境植物信号转导途径中起着重要作用。该研究根据丹参转录组数据从丹参cDNA中克隆得到一个SnRK2家族基因,命名为SmSnRK24,属于Ⅰ类SnRK2。SmSnRK24基因包含8个内含子,9个外显子,其开放阅读框1 068 bp,编码355个氨基酸,推测其蛋白相对分子质量为4063 kDa,将其构建到原核表达载体pMALc2X上,原核诱导表达出与预测蛋白大小一致的目的蛋白。依据丹参基因组序列,PlantCARE分析SmSnRK24起始密码子ATG上游3 000 bp的启动子系列,结果显示该序列包含Ibox,GAmotif,HSE,LTR,TCrich repeats等逆境胁迫响应元件,以及GAREmotif,Pbox,ABRE,CGTCAmotif等激素响应元件。实时荧光定量PCR分析表明SmSnRK24在丹参根中的含量较高,在茎中和叶中含量相当,ABA和PEG胁迫响应分析表明,SmSnRK24对PEG渗透胁迫响应显著,对ABA胁迫响应微弱。该研究为进一步探讨SmSnRK24基因在丹参干旱胁迫下次生代谢产物积累机制中的作用奠定了基础。
[关键词]丹参; SmSnRK24; 原核表达; 启动子; 实时荧光定量PCR
Cloning and expression analysis of protein kinase
SmSnRK24 from Salvia miltiorrhiza
JIA Yanyan1, RU Mei2, JIN Weibo3, LIANG Zongsuo1,3*
(1 College of Life Science, Northwest Agriculture and Forestry University, Yangling 712100, China;
2 Institute of Soil and Water Conservation, Chinese Academy of Sciences and the Ministry of Water Resources, Yangling 712100, China;
3 College of Life Science, Zhejiang SciTech University, Hangzhou 310018, China)
[Abstract]Sucrose nonfermenting 1related protein kinase 2(SnRK2) plays a key role in abiotic stress signaling in plants In this study, we cloned a SmSnRK24 gene belonging to subclass I of SnRK2 from Salvia miltiorrhiza by screening its transcriptome database The SmSnRK24 gene contains 8 introns and 9 exons, with a 1 068 bp open reading frame encoding a polypeptide of 355 amino acids, the predicted molecular mass of which is 4063 kDa Prokaryotic expression of SmSnRK24 protein using pMALc2X as the expression vector displayed that the recombinant protein of SmSnRK24 gene in E coli was consistent with the predicted size A 3 000 bp promoter sequence of SmSnRK24 contained some stressresponsive elements and hormoneresponsive elements Quantitative realtime PCR analysis revealed that the expression of SmSnRK24 in root was much higher than that in stem and leaf, SmSnRK24 was strongly induced by PEG stress, weakly induced by ABA stress This research provided a basis for further study of the SmSnRK24 gene playing the role in accumulate mechanism of secondary metabolites in S miltiorrhiza under drought
[Key words]Salvia miltiorrhiza; SmSnRK24; prokaryotic expression; promoter; quantitative realtime PCR
丹參,为唇形科鼠尾草属多年生草本植物,是传统大宗药材之一,主要活性成分为水溶性酚酸类化合物和脂溶性丹参酮类。丹参基原植物具有生命力强、世代周期短、组织培养和转基因技术成熟、基因组小、染色体数目少等特点,并且随着丹参转录组信息、全基因组信息的逐步丰富,丹参已被认定为中药研究的理想模式植物[12]。
目前,干旱胁迫成为影响植物生长发育的最严重因子之一,植物在干旱胁迫的环境中会改变细胞内次生代谢产物的积累[3]。丹参是干旱敏感种,在干旱胁迫下通过酚酸类物质积累抵御干旱氧化胁迫[4]。中度干旱胁迫显著促进丹参活性成分的积累已得到研究者们的一致认同[59],在此基础上,刘晓蕾从代谢途径着手,初步研究了中度胁迫下显著提高丹参叶片总酚酸含量积累的机制,即在干旱条件下通过启动水溶性代谢途径关键酶的活性从而调控酚酸类物质的积累[10]。
诸多研究表明,在面对干旱胁迫时,植物体内ABA的快速积累对植物响应干旱胁迫起着重要的作用[11]。SnRK2家族作为ABA信号转导途径中重要成员,已在拟南芥、玉米、水稻、苹果、马铃薯和草莓等物种中得到克隆和功能分析研究[1217]。然而,當前有关SnRK2s在药用植物上的研究几乎空白,限制了其在提高逆境下药用植物次生代谢含量方面的应用。
通过对丹参SnRK2家族成员之一SmSnRK24的分析,将有助于通过基因工程手段提高干旱胁迫下丹参有效成分的含量。聚乙二醇6000(PEG6000)是一种亲水性很强的大分子聚合物,其自身不能通过植物细胞壁而渗入活细胞内,且无毒性,但能使细胞缓慢吸水,利用聚乙二醇作为诱导剂模拟干旱条件具有简单快速、周期短、重复性好等特点,因此,近年来常被广泛用于植物的耐旱性分析[1819]。研究表明,PEG能模拟干旱胁迫的原因是其可阻塞植物的输导组织,且其模拟干旱胁迫与土壤控水的结果相同[2022],当15%≤PEG≤25%时即可模拟中度干旱胁迫[2324]。
本研究首次以药用模式植物丹参为材料,对SmSnRK24基因进行了生物信息学分析,原核表达分析,启动子分析和组织特异性分析,同时也分析了在ABA处理和PEG模拟中度干旱胁迫下SmSnRK24基因的响应情况,旨在为深入研究丹参SmSnRK24基因功能奠定基础,同时为了解丹参中ABA信号转导途径提供科学积累。
1材料
11植物将丹参种子播种于穴盘中,组培间培养,种子萌发并长出一对真叶后移栽至营养钵中,每个营养钵3棵幼苗,培养至60 d时用于各种分析。组织特异性分析:分别取60 d龄丹参幼苗的根、茎和叶于液氮中迅速冷冻,置于-80 ℃冰箱冻存备用。ABA处理和PEG处理:分别用100 μmol·L-1 ABA和20% PEG溶液喷洒并浇灌丹参苗,样品分别于处理后0,05,1,3,6,9,12,24 h进行收集,以对应条件下的H2O处理作为对照,材料收集后液氮速冻,置于-80 ℃冰箱冻存备用。
12菌种及载体pMALc2X购于NEB有限公司,大肠杆菌DH5α感受态购于康为世纪生物科技有限公司,T载体(pEASYBlunt Simple Cloning Kit)购自全式金生物技术有限公司,宿主菌Rosetta本实验室保存。
13工具酶及主要试剂pfu DNA聚合酶、T4 DNA连接酶、限制性核酸内切酶购于Thermo公司,RNAprep Pure植物总RNA提取试剂盒(DP432)购于北京天根生化科技有限公司,相对分子质量标准200 bp Ladder、反转录试剂盒、荧光定量试剂盒均购于TaKaRa有限公司,DNA回收纯化试剂盒和质粒提取试剂盒均购自OMEGA公司,预染蛋白Marker购于北京全式金生物技术有限公司,PCR引物均由北京奥科技术有限公司合成。
2方法
21总RNA提取及DNA提取参照RNAprep Pure植物总RNA提取试剂盒的使用说明书进行丹参植物根、茎、叶以及对照和处理材料总RNA的提取,用10%琼脂糖凝胶电泳检测其完整性,并利用核酸浓度检测仪测定获得RNA的浓度及纯度。RNA反转录为cDNA依据TaKaRa反转录试剂盒的操作步骤进行。DNA提取采用改良的CTAB法。
22SmSnRK24基因cDNA的克隆和基因组序列的获得以拟南芥SnRK2基因家族保守序列为参考,从丹参转录组数据库中Blast丹参SnRK2s基因,筛选出的其中1条SnRK2基因长1 846 bp,用Primer Premier 50软件设计基因特异性引物。上游引物:5′GATACACAAACCCACTCTGCACTAC3′,下游引物:5′CAAGAAAATACAGAAGTTCTCATC3′,分别以反转录的cDNA和DNA为模板进行扩增。在25 μL扩增体系中含无RNA酶水172 μL,dNTP Mixture(25 mmol·L-1) 2 μL,10×Pfu buffer 25 μL(含MgSO4),引物(10 μmol·L-1)各1 μL,模板1 μL,Pfu DNA Polymerase 03 μL。反应条件:94 ℃预变性5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 5 min,33个循环;最后72 ℃再延伸8 min。PCR扩增出的特异片段回收、连接至pEASYBlunt Simple载体中,25 ℃连接15 min后,转入大肠杆菌DH5α感受态中,涂布在加氨苄青霉素(终浓度为100 mg·L-1)的LB平板上,37 ℃培养过夜。挑取生长良好的单克隆于加氨苄青霉素的液体LB培养基中活化,菌液PCR验证,选择阳性菌液送上海立菲生物技术有限公司进行测序,获得SmSnRK24pEASY重组质粒。
贾彦彦等:丹参蛋白激酶SmSnRK24的克隆及表达分析23SmSnRK24基因的生物信息学分析将测序所得的cDNA序列通过NCBI在线比对(https://blastncbinlmnihgov/Blastcgi),找出与其同源性较高的其他物种的氨基酸序列,然后用DNAMAN软件进行同源性比较;从NCBI网站下载模式植物拟南芥和双子叶植物苹果的SnRK2家族成员氨基酸序列,应用MEGA606使用NJ法(bootstrap 1000)构建系统进化树;利用NCBI(http://www.ncbi.nlm.nih.gov/gorf/gorfhtml)中的ORFfinder和GENSCAN在线软件(http://genes.mit.edu/GENSCANhtml)分析其ORF序列;利用GSDS20在线软件(http://gsds.cbi.pkueducn/)分析基因的内含子和外显子序列;利用Expasy工具(http://web.expasy.org/protparam/)进行氨基酸残基数目、组成、蛋白质相对分子质量、理论等电点和亲、疏水性的在线分析;利用Expasy工具中的SOPMA软件(https://npsaprabiibcpfr/cgibin/npsa_automatpl?page=/NPSA/npsa_sopmahtml)在线预测分析α螺旋、β折叠和无规则卷曲;利用Expasy工具中的SWISSMODEL(http://swissmodelexpasyorg/)进行蛋白的三维结构预测;利用NetPhos 20 Server(http://wwwcbsdtudk/services/NetPhos/)对SmSnRK24蛋白进行磷酸化位点分析。
24SmSnRK24蛋白原核表达根据SmSnRK24基因的ORF序列,设计上游引物F:5′CGCGGATCCATGGAGAAATAC3′(下划线处为保护碱基和BamHⅠ酶切位点),下游引物R:5′GACGTCGACCTAAGTGATACG3′(下劃线处为保护碱基和SalⅠ酶切位点),以上述重组质粒SmSnRK24pEASY为模板进行扩增,将PCR产物连接到表达载体pMALc2X的BamHⅠ和SalⅠ酶切位点处,获得重组质粒SmSnRK24pMAL,将鉴定和测序正确的重组质粒和空的表达载体分别转化到大肠杆菌Rosetta中,挑取重组菌的单菌落接种至含有氨苄霉素的LB液体培养基中,37 ℃培养过夜,然后按照1∶100稀释到含有抗生素的LB液体培养基中,当A600达到06~08的时候分别加入01,03,05,07,09 mmol·L-1 IPTG诱导表达,22 ℃诱导16 h。取诱导后菌液1 mL,4 000 r·min-1离心10 min,收集菌体,弃上清,用PBS重悬沉淀,取20 μL重悬液加入5 μL的 5×蛋白loading buffer,沸水浴5 min,SDSPAGE进行分析。
25SmSnRK24基因启动子分析SmSnRK24基因的5′侧翼序列根据丹参基因组序列分析所得。转录应答元件的分析采用PlantCARE database (http://bioinformaticspsbugentbe/webtools/plantcare /html/)进行。
26SmSnRK24基因表达分析利用实时荧光定量PCR对SmSnRK24在丹参不同器官及不同胁迫处理条件下的表达进行分析。所使用的定量引物序列为F: 5′TTGCCAACTCTTCTAGGAGAAT3′,R: 5′GGTTCTCTTTGCGGTAATACAC3′。PCR的反应体系如下:125 μL SYBR Premix Ex Taq酶,上下游引物(10 μmol·L-1)各2 μL,cDNA模板(150 mg·L-1)2 μL,加水补足至25 μL,3个平行重复。扩增程序为:95 ℃预变性30 s,95 ℃变性5 s,58 ℃退火30 s,40个循环。溶解曲线程序:从65 ℃以每5 s 05 ℃的速度升至95 ℃。以植物的管家基因之一βactin基因作为内参,利用2-ΔΔCt法计算相对表达量。所有处理均设3个生物学重复。实时荧光定量PCR数据利用CFX Manager(BioRad,USA)处理分析,利用SPSS软件(Version 160)进行显著性分析。
3结果与分析
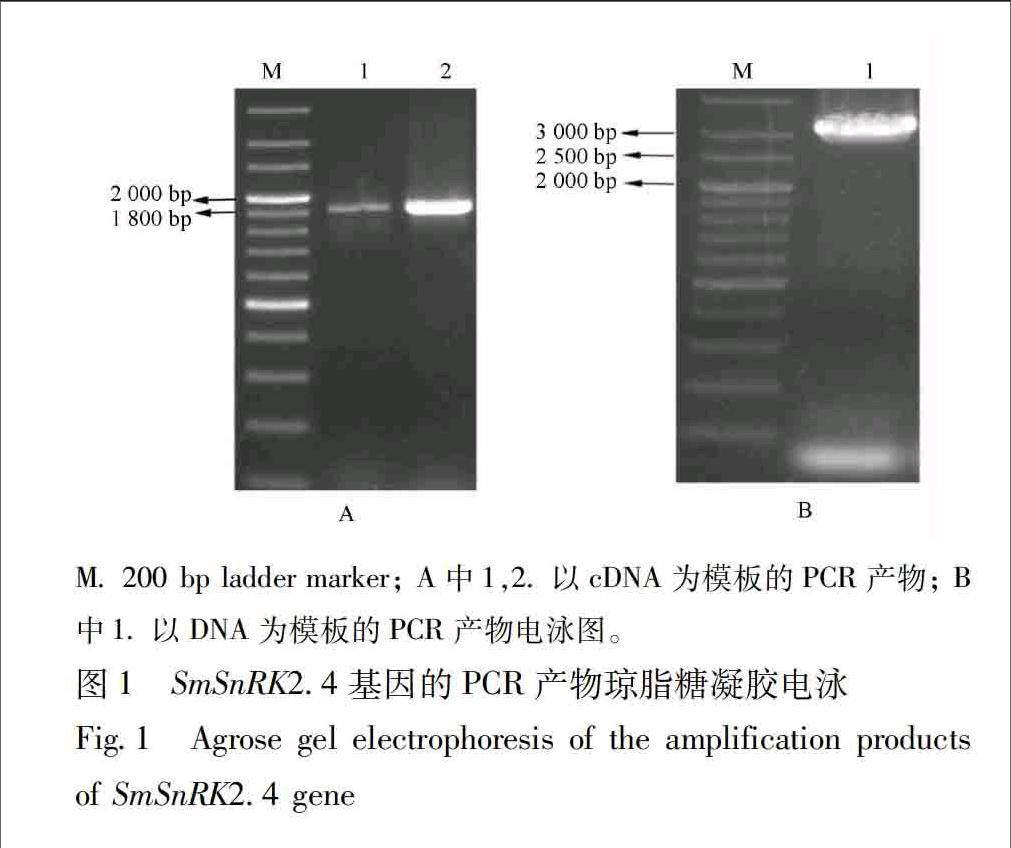
31SmSnRK24基因全长cDNA和基因组DNA序列的获得根据拟南芥的10个SnRK2家族成员的保守序列,利用本地Blast检索程序,从丹参转录组数据库中Blast丹参SnRK2s基因,搜索出的其中1条SnRK2基因序列长1 846 bp,将其通过NCBI的blastX比对,确定其为SnRK2家族成员,命名为SmSnRK24,根据该序列设计特异引物,以反转录的cDNA为模板,进行PCR扩增,扩增出与目的大小一致的单一特异条带,见图1A。将其回收、克隆送去测序,分析测序结果,与目的序列完全吻合,无碱基缺失或替换情况。为了分析其基因组序列信息,以丹参DNA为模板,用上述特异引物进行PCR扩增,扩增出大小在3 000 bp左右的单一特异条带,回收、克隆测序,测序结果分析显示:该特异条带大小为3 136 bp,见图1B。
32SmSnRK24基因的生物信息学分析结合ORFfinder和GENSCAN在线软件分析,确定1 846 bp 的SmSnRK24 cDNA序列中包含开放阅读框(ORF)1 068 bp,位于序列的483~1 550 bp位置,将ORF序列与获得的DNA序列比对,查找DNA序列中的内含子,结果显示:SmSnRK24含有8个内含子,9个外显子,剪切位点符合GU/AG规则,内含子和外显子的分布情况见图2。SmSnRK24基因编码355个氨基酸,将其氨基酸序列通过NCBI Blastp 比对表明,与其他物种的SnRK2相似度较高,见图3。与唇形目芝麻Sesamum indicum、鼠李目葡萄Vitis vinifera、茄目甜辣椒Capsicum annuum、茄目烟草Nicotiana tabacum的SnRK2基因氨基酸序列相似度分别达到91%,90%,93%,92%,说明SnRK2基因家族的保守性很强。通过与拟南芥SnRK2家族的10个基因和苹果SnRK2家族的10个基因的氨基酸聚类分析发现,SmSnRK24属于SnRK2家族第Ⅰ亚家族,见图4。
利用Expasy工具分析显示,SmSnRK24编码蛋白相对分子质量为40637 kDa,等电点为585,平均亲水系数(GRAVY)为-0533,二级结构分析结果表明,SmSnRK24的二级结构中α螺旋占4225%,
β转角占817%,无规则卷曲占3127%,延伸链占1831%;三维结果预测发现,SmSnRK24预测编码蛋白三级结构与二级结构预测结果相符合;NetPhos 20 Server分析结果表明,SmSnRK24有9个丝氨酸磷酸化位点,3个苏氨酸磷酸化位点,6个酪氨酸磷酸化位点。
33SmSnRK24蛋白原核表达SmSnRK24的ORF片段与表达载体pMALc2X的连接产物转入大肠杆菌DH5α中,进行菌液PCR验证,将经鉴定后的阳性克隆提取重组质粒,进行双酶切鉴定,将菌液PCR和酶切鉴定均为阳性克隆的质粒送测序,测序结果显示基因序列正确插入表达载体pMALc2X中。
将重组质粒和空载体pMALc2X分别转入大肠杆菌Rosetta中,加入不同浓度的IPTG诱导后,收集菌体,PBS重悬,加蛋白上样缓冲液煮沸,经12% SDSPAGE电泳分析,含有重组质粒的菌体经IPTG诱导出目的条带,见图5中方框所示。表明重组质粒在大肠杆菌中成功表达,此外,从图中可以看出在IPTG浓度为05,07,09 mmol·L-1时,蛋白诱导量相对较多。
34SmSnRK24启动子分析利用PlantCARE Database对约为30 kb的丹参SnRK24基因5′侧翼序列进行分析,结果显示,该启动子序列中含有包含Ibox,GAmotif,HSE,LTR,TCrich repeats等逆境胁迫响应元件,以及GAREmotif,Pbox,ABRE,
CGTCAmotif等激素响应元件。部分响应元件见表1,推测该基因的表达可能受到上述各因素的调控。
35SmSnRK24的表达分析在丹参不同部位中的表达:以移栽培养60 d的丹参幼苗为材料,
M预染蛋白marker; 1空pMALC2X未诱导蛋白样; 2空pMALC2X诱导蛋白样; 3融合蛋白未诱导蛋白样; 4融合蛋白01 mmol·L-1 IPTG诱导蛋白样; 5融合蛋白03 mmol·L-1 IPTG诱导蛋白样; 6融合蛋白05 mmol·L-1 IPTG诱导蛋白样; 7融合蛋白07 mmol·L-1 IPTG诱导蛋白样; 8融合蛋白09 mmol·L-1 IPTG诱导蛋白样。
以丹参管家基因之一βactin为内参,利用实时荧光定量PCR分析SmSnRK24基因在丹參根、茎、叶中的表达,把茎中目的基因的表达量设为1,测定根
元件名称功能ABRE参与ABA响应的顺式作用元件AuxRRcore参与生长素响应的顺式作用元件CAATbox真核生物常有的增强调节区CGTCAmotif参与茉莉酸甲酯响应的顺式作用元件Gbox/Ibox参与光响应的顺式调节元件HSE参与热胁迫的顺式作用元件MBS参与干旱诱导的MYB结合位点TATAbox位于转录起始位点上游约-30 bp处,真核生物启动子基本元件TCrich repeats胁迫反应相关响应元件GAREmotif/Pbox赤霉素响应元件LTR低温响应作用元件TCAelemen水杨酸响应作用元件
和叶中目的基因相对于茎的表达量。结果显示,基因在所有检测部位中均有表达,在根中的表达量最高,在茎中和叶中的表达量几乎相同,见图6。
ABA和PEG胁迫处理下的表达:以移栽培养60 d的丹参幼苗为材料,进行PEG和ABA处理,利用实时荧光定量PCR对不同处理条件下目标基因的表达情况进行分析。该基因对PEG胁迫响应显著,快速响应PEG诱导,在05 h时达到高峰,经过1 h时的迅速下降后,3 h 时又恢复高峰,之后开始逐渐降低,在12 h时降到最低表达水平后,24 h上升达到最高峰;ABA对该基因的诱导效果甚微,基因的转录水平仅在9 h时出现显著升高,在05,1,6 h时出现了不同程度的下调,在3,12,24 h时则不受ABA诱导,见图7。
4讨论
SnRK2是植物体特有的一类Ser/Thr类蛋白激酶,研究表明,SnRK2家族成员在ABA信号转录途径和抗渗透胁迫中扮演着重要的角色。针对SnRK2家族成员对干旱和ABA胁迫响应的情况,相关研究表明:在拟南芥SnRK2家族的10个成员当中,9个能够被高渗胁迫所激活,其中只有5个能够被ABA所诱导[12];在玉米11个SnRK2家族成员中5个受ABA激活[14];在水稻10个SnRK2成员,所有的家族成员都受高渗胁迫的诱导,其中有3个成员受ABA的诱导[13];小麦中TaSnRK23/24/28对外源ABA和干旱胁迫具有不同程度的响应[2527];马铃薯中8个SnRK2基因均受PEG诱导表达,而外源ABA只能诱导StSnRK23基因的表达[16]。从系谱发生的分析中,SnRK2基因家族被分为3个亚家族,分别为groupⅠ,groupⅡ,groupⅢ,研究表明,groupⅠ不受ABA的激活,groupⅡ对ABA具有微弱的响应或不响应,而groupⅢ受ABA的强烈激活,所有的基因除AtSnRK29外,均受高渗胁迫的诱导[1213,28]。
目前,对SnRK2家族成员的功能在模式植物和一些大田作物中已得到了较为充分的阐述,然而,在药用植物中的研究还相对较少,作为药用模式植物丹参,随着其转录组和基因组信息的丰富,为研究目标基因提供了极大的便利。
本研究首次从丹参转录组中筛选得到了丹参的SnRK2家族成员之一SmSnRK24基因,对其基因特性和空间结构进行了生物信息学分析,并构建了该基因的原核表达载体,成功地在大肠杆菌中表达,这为后续SmSnRK24的功能研究奠定了基础。利用实时荧光定量PCR技术检测其在PEG模拟的干旱胁迫和ABA胁迫下的表达水平,结果显示:SmSnRK24基因受PEG和ABA的诱导,这与启动子作用元件的预测结果相一致,其对PEG胁迫的响应较为迅速且强烈,呈现波浪形趋势,这与TaSnRK23/24/28和NtSnRK28基因在PEG胁迫下的表达趋势基本相似,这可能是由SnRK2s家族基因对逆境胁迫的响应机制所决定,详细机理的阐述还有待进一步研究[2527,29]。其对ABA胁迫的响应微弱,结合对SmSnRK24基因磷酸化位点分析结果,推测该基因可能通过磷酸化修饰后参与植物抗逆途径,属于ABA非依赖型。
适当干旱胁迫有助于提高丹参有效成分的含量,而在抗渗透胁迫中扮演着重要的角色的SmSnRK24是如何调节丹参有效成分的含量,其通过何种信号转导途径来调节丹参有效成分含量,这都是后续要努力的方向,本研究为后续研究提供了科学的理论依据。
[参考文献]
[1]王庆浩,陈爱华,张伯礼 丹参:一种中药研究的模式生物[J] 中医药学报, 2009(37):1
[2]宋经元,罗红梅,李春芳,等 丹参药用模式植物研究探讨[J] 药学学报, 2013, 48(7): 1099
[3]盛东峰,陈龙 聚乙二醇6000胁迫对丹参毛状根中丹参酮积累的影响[J] 中草药, 2013, 44(9):1181
[4]Bettaieb I, HamrouniSellami I, Bourgou S, et al Drought effects on polyphenol composition and antioxidant activities in aerial parts of Salvia officinalis L[J] Acta Physiol Plant, 2011, 33(4):1103
[5]刘景玲 UVB辐射和干旱对丹参生物量及酚酸类成分含量的影响[D] 杨凌: 西北农林科技大学, 2014
[6]左小容 干旱对丹参的生长及有效成分积累的影响[D] 杨凌: 西北农林科技大学, 2011
[7]刘大会, 郭兰萍, 黄璐琦, 等 土壤水分含量对丹参幼苗生长及有效成分的影响[J] 中国中药杂志, 2011, 36(3):321
[8]韩立敏, 俞嘉宁, 魏新丽, 等 干旱、盐胁迫处理对丹参无菌苗中丹参素含量的影响[J]中国中药杂志, 2008, 33(10):1211
[9]高扬 不同土壤水分对丹参耗水特性及有效成分含量的影响[D] 杨凌: 西北農林科技大学, 2004
[10]刘晓蕾 干旱下丹参酚酸类化合物积累机制及其抗寒性研究[D] 杨凌: 西北农林科技大学, 2011
[11]Fujita Y, Fujita M, Shinozaki K, et al ABAmediated transcriptional regulation inresponse to osmotic stress in plants[J] J Plant Res, 2011, 124:509
[12]Boudsocq M, BarbierBrygoo H, Lauriere C Identification of nine sucrose non fermenting 1related protein kinases 2 activated by hyperosmotic and saline stresses in Arabidopsis thaliana[J] J Biol Chem, 2004, 279(40):41758
[13]Kobayashi Y, Yamamoto S, Minami H,et al Differential activation of the rice sucrose non fermenting1related protein kinase2 family by hyperosmotic stress and abscisic acid[J] Plant Cell, 2004, 16(5):1163
[14]Huai J L, Wang M, He J G, et al Cloning and characterization of the SnRK2 gene family from Zea mays[J] Plant Cell Rep, 2008, 28:1861
[15]陈娜娜, 刘金义, 蔡斌, 等 苹果SnRK2基因家族的鉴定和生物信息学分析[J] 中国农学通报, 2013, 29(13):120
[16]毛娟 马铃薯抗逆相关基因SnRK2家族的克隆与功能分析[D] 兰州:甘肃农业大学, 2014
[17]Han Y, Dang R H, Li J X, et al Sucrose nonfermenting1related protein kinase26, an ortholog of open stomata1, is a negative regulator of strawberry fruit development and ripening[J] Plant Physiol, 2015, 167(3):915
[18]梁国玲, 周青平, 颜红波 聚乙二醇对羊茅属4种植物种子萌发特性的影响研究[J] 草业科学, 2007, 24(6):50
[19]杨柳, 周瑞阳, 金声杨 PEG模拟干旱胁迫对11份黄麻种子萌发的效应[J] 南方农业学报, 2011, 42(7):715
[20]Rawlor D W Absorption of polyethylene glycol by plants and their effects on plant growth[J] New Phytol, 1970, 69:501
[21]Kaufmann M R, Eckard A N Evaluation of water stress control with polyethylene glycol by analysis of guttation[J] Plant Physiol, 1971, 47:453
[22]刘晓东, 李洋洋, 何淼 PEG模拟干旱胁迫对玉带草生理特性的影响[J] 草业科学, 2012, 29(5):687
[23]刘丹, 王雪, 杨毅, 等 PEG胁迫对萌动苦豆子子叶抗旱生理及氧化苦参碱含量的影响[J] 干旱地区农业研究, 2016, 34(3):166
[24]陈郡雯, 吴卫, 郑有良, 等 聚乙二醇(PEG6000)模拟干旱条件下白芷苗期抗旱性研究[J] 中国中药杂志, 2010, 35(2):149
[25]Tian S J, Mao X G, Zhang H Y, et al Cloning and characterization of TaSnRK23, a novel SnRK2 gene in common wheat[J] J Exp Bot, 2013, 64(7):2063
[26]Mao X G, Zhang H Y, Tian S J, et al TaSnRK24, an SNF1type serine/threonine protein kinase of wheat(Triticum aestivum L), confers enhanced multistress tolerance in Arabidopsis[J] J Exp Bot, 2010, 61:683
[27]Zhang H Y, Mao X G, Wang C S, et al Overexpression of a common wheat gene TaSnRK28 enhances tolerance to drought, salt and low temperature in Arabidopsis[J] PLoS ONE, 2010, 5:e16041
[28]Kulik A, Wawer I, Krzywińska E, et al SnRK2 protein kinaseskey regulators of plant response to abiotic stresses[J] OMICS, 2011, 15(12):859
[29]Zhang H Y, Jia H F, Liu G S, et al Cloning and characterization of NtSnRK27 and NtSnRK28 genes involved in abiotic stress responses from Nicotiana tabacum[J] Acta Physiol Plant, 2014, 36: 1673
[责任编辑吕冬梅]
[收稿日期]20160709
[基金项目]国家自然科学基金项目(81373908);浙江省自然科学基金项目(LZ16H280001);科技部“十二五”科技支撐项目(2015BAC01B03)
[通信作者]梁宗锁,Email:liangzs@msiswcaccn
[作者简介]贾彦彦,博士研究生,主要从事药用植物次生代谢分子调控机理研究,Email:xiyanaidi@163com
