qRT-PCR法分析复发性SLE患者肠道双歧杆菌、柔嫩梭菌数量的变化
2018-04-20吴霞肖盼盼谢晓然孙雪茜付冰冰孙晓鹏
吴霞 肖盼盼 谢晓然 孙雪茜 付冰冰 孙晓鹏

摘 要:目的 运用实时荧光定量聚合酶链式反应(qRT-PCR)法分析系统性红斑狼疮患者肠道菌群数量的变化,探讨双歧杆菌、柔嫩梭菌与复发性SLE活动的关系。方法 提取粪便细菌组DNA,运用qRT-PCR法分析此二菌绝对数量的变化。结果 SLE复发活动期双歧杆菌、柔嫩梭菌数量均较治疗后稳定期减少(P<0.05),对比正常对照组也均减少(P<0.05)。结论 双歧杆菌、柔嫩梭菌菌群数量与SLE活动度评分相关,肠道内此二菌数量减少可能与SLE病情的复发有关。
关键词:系統性红斑狼疮;双歧杆菌;柔嫩梭菌;实时荧光定量PCR
中图分类号:R593.241 文献标识码:A DOI:10.3969/j.issn.1006-1959.2018.05.022
文章编号:1006-1959(2018)05-0065-05
Analysis of the Changes of Intestinal Bifidobacterium and Clostridium Tenella in Patients with Recurrent SLE by qRT-PCR
WU Xia1,XIAO Pan-pan1,XIE Xiao-ran1,SUN Xue-qian2,FU Bing-bing2,SUN Xiao-peng2
(1.Jiamusi University,Jiamusi 154007,Heilongjiang,China;
2.Department of Rheumatological Immunology,First Affiliated Hospital of Jiamusi University,Jiamusi 154002,Heilongjiang,China)
Abstract:Objective To investigate the relationship between bifidobacterium,Clostridium tenella and recurrent SLE activity in patients with systemic lupus erythematosus by real-time quantitative polymerase chain reaction(qRT-PCR).Methods The DNA of fecal bacteria group was extracted,and the absolute quantity of the two bacteria was analyzed by qRT-PCR method.Results Bifidobacterium in the recurrent stage of SLE was found to be bifidobacterium.The number of Clostridium tenella was lower than that of stable period after treatment(P<0.05),compared with the normal control group,it was also decreased(P<0.05).Conclusion The number of bifidobacterium and Clostridium tenella was correlated with the SLE activity score,and the decrease of these two bacteria in the intestinal tract might be related to the recurrence of SLE.
Key words:Systemic lupus erythematosus;Bifidobacterium;Clostridium tenella;Real-time fluorescence quantitative PCR
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及全身各组织的自身免疫炎症性疾病[1],肠道内多种细菌与SLE相关。越来越多的证据表明[2],机体免疫功能的正常与宿主肠道内微生物群和宿主免疫系统间的动态平衡密切相关。Yeoh N等[3]提出肠道菌群与自身免疫病存在一定的关联。2013年Kamada等[4]发现小鼠肠道内微生物的菌群失调与多种自身免疫性疾病有关。2014年Hevia A[5]首次证实人SLE可致肠道中厚壁菌门/拟杆菌门数量改变。本研究旨在分析SLE患者在病情活动期治疗前、稳定期治疗后及正常对照组粪便中双歧杆菌、柔嫩梭菌数量的变化,探讨此二菌与复发性SLE病情活动的关系。
1资料与方法
1.1一般资料 选取2015年12月~2016年12月佳木斯大学附属第一医院住院SLE患者30例为SLE组,男4例,女26例,年龄15~50岁,平均年龄(27.52±12.51)岁。对照组男4例,女26例,年龄11~50岁,平均年龄(26.81±13.70)岁。SLE组用药为:泼尼松1 mg/(kg·d)至病情稳定2周后每周减量10%,羟氯喹0.4 g/d。根据SLE活动度评分(systemic lupus erythematosus disease activity index,SLEDAI)分为治疗前活动期组(≥5分)和治疗后稳定期组(≤4分)。纳入标准:①11~50岁之间的非绝经期女性和同年龄段的男性患者;②符合SLE诊断标准确诊为狼疮者。排除标准:①首次确诊SLE者;②合并严重的心脑血管、肝、肾、肺等疾病不能后续追踪病情者;③合并消化道慢性疾病者;④近4周内使用可能对菌群造成影响的药物;⑤合并可引起口腔菌群改变的口腔疾病者。本实验已通过医院伦理委员会同意。
1.2方法
1.2.1粪便标本采集及DNA提取 采集研究对象新鲜便标本迅速置于-80 ℃冰箱冻存。秤取中段标本180~200 mg,粪便基因组DNA提取试剂盒(北京天根)提取粪便细菌组DNA,洗脱体积50 μl。DU800核酸蛋白分析仪测OD260值,确定DNA浓度并稀释成20 ng/μl,小管分装后-20 ℃保存备用。
1.2.2 PCR反应和琼脂糖凝胶电泳 PCR反应体系:2X PCR Taq MasterMix/with dye 25 μl;上下游引物各1 μl;DNA模板7 μl;ddH2O 16 μl。条件:94 ℃预变性3 min,94 ℃变性20 s,退火30 s,72 ℃延伸30s,30个循环。反应结束,产物行2.0%琼脂糖凝胶电泳(100 V,30 min)。Tocan800凝胶成像分析仪留取图像。双歧杆菌、柔嫩梭菌引物由北京擎科生物公司合成,见表1。
1.2.3标准品制备 琼脂糖凝胶纯化回收试剂盒(北京天根)回收PCR产物胶块DNA,DU800测定浓度及纯度,选择纯度最佳者为标准品,并将其换算成各标准品1 μl的拷贝数制作标准曲线。
1.2.4实时荧光定量PCR ①标准品曲线生成:将2种标准品做10倍倍比稀释(106~102 copies/μl),设5个浓度梯度分别作为模板加入qRT-PCR体系中。总体系20 μl:SYBR Premix Ex Taq II(2×)10 μl;上下游引物各0.8 μl;ROX Reference Dye 0.4 μl;DNA模板2 μl,ddH2O 6 μl。条件:95 ℃预变性30 s;95℃变性5 s,60 ℃退火31 s,40个循环,95 ℃复性15s,95~60 ℃以0.5 ℃间隔收集荧光,生成标准曲线。②样本绝对定量:将DNA提取液作模板,反应体系及条件同标准品,各实验均设有校正组和阴性对照组,3个平行复孔,反应完毕生成扩增曲线及溶解曲线。
1.3统计学方法 采用SPSS20.0统计软件进行分析。各组间年龄、性别、体重指数等差异采用单因素方差分析。细菌计量资料以(x±s)表示,SLE治疗前后比较采用配对t检验,多组比较采用SLD-t检验,P<0.05为差异有统计学意义。SLE治疗前活动期组菌群数量与SLEDAI关系采用线性回归法分析。
2结果
2.1引物特异性验证 100bp DNA Marker标准,引物特异性良好,见图1,图2。
2.2荧光定量PCR ①标准曲线:以标准品的对数值为横坐标,Ct值为纵坐标作标准曲线,见图3,图4,计算各样本中二菌的绝对拷贝数。②扩增曲线:以校正后荧光强度ΔRn为纵坐标,循环数为横坐标,阈值在对数期内,见图5,图6。③溶解曲线:二菌均为单峰,扩增产物单一,引物特异性好,见图7,图8。
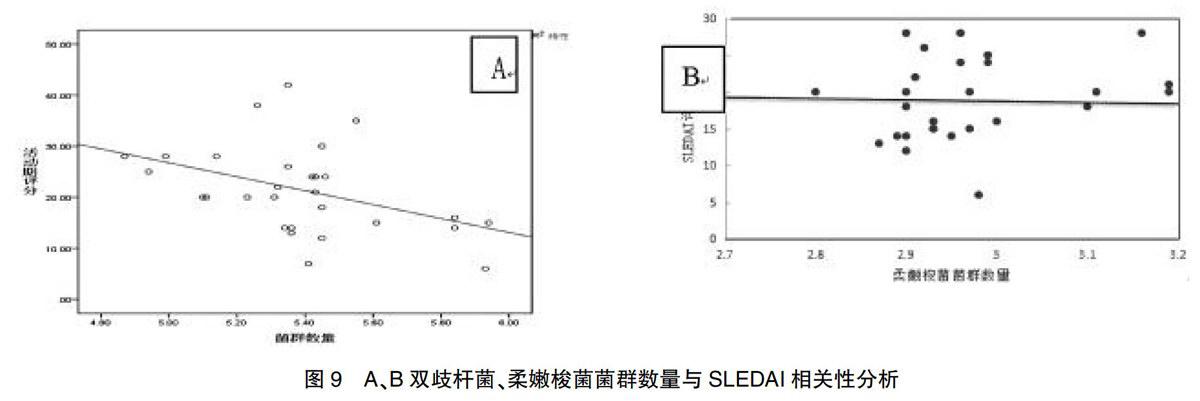
2.3肠道菌群的绝对定量结果 年龄、性别、体重指数差异无统计学差异(P>0.05)。复发活动期治疗前粪便中双歧杆菌、柔嫩梭菌数量均明显低于稳定期治疗后组相较于正常对照组,此二菌数量亦明显降低,治疗后稳定期组与正常对照组无明显差异(P>0.05),见表3。双歧杆菌、柔嫩梭菌菌群数量与SLEDAI相关性分析,见图9。
3讨论
人的肠道内包含原生动物、真菌和细菌的多种组合(>1000种)。在健康人体肠道内,其数量能达到1014个[6]。本研究中双歧杆菌、柔嫩梭菌是人体肠道内的常驻厌氧菌。双歧杆菌通过抑制B细胞转化并促进抗炎因子IL-10、TGF-β的分泌、保护肠上皮细胞免于致病菌的侵袭;柔嫩梭菌抑制外周血单核细胞(PBMC)中促炎细胞因子如IL-12、IFN-γ、TNF-α的释放抑制炎症反应。同时研究证实,短链脂肪酸(SCFAs)是SLE肠道菌群与宿主代谢之间交叉反应的潜在协调者[7]。SCFAs的异常生成与微生物的肠道改变密切相关[8]。丁酸盐是SCFAs中的一员,是肠道最丰富的微生物代谢产物之一[9]。双歧杆菌、柔嫩梭菌等厌氧菌能够将碳水化合物转化为丁酸盐,后者则通过诱导粘蛋白合成,抑制NF-κB等多个代谢通路抑制肠道致病菌的繁殖;也能在应激状态下诱导HSP25(肠上皮热休克蛋白)和HSP72的产生,下调促炎细胞因子表达,发挥抗炎作用;同时为哺乳动物肠上皮细胞再生、修复以及发育提供主要能量DE来源[10]等多种方式维持宿主的肠黏膜免疫功能正常。本实验通过对比复发性SLE患者與健康对照组粪便中两细菌的数量发现,SLE复发活动期治疗前两种细菌数量较正常对照组均明显降低,提示复发性SLE患者活动期肠道内此二菌菌群失调;复发治疗前活动期组较治疗后稳定期组两菌群数量明显减少。本次实验中肠道内双歧杆菌、柔嫩梭菌菌群数量与SLEDAI也存在明显相关,菌群数量随SLEDAI评分的降低而逐渐增多。综上推断,宿主肠道内此二菌菌数量减少可能与复发性SLE患者病情活动有关。
SLE是累及胃肠道等全身多系统症状的一种慢性的自身免疫炎性疾病。临床上常采用泼尼松联合羟氯喹等免疫抑制剂控制炎症、抑制免疫反应治疗SLE。羟氯喹直接作用于宿主细胞,并不直接作用于入侵的病原体,得出羟氯喹对细菌的作用是非常有限的,故本研究中治疗药物羟氯喹对肠道菌群数量的影响认为是可以忽略的。
本研究可能为深入研究SLE的肠道菌群提供一些参考。但由于实验条件有限,未能明确阐述泼尼松不同剂量对肠道内双歧杆菌、柔嫩梭菌数量的影响,将在后续的实验中改进实验方案后再继续论述。
参考文献:
[1]Rodríguezcarrio J,López P,Sánchez B,et al.Intestinal Dysbiosis Is Associated with Altered Short-Chain Fatty Acids and Serum-Free Fatty Acids in Systemic Lupus Erythematosus[J].Frontiers in Immunology,2017,8(1):23.
[2]Strober W.Impact of the gut microbiome on mucosal inflammation[J].Trends in Immunology,2013,34(9):423-430.
[3]Yeoh Nigel,Burton J P,Suppiah P,et al.The role of the microbiome in rheumatic diseases[J].Current Rheumatology Reports,2013,15(3):1-11.
[4]Kamada N,Seo SU,Chen GY,et al.Role of the gut microbiota in immunity and inflammatory disease[J].Nature Reviews Immunology,2013,13(5):321-335.
[5]Hevia A,Milani C,López P,et al.Intestinal dysbiosis associated with systemic lupus erythematosus[J].Mbio,2014,5(5):e01548.
[6]Sommer F, Bckhed F.The gut microbiota-masters of host development and physiology[J].Nature Reviews Microbiology,2013,11(4):227-38.
[7]Rodríguez-Carrio J,López P,Sánchez B,et al.Intestinal Dysbiosis Is Associated with Altered Short-Chain Fatty Acids and Serum-Free Fatty Acids in Systemic Lupus Erythematosus[J].Frontiers in Immunology,2017,8(1):23.
[8]Salonen A,Lahti L,Salojarvi J,et al.Impact of diet and individual variation on intestinal microbiota composition and fermentation products in obese men[J].The ISME Journal,2014,8(11):2218-2230.
[9]Park JH,Kang SG,Kim MH,et al.Short-chain fatty acids activate GPR41 and GPR43 on intestinal epithelial cells to promote inflammatory responses in mice[J].Gastroenterology,2013,145(2):396-406.
[10]De Vadder F,Kovatcheva-Datchary P,Goncalves D,et al.Microbiota-generated metabolites promote metabolic benefits via gut-brain neural circuits[J].Cell,2014,156(1-2):84.
