小麦粒重形成的分子调控机制研究综述
2016-04-27郭嘉莲万琳涛徐林峰丁明全浙江农林大学农业与食品科学学院浙江省农产品品质改良技术研究重点实验室浙江临安00浙江省开化县农作物技术推广站浙江开化400浙江勿忘农种业科学研究院有限公司浙江杭州000
魏 玮,郭嘉莲,万琳涛,徐林峰,丁明全,周 伟(.浙江农林大学农业与食品科学学院/浙江省农产品品质改良技术研究重点实验室,浙江临安00;.浙江省开化县农作物技术推广站,浙江开化400;.浙江勿忘农种业科学研究院有限公司,浙江杭州000)
小麦粒重形成的分子调控机制研究综述
魏玮1,郭嘉莲1,万琳涛2,徐林峰3,丁明全1,周伟1
(1.浙江农林大学农业与食品科学学院/浙江省农产品品质改良技术研究重点实验室,浙江临安311300;2.浙江省开化县农作物技术推广站,浙江开化324300;3.浙江勿忘农种业科学研究院有限公司,浙江杭州310020)
摘要:粒重是小麦Triticum aestivum产量构成的三大要素之一,是由多基因控制的数量性状,极易受环境因素的影响。国内外学者围绕粒重形成的遗传特征和分子调控机制进行了大量研究,也取得了一些研究进展。如何高效地利用前人的研究成果进行不断创新以提高小麦单产是育种工作者重要的研究课题。围绕小麦粒重形成的构成要素、遗传特征、QTLs(quantitative trait loci,QTLs)遗传定位、籽粒质量形成候选基因的克隆与分子调控机制解析等方面的最新研究展开综述;同时总结了以往研究过程中存在的问题,并结合自身研究对研究前景进行分析后指出:为了从分子水平上全面阐明小麦粒重形成的调控机制,后续研究首先应在小麦粒重形成的关键时期对籽粒激素的变化特征进行全面分析;其次要利用全基因组关联分析和高通量测序技术进一步开发与性状密切相关联的SNP标记(single nucleotide polymorphism,SNP);最后结合作图群体进行表型与SNP分析技术为基础的基因型关联性分析,对粒重形成候选主效基因进行精细定位、图位克隆和功能解析。表1参52
关键词:作物遗传育种;小麦;粒重;产量;分子调控;综述
小麦Triticum aestivum是重要的粮食作物。有效穗数、穗粒数以及粒重是小麦产量构成的三要素。在产量构成三要素中穗粒数的增加建立在小麦穗数减少的基础上。小麦粒重的增加是相对独立的;在产量三要素中粒重的遗传力最大,受环境的影响效应也最小[1-6]。因此,在穗数和穗粒数稳定的前提下,粒重的增加对小麦产量的提高有重要的作用。目前,围绕小麦粒重形成的外因(包括光照、温度、水分、二氧化碳和养分)和内因(包括生理生化机制和基因调控网络解析)开展了大量的研究,也取得一些进展。但由于普通栽培小麦是六倍体,与其他大农作物如玉米Zea mays,水稻Oryza sativa等二倍体作物相比,遗传相对比较复杂。因此,小麦粒重形成的分子调控机制研究相对滞后。本文从粒重的构成要素及遗传特征、粒重数量性状遗传位点(quantitative trait loci,QTLs)的遗传定位和基因克隆以及粒重形成的分子调控网络解析等方面开展综述,为科研人员的深入研究提供参考。
1 小麦粒重的构成要素及其遗传特征
小麦粒重是受多基因控制的数量性状,由粒长、粒宽、粒厚等基本要素构成[2-3]。利用不同的分析群体对构成粒重的3个基本要素与粒重的关联性进行了分析发现,小麦粒长、粒宽均与粒重都具有极显著的正相关关系,相关性大小依次为粒宽>粒厚>粒长[3-6·]。除此之外,研究人员对籽粒体积与粒重的关联性进行了分析。王瑞霞等[1]研究发现,相比于粒长、粒宽和粒厚,籽粒体积与小麦粒重相关性最高,这与BRESEGHELLO等[7]的研究结果相一致。可见,粒长、粒宽、粒厚、粒体积等都是粒重的重要构成要素。
2 小麦粒重QTLs的定位分析
2.1QTLs定位的群体
建立小麦粒重及其他性状基因的遗传连锁图谱,首先要构建合适的作图群体。目前,用于小麦基因遗传定位常用的作图群体包括两大类。第1类为暂时性群体,如F2群体、F2:3群体、回交(back cross,BC)及三交群体;第2类为永久性群体,如重组自交系(recombinant inbred line,RIL),加倍单倍体(doubled haploid,DH)及近等基因系(near isogenic lines,NILs)。针对不同的研究目标,研究人员使用不同的作图群体来对目标QTLs进行遗传定位。由于作图群体的差异以及影响粒重形成的因素太多,使得QTLs定位结果的可比性比较差。目前,已明确报道的与粒重形成相关的QTLs广泛分布在小麦的21条染色体上[2,4,7-20]。以色列Weizmann科学院FELDMAN教授的实验室花了近6 a时间培育了2套分别以普通小麦品种Bethlehem(BL)和中国春(Chinese Spring,CS)为背景的野生2粒小麦染色体臂置换系(chromosome arm substitution lines,CASLs)。创建时每个CASL都用对应的双端体与野生2粒小麦进行杂交,然后用对应的双端体经过6~7次回交,最后自交1次,每个世代结合细胞遗传学鉴定选育而成。每个CASL将野生2粒小麦单个染色体臂分别引入到同一栽培小麦的遗传背景中,这样可以对单个野生2粒小麦染色体臂上的基因进行独立研究,而避免其他染色体臂上基因的干扰,从而达到对某一数量性状进行独立研究的目的。利用该套材料与受体亲本(CS和BL)杂交所创建的F2群体比采用2个遗传背景差异很大的父母本杂交所创建的F2群体基因位点纯合率要高得多,但比不上NILs,因而基因定位结果的准确性介入普通F2群体和NILs之间。而利用此套材料所创建的小片段重组导入系(recombination substitution lines,RSLs)需要用相应的CASL与双端体(ditelosomic,DT)进行1次杂交和2次回交,期间结合分子标记对相应的染色体片段进行筛选,然后再自交3次RSLs才能完全创建完成。因而RSLs相应的数量性状基因位点的纯合率可以和NILs相提并论,而RSLs创建的难度要比NILs容易一些。作者实验室利用此套CASLs所创建的F2和RSLs已成功发现和定位了一个新的白粉病抗性基因到2B短臂上,并证实光周期基因Ppd-B1是2BS染色体臂上唯一的迟熟候选主效基因(论文待发表),证实利用此套CASLs材料所创建的作图群体对目标基因进行遗传定位的可靠性很高。目前,作者实验室正在利用此套CASLs所创建的F2和RSLs精细定位在3A,7BS和4AL染色体臂上且与小麦抽穗相关的主效QTLs。
2.2QTLs定位及互作效应
现阶段研究粒重基因的主要方法是QTL作图和关联性分析。在小麦产量构成的三要素中,粒重的遗传相对稳定且主要受遗传因子的控制;其遗传特性表现为加性效应,包括基因与基因的加性效应和基因与环境的加性效应,其遗传力为59%~80%。千粒重是衡量粒重的重要指标。目前,国内外研究者围绕粒重的构成要素包括粒长、粒宽和粒厚以及千粒重的QTLs定位工作展开了广泛的研究。利用不同的作图群体对粒重各构成要素的QTLs进行遗传定位发现,小麦3个基因组(A,B和D)的21条染色体上均分布着与粒重及其构成要素相关的QTLs(表1)。BRESEGHELLO等[7]和GEGAS等[5]研究小麦粒重各构成要素之间的关系时指出,控制小麦粒长和粒宽的遗传因子相对独立,分别由不同的主效QTL控制[5,7]。GEGAS等[5]和宿振起[21]研究粒形(粒长/粒宽)和千粒重的遗传相关性后发现,粒形与千粒重无显著的相关性,表明粒形和千粒重受独立的遗传体系所控制。因此,小麦粒重的主要构成要素遗传机制和互作效应机制的解析对主效基因的克隆与开发应用将具有重要指导意义。
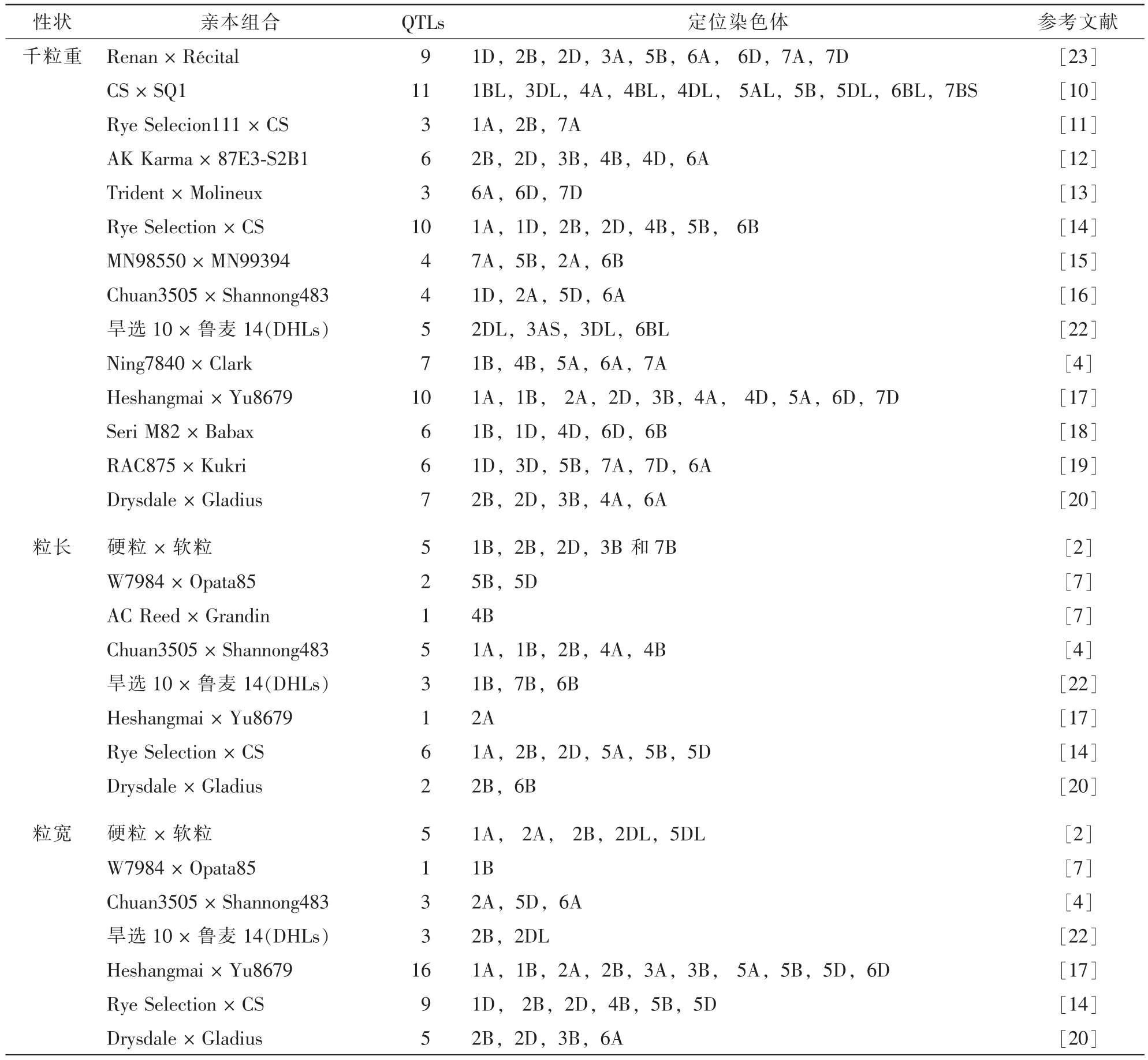
表1 粒长、粒宽和千粒重QTLs的遗传定位Table 1 Genetic location of QTLs involved in grain length, grain width and thousand kernel weight
粒重是由多基因控制的数量性状。定位分析研究表明小麦粒重QTLs的遗传定位极易受环境的影响;基因与环境的互作会导致QTLs在不同环境条件下表现很不稳定,使它在一些环境中能够检测到而在另外一种环境下又检测不到[21-23]。钱雪娅等[8]研究发现:小麦产量性状的遗传不仅受基因遗传效应所控制,还受上位效应、加性效应(包括基因之间以及基因与环境之间的加性效应)的影响。因此,在不同环境条件下对粒重各构成要素的QTLs进行遗传定位综合分析能够更好地分析主效QTLs之间的上位性、加性和互作效应,从而更加全面地分析粒重QTLs的遗传特征及其效应因子之间的作用特征。
3 小麦粒重形成的分子调控机制
3.1小麦粒重形成相关基因的克隆与功能解析
六倍体的普通小麦相比于二倍体的水稻、玉米等作物遗传相对比较复杂;因而目前在普通小麦中与粒重形成密切关联且被克隆并对功能进行完全解析的基因报道并不是很多。而在模式植物水稻中此类研究进展相对较快,这为小麦粒重形成分子调控途径机制解析提供了重要的参考。
目前,小麦粒重形成相关基因的克隆与功能解析主要围绕两大类基因展开。一类是淀粉合成代谢相关的基因;另一类是籽粒细胞发育和分化相关的基因。腺苷二磷酸葡萄糖焦磷酸化酶(AGPP),可溶性淀粉合成酶(SSS)和淀粉分支酶(SEB)是3个最早被证实控制籽粒淀粉的生物合成,且是与小麦粒重形成密切相关联的关键酶基因[24]。曹颖妮等[25]对小麦灌浆期淀粉积累及酶活性变化研究表明,AGPP,SSS 和SEB的酶活性最大峰值出现在小麦开花后20~25 d,且AGPP和SSS活性大小与直连淀粉含量呈正比,SEB活性大小与支链淀粉含量呈正比。蔗糖合酶基因(sucrose synthase,SUS)是另一被证实能在淀粉合成过程中起重要作用的关键基因。JIANG等[26]克隆了普通小麦第2连锁群上的蔗糖合酶基因TaSUS2,根据TaSUS2-2B位点上等位基因间的差异(Hap-H和Hap-L)开发了1个共显性标记,关联分析发现Hap-H与千粒重密切相关,推测其为小麦粒重形成的重要候选基因。腺苷二磷酸葡萄糖焦磷酸化酶(ADP-glucose pyrophosphorylase,AGPP)是控制植物体内蔗糖和淀粉合成的关键限速酶,催化葡萄糖-1-磷酸和ATP形成淀粉合成的直接底物。AGPP是由大小亚基组成的异源四聚体,其中β小亚基是催化亚基。已证实AGPP基因能调节胚乳细胞淀粉的合成;过表达AGPP基因的转基因水稻的籽粒饱满,千粒重显著增加。目前,已在普通小麦中克隆了AGPP各亚基的cDNA,其中β小亚编码的基因定位于染色体7A,7B和7D上,是一个单拷贝的基因位点。研究表明:开花后20~25 d小麦籽粒中AGPP酶活性最高,而胚乳中AGPP酶活性增强可以提高其淀粉含量[27]。
在小麦籽粒细胞发育和分化相关基因的功能研究中,常成等[6]结合水稻GS3(glutamine synthetase III,GS3)基因序列和小麦及其近缘种属EST序列,拼接形成了小麦GS3基因;其编码的氨基酸序列和水稻相似性很高,特别是基因的保守区域。利用万县百麦子和京411构建的小麦RILs对GS3基因与籽粒大小和粒重的关系进行连锁分析发现,GS3与小麦籽粒长度、宽度、粒厚及粒重等性状的相关性都达到显著水平。在水稻中已证实GS3主要通过调控籽粒纵向细胞的数量而影响粒长和粒重[28]。推测小麦的TaGS3基因的功能可能与水稻的具有相似的作用机制。
SU等[29]利用同源克隆技术在小麦中克隆得到了TaGW2(grain weight II,GW2)基因,将该基因定位于小麦染色体第六同源群上;并在TaGW2-6A基因的启动子区域发现了2个SNP位点。研究发现:其中1个SNP位点与籽粒的粒宽和粒重有显著的关联性,推测TaGW2基因启动子区域的突变可能会影响基因的表达进而对小麦粒重的形成产生影响。杨子博[30]通过对克隆的中国春和兰考大粒小麦TaGW2等位基因进行序列比对发现,兰考大粒小麦突变体的TaGW2基因在977 bp处有1个T碱基的插入使该基因翻译提前终止;对TaGW2基因编码的氨基酸序列的一级结构预测发现,其氨基酸残基61~103区域有1个GW蛋白典型的结构域,它可使TaGW2基因具有泛素连接酶的功能。水稻中的GW2基因调控粒宽的机制为GW2通过编码1种E3泛素连接酶参与泛素介导的蛋白降解,负向调控水稻籽粒颖壳细胞的数目而降低粒宽[28]。推测TaGW2基因在小麦中的功能可能与水稻GW2基因所起的功能相似,对小麦粒重的发育起负向调控作用。MA等[31]从普通小麦中克隆了细胞壁转化酶TaCWI(cell wall bound invertase,CWI)基因。此基因全长3 676 bp,含有7个外显子和6个内含子以及1个1 767 bp的开放读码框。根据TaCWI-A1位点的等位变异TaCWI-A1a和TaCWI-A1b开发了1对互补显性标记CWI22和CWI21。通过对2组中国冬小麦主栽品种和2组中国农家品种的检测,CWI22扩增的402 bp条带与高千粒重密切相关,而CWI21所扩增的404 bp条带与低千粒重密切相关。细胞壁结合转化酶(cell wall bound invertase,CWI)主要存在与细胞壁上或是在细胞间质中,对碳水化合物的转运中发挥着重要作用。在玉米中,CWI活性降低的突变体在早期籽粒形成阶段籽粒生长明显受到抑制,成熟时粒重只有正常籽粒的1/5[32];CWI缺失的突变体胚乳发育不良,胚乳细胞数目和大小均降低[33]。小麦TaCWI基因调控粒重形成的分子机制研究有待于更进一步地完善。
3.2小麦粒重形成的激素代谢及信号途径
植物内源激素主要包括生长素(indole-3-acetic acid,IAA),赤霉素(gibberellic acid,GA),细胞分裂素(cytokinin,CTK),脱落酸(abscisic Acid,ABA),乙烯(ethyne,ETH),异戊烯基腺苷(iso-propyl alcohol,iPA)等。内源激素在植物生长发育过程中发挥着重要的调控作用。研究表明:谷物籽粒灌浆速率和粒重大小主要由籽粒(库)激素的平衡和调节所控制[34]。小麦籽粒的形态建成和灌浆均存在内源激素的参与,在籽粒胚发育、淀粉合成关键酶、储藏蛋白的表达、植株衰老、碳/氮代谢等过程中激素平衡对小麦籽粒产量和品质的提高起重要的调节作用[35]。
IAA是影响小麦籽粒内溶物的重要激素。试验表明:内源IAA可以调控籽粒内溶物的转化效率;IAA对光合产物向籽粒的输入及其在籽粒中的转化都有明显的促进作用。研究表明:内源激素IAA的浓度同淀粉积累速度呈正相关关系;IAA通过调控蛋白酶的活性,加速蔗糖的分解速度从而增加小麦籽粒淀粉的积累[36]。赤霉素(GA)可促进小麦结实,在小麦灌浆期喷施赤霉素可以明显增加穗粒数,进而提高产量。WHEELER等[35]指出,在籽粒发育过程中内源IAA与GA的浓度随籽粒的发育而不断升高,与粒重的增长密切相关[20]。推测在小麦籽粒发育过程中GA和IAA起协同作用共同参与籽粒干物质的积累,从而促进粒重的形成。CTK通过调节胚乳细胞的分裂以及数目而影响小麦粒重。研究表明:受精后不久小麦CTK活性明显提高;在籽粒发育的初期CTK通过调节胚乳细胞储存能力从而影响籽粒灌浆及粒重。王丰等[36]研究表明:在高温情况下胚乳灌浆期ABA含量增加,使得胚乳细胞的灌浆速率明显加快。在小麦籽粒灌浆前期,内源ABA的含量对籽粒灌浆速度表现为促进作用,后期则起抑制作用[37]。外施ABA增加籽粒灌浆的速率,但是却缩短籽粒灌浆期的时间[38]。刘霞等[39]和高松洁等[40]对小麦灌浆期内源激素的变化研究发现,籽粒中GA3/ABA协同起作用能显著加快籽粒灌浆速度。研究发现:在小麦胚乳细胞分化的前期细胞内的iPA和ABA含量较高。较高的iPA水平一定程度上可以促进胚乳细胞的分化,从而增加籽粒的体积[23]。籽粒发育中期,伴随着灌浆速率的迅速升高,籽粒内iPA水平降低,同时GA,ABA和IAA的水平升高,由此可见GA,ABA,IAA和iPA在籽粒灌浆过程中起协同作用促进小麦籽粒灌浆[23]。乙烯是种子和果实成熟阶段释放的一种催熟剂,往往在植物生殖生长的后期大量释放而促进果实或是种子的成熟。研究发现:在小麦灌浆初期施加外源乙烯合成抑制剂能显著增加粒重[41],可能与籽粒中的蔗糖合成酶和淀粉合成相关酶活性的提高有关[42-43]。喷施乙烯可促进籽粒早灌浆,维持较长的灌浆高峰,但是籽粒灌浆速率减慢,粒重降低。乙烯的快速释放可以使ɑ-淀粉酶合成基因在营养器官中过量表达,从而使淀粉在储藏器官中的合成和积累量下降[44]。
4 存在问题与展望
目前,涉及小麦粒重形成分子调控关键基因的研究较少,缺乏本质性的认识。虽然通过QTL分析技术定位了一些控制籽重的位点,但很少进行克隆和功能的验证;对籽重形成的完整遗传机制并不清楚,关键调控基因还未见报道。基于此,可采取以下3条有效的途径加快小麦粒重形成分子调控机制的解析研究:①结合已公布的小麦遗传连锁图谱信息,利用全基因组关联分析(genome-wide association study,GWAS)技术进一步开发与性状密切相关联的单核苷酸多态性标记(single nucleotide polymorphism,SNP);结合作图群体进行表型与基因型的关联性分析,确定粒重形成候选主效基因,并进行克隆和功能解析。GWAS是一种基于连锁不平衡来识别分子标记之间或候选基因与性状之间关系的方法,已被广泛应用到植物遗传学和育种相关的重要性状研究中。目前,利用GWAS分析技术已在水稻中挖掘了与谷粒长度和宽度、顶端颜色、果皮颜色、淀粉酶含量、凝胶化温度等性状密切相关联的SNP位点[45];在玉米中多个与生育酚和α-生育酚含量相关联的SNP位点也被挖掘出来[46]。利用GWAS分析技术已在小麦中挖掘出多个与抽穗期、植株高度、淀粉和蛋白质含量、耐铝和抗锈蚀性等性状密切相关联的SNP位点,显示出此项技术在遗传定位目标候选基因以及分子辅助育种上的独特优势[47-48]。目前,关于小麦粒重形成关键基因的克隆与功能解析的研究报道甚少。因此,利用GWAS技术进一步挖掘与小麦粒重形成密切相关联的SNP标记,利用作图群体分析标记与表型变异的关联度,从而定位和克隆目标基因并加以利用可作为小麦粒重候选主效基因挖掘的主要手段。②结合高通量测序技术包括转录组RNA测序和蛋白组测序技术,通过分析近等基因系和亲本之间、渐渗系和亲本之间、高代回交个体和亲本之间显著差异表达的基因和蛋白,结合生物信息学分析预测小麦粒重形成的候选基因,探讨小麦粒重形成的分子调控机制。高通量转录组RNA和蛋白组测序技术可以在没有完整基因组序列的前提下,研究所有mRNA转录本和蛋白的丰度信息,发掘新的转录本和多肽,且可以得到定量更准确,分析更可靠、重复性更高及检测范围更广的结果[49]。目前,已在水稻[50]、拟南芥Arabidopsis thaliana[51]等模式植物中运用此项技术,通过分析转基因和非转基因单株之间、突变体和野生型单株之间显著差异表达的基因,挖掘目标基因以及目标基因的上下游调节基因的成功案列。因此,灵活运用高通量测序技术全面解析小麦粒重形成的分子调控机制是另一研究策略。③单子叶小麦粒重的发育与胚乳生长程度密切相关;粒重的大小同其3个主要构成要素的发育以及它们之间的协调发育都有密切的联系[52]。目前,植物粒重形成分子调控机制研究主要围绕模式植物如拟南芥[52]、水稻[21]展开,而小麦粒重形成的完整激素和分子调控机制的研究相对滞后。因此,在研究工作中只有从小麦粒重形成过程中的形态建成、灌浆、蜡黄、脱水等关键时期对其激素和分子调控机制进行分阶段解析,才能从整体上阐明小麦粒重形成的分子调控机制。
5 参考文献
[1]王瑞霞,张秀英,伍玲,等.不同生态环境下冬小麦籽粒大小相关性状的QTL分析[J].中国农业科学,2009,42(2):398 - 407.WANG Ruixia, ZHANG Xiuying, WU Ling, et al.QTL analysis of grain size and related traits in winter wheat under different ecological environments[J].Sci Agric Sin, 2009, 42(2): 398 - 407.
[2]CAMPBELL K G, BERGMEM C J, GUALBERTO D G, et al.Quantitative trait loci associated with kernel traits in a soft×hard wheat cross[J].Crop Sci, 1999, 39(6): 1184 - 1195.
[3]DHOLAKIA B B, AMMIRAJU J S S, SINGH H, et al.Molecular marker analysis of kernel size and shape in bread wheat[J].Plant Breed, 2003, 122(5): 392 - 395.
[4]SUN Xianyin, WU Ke, ZHAO Yan, et al.QTL analysis of kernel shape and weight using recombinant inbred lines in wheat[J].Sci Agric Sin, 2009, 165(3): 615 - 624.
[5]GEGAS V C, NAZARI A, GRIFFITHS S, et al.A genetic framework for grain size and shape variation in wheat[J].Plant Cell, 2010, 22(4): 1046 - 1056.
[6]常成,张海萍,张秀英,等.小麦PEBP-like基因等位变异与籽粒大小,粒重关系研究[J].分子植物育种,2009,7(1):23 - 37.CHANG Cheng, ZHANG Haiping, ZHANG Xiuying, et al.Study on relationship between allelic variation in PEBP-like gene and grain size and weight in common wheat[J].Mol Plant Breed, 2009, 7(1): 23 - 37.
[7]BRESEGHELLO F, SORRELLS M E.QTL analysis of kernel size and shape in two hexaploid wheat mapping population wheat[J].Field Crop Res, 2007, 101(2): 172 - 179.
[8]钱雪娅.不同水分条件下小麦重要农艺性状的遗传分析及QTL定位[D].杨凌:西北农林科技大学,2009:5 -10.QIAN Xueya.Genetic Dissection of Quantitative Loci for Important Agronomic Traits in Wheat under Tow Water Regimes[D].Yangling: Northwest A & F University, 2009: 5 - 10.
[9]QUARRIE S A, STEED A, CALESTANI C, et al.A high-density genetic map of hexaploid wheat(Triticum aestivum L.)from the cross Chinese Spring×SQ1 and its use to compare QTLs for grain yield across 110 arrange of environments[J].Theor Appl Genet, 2005, 110(5): 865 - 880.
[10]KUMAR N, KULWAL P L, GAUR A, et al.QTL analysis for grain weight in common wheat[J].Euphytica, 2006, 151(2): 135 - 144.
[11]HUANG Xueqin, CLOUTIER S, LYCAR L, et al.Molecular detection of QTLs for agronomic and quality traits in a doubled haploid population derived from two Canadian wheats(Triticum aestivum L.)[J].Theor Appl Genet, 2006, 113(4): 753 - 766.
[12]KUCHEL H, WILLIAMS K, LANGRIDGE P, et al.Genetic dissection of grain yield in bread wheat:ⅡQTL-by-environment interception[J].Theor Appl Genet, 2007, 115(7): 1015 - 1027.
[13]RAMYA P, CHAUBAL A, KULKARNI K, et al.QTL mapping of 1000-kernel weight, kernel length, and kernel width in bread wheat(Triticum aestivum L.)[J].J Appl Genet, 2010, 51(4): 421 - 429.
[14]TSILO T J, HARELAND G A, SIMSEK S, et al.Genome mapping of kernel characteristics in hard red spring wheat breeding lines[J].Theor Appl Genet, 2010, 121(4): 717 - 730.
[15]SUN Xiaochun, Felix Marza, MA Hongxiang, et al.Mapping quantitative trait loci for quality factors in an inter-class cross of US and Chinese wheat[J].Theor Appl Genet, 2010, 120(5): 1041 - 1051.
[16]WANG Ruiying, HAI Lin, ZHANG Xiuying, et al.QTL mapping for grain filling rate and yield-related traits in RILs of the Chinese winter wheat population Heshangmai3×Yu8679[J].Theor Appl Genet, 2009, 118(2): 313 - 325.
[17]MEINTYRE C L, MATHEWS K L, RATTEY A, et al.Molecular detection of genomic regions associated with grain yield and yield-related components in an elite bread wheat cross evaluated under irrigated and rainfed conditions [J].Theor Appl Genet, 2010, 120(3): 527 - 541.
[18]DION B, ALI I, MATTEW R, et al.Genetic dissection of grain yield and physical grain quality in bread wheat (Triticum aestivum L.)under water-limited environments[J].Theor Appl Genet, 2012, 125(2): 255 - 271.
[19]MAPHOSA L, LANGRIDGE P, TAYLOR H, et al.Genetic control of grain yield and grain physical characteristics in a bread wheat population grown under a range of environmental conditions[J].Theor Appl Genet, 2014, 127(7): 1607 - 1624.
[20]QIN Lin, HAO Chenyang, HOU Jian, et al.Homologous haplotypes, expression, genetic effects and geographic distribution of the wheat yield gene TaGW2[J].BMC Plant Biol, 2014, 14(1): 107.doi:10.1186/1471-2229-14-107.
[21]宿振起.小麦粒重基因TaGW2的克隆,标记的开发及功能验证[D].北京:中国农业科学院,2010:6 - 11.SU Zhenqi.Identification and Development of a Functional Marker of TaGW2 Associated with Grain Weight in Wheat(Triticum aestivum L.)[D].Beijing: Chinese Academy of Agricultural Sciences, 2010: 6 - 11.
[22]SCHUSSLER J R, BRENNER M L, BRUN W A.Relationship of endogenous abscisic acid to sucrose level and seed growth rate of soybeans[J].Plant Physiol, 1991, 96(4): 1308 - 1313.
[23]王瑞英,于振文,潘庆民,等.小麦籽粒发育过程中激素含量变化[J].作物学报,1999,25(2):227 - 231.WANG Ruiying, YU Zhenwen, PAN Qingmin, et al.Changes of endogenous plant hormone contents during grain development in wheat[J].Acta Agron Sin, 1999, 25(2): 227 - 231.
[24]SCHAFFER A A, PETREIKOV M.Sucrose-to-starch metabolism in tomato fruit undergoing transient starch accumulation[J].Plant Physiol, 1997, 113(3): 739 - 746.
[25]曹颖妮,胡卫国,王根平,等.糯性和非糯性小麦灌浆期胚乳直/支链淀粉积累及其相关酶活性研究[J].西北植物学报,2010,30(10):1995 - 2001.CAO Yingni, HU Weiguo, WANG Genping, et al.Dynamic changes of starch accumulation and enzymes relating to starch biosynthesis of kernel during grain filling in waxy and non-waxy winter wheat[J].Acta Bot Boreal-Occident Sin, 2010, 30(10): 1995 - 2001.
[26]JIANG Qiyan, HOU Jian, HAO Chenyang, et al.The wheat(T.aestivum)sucrose synthase 2 gene(TaSus2)active in endosperm development is associated with yield traits[J].Funct Integr Genom, 2011, 11(1): 49 - 61.
[27]SMIDANSKY E, MARTIN J, HANNAH C, et al.Seed yield and plant biomass increases in rice are conferred by deregulation of endosperm ADP-glucose pyrophosphorylase[J].Planta, 2003, 216(4): 656 - 664.
[28]SONG Xianjun, HUANG Wei, SHI Mei, et al.A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase[J].Nat Gen, 2007, 39(5): 623 - 630.
[29]SU Zhenqi, HAO Chenyang, WANG Lanfeng, et al.Identification and development of a functional marker of TaGW2 associated with kernel weight in bread wheat(Triticum aestivum L.)[J].Theor Appl Genet, 2011, 122(1): 211 -223.
[30]杨子博.小麦粒重基因TaGW2的克隆、原核表达及分子标记的开发[D].杨凌:西北农林科技大学,2012:7- 11.YANG Zibo.Cloning, Pokaryotic Expression and Maker Development for TaGW2, a Gene Linked to Wheat Kernel Weight[D].Yangling: Northwest A & F University, 2012: 7 - 11.
[31]MA Dongyun, YAN Jun, HE Zhonghu, et al.Characterization of a cell wall invertase gene TaCwi-A1 on common wheat chromosome 2A and development of functional markers[J].Mol Breed, 2012, 29(1): 43 - 52.
[32]MILLER M E, CHOUREY P S.The maize invertase-deficient miniature-1 seed mutation is associated with aberrant pedicel and endosperm development[J].Plant Cell, 1992, 4(3): 297 - 305.
[33]CHENG Wanhsing, TALIERCIO E W, CHOUREY P S.The miniature1 seed locus of maize encodes a cell wall invertase required for normal development of endosperm and maternal cells in the pedicel[J].Plant Cell, 1996, 8(6): 971 - 983.
[34]杨建昌,王志琴,朱庆森,等.ABA与GA对水稻籽粒灌浆的调控[J].作物学报,1999,25(3):341 - 347.YANG Jianchang, WANG Zhiqin, ZHU Qingsen, et al.Regulation of ABA and GA to the grain fil1ing of rice[J].Acta Agron Sin, 1999, 25(3): 341 - 347.
[35]HESS J, CARMAN J G, BANOWETZ G M.Hormones in wheat kernels during embryony[J].J Plant Physiol, 2002, 159(4): 379 - 386.
[36]刘仲齐,吴兆苏,俞世蓉.吲哚乙酸和脱落酸对小麦籽粒淀粉积累的影响[J].南京农业大学学报,1992,15 (l):7 - 12.LIU Zhongqi, WU Zhaosu, YU Shirong.Effects of IAA and ABA on starch accumulation in wheat grain[J].J Nanjing Agric Univ, 1992, 15(1): 7 - 12.
[37]柏新付,蔡永萍,聂凡.脱落酸与稻麦籽粒灌浆的关系[J].植物生理学通讯,1989,23(3):40 - 41.BAI Xinfu, CAI Yongping, NIE Fan.Relationship between absciaic acid and grain filling of rice and wheat[J].Plant Physiol Commun, 1989, 23(3): 40 - 41.
[38]李睿,兰盛银,徐珍秀.外源激素对小麦胚乳程序性细胞死亡和子粒灌浆的影响[J].湖北农业科学,2004,26(2):26 - 30.LI Rui, LAN Shengyin, XU Zhenxiu.The effect of exogenous hormones on the programmed cell death of endosperm and the grain filling in wheat[J].Hubei Agric Sci, 2004, 26(2): 26 - 30.
[39]刘霞,穆春华,尹燕枰,等.花后高温,弱光及其双重胁迫对小麦籽粒内源激素含量与增重进程的影响[J].作物学报,2007,33(4):677 - 681.LIU Xia, MU Chunhua, YIN Yanping, et al.Effects of high temperature and shading stress after anthesis on endogenous hormone contents and filling process in wheat grain[J].Acta Agron Sin, 2007, 33(4): 667 - 668.
[40]高松洁,王文静,夏国军,等.小麦大粒品种内源GA3及ABA含量的变化规律[J].河南农业大学学报,2000,34(3):213 - 219.GAO Songjie, WANG Wenjing, XIA Guojun, et al.The changing rules of content of inner GA3, ABA in big kernel wheat variety[J].J Henan Agric Univ, 2000, 34(3): 213 - 219.
[41]许振柱,于振文,亓新华,等.土壤干旱对冬小麦旗叶乙烯释放,多胺积累和细胞质膜的影响[J].植物生理学报,1995,21(3):295 - 301.XU Zhenzhu, YU Zhenwen, QI Xinhua, et al.Effect of soil drought on ethylene evolution, polyamine accumulation and cell membrane in flag leaf of winter wheat[J].Acta Phytophysiol Sin, 1995, 21(3): 295 - 301.
[42]MOHAPATRA P K, NAIK P K, PATEL R.Ethylene inhibitors improve dry matter partitioning and development of late flowering spikelets on rice panicles[J].Aust J Plant Physiol, 2000, 27(4): 311 - 323.
[43]NAIK P K, MOHAPATRA P K.Ethylene inhibitors enhanced sucrose synthase activity and promoted grain filling of basal rice kernels[J].Aust J Plant Physiol, 2000, 27(11): 997 - 1008.
[44]ROOK F, CORKE F, CARD R, et al.Impaired sucrose-induction mutants reveal the modulation of sugar-induced starch biosynthetic gene expression by abscisic acid signaling[J].Plant J, 2001, 26(4): 421 - 433.
[45]HUANG Xuehui, WEI Xinghua, SANG Tao, et al.Genome-wide association studies of 14 agronomic traits in rice landraces[J].Nat Genet, 2010, 42(11): 961 - 967.
[46]LI Qing, YANG Xiaohong, XU Shutu, et al.Genome-wide association studies identified three independent polymorphisms associated with α-tocopherol content in maize kernels[J].PLoS ONE, 2012, 7(5): e36807.doi: 10.1371/journal.pone.0036807.
[47]RAMAN H, STODART B, RYAN PR, et al.Genome-wide association analyses of common wheat(Triticum aestivum L.)germplasm identifies multiple loci for aluminum resistance[J].Genome, 2010, 53(11): 957 - 966.
[48]YU Longxi , MORGOUNOV A, WANYERA R, et al.Identification of Ug99 stem rust resistance loci in winter wheat germplasm using genome-wide association analysis[J].Theor Appl Genet, 2012, 125(4): 749 - 758.
[49]WANG Zhong, GERSTEIN M, SNYDER M.RNA-Seq: a revolutionary tool for transcriptomics[J].Nat Rev Genet, 2009, 10(1): 57 - 63.
[50]GAO Yi, XU Hong , SHEN Yanyue, et al.Transcriptomic analysis of rice(Oryza sativa)endosperm using the RNASeq technique[J].Plant Mol Biol, 2013, 81(4/5): 363 - 378.
[51]NIEDERHUTH C E, PATHARKAR O R, WALKER J C.Transcriptional profiling of the Arabidopsis abscission mutant hae hsl2 by RNA-Seq[J].BMC Genomics, 2013, 14(1): 37.doi: 10.1186/1471-2164-14-37.
[52]SUNDARESAN V.Control of seed size in plants[J].Proc Nat Acad Sci USA, 2005, 102(50): 17887 - 17888.
《浙江农林大学学报》获2014年度“中国科技论文在线优秀期刊”一等奖
从教育部教技发中心函[2015]162号文获悉,《浙江农林大学学报》获2014年度“中国科技论文在线优秀期刊”一等奖。
为了更好地贯彻落实十八大提出的创新驱动发展战略,促进科技期刊健康发展,提高科技期刊的质量,推动科技期刊的数字化建设,提高期刊刊载论文的引用率,扩大期刊的影响力,促进论文免费共享,建设良好的科研环境,使科技期刊更好地为科研和科研工作者服务,教育部科技发展中心对截至2014年12月31日已收录在“中国科技论文在线”“科技期刊”栏目的教育部主管的期刊,经过严格的评审,评选出“中国科技论文在线优秀期刊”一等奖111项,二等奖183项;评选出“中国科技论文在线科技期刊优秀组织单位”64个。《浙江农林大学学报》荣获一等奖。
《浙江农林大学学报》坚持阵地和质量意识,始终以促进文化繁荣,引领学术进步,推进技术创新,构建社会和谐为己任,在互联网+的新形势下,奋力前行,不断超越,综合质量和学术声誉不断提高。2015年以来,《浙江农林大学学报》连续第7次入选《中文核心期刊要目总览》(2014版)、入选RCCSE中国核心学术期刊和中国科学引文数据库核心库等。
《浙江农林大学学报》将再接再厉,创新、协调、绿色、开放、共享,贯彻“绿水青山就是金山银山”重要思想,坚持立德树人,更好地为社会、经济、科技和学校发展服务。
吴伟根
Research progress on molecular regulation mechanism of grain weight formation in wheat
WEI Wei1, GUO Jialian1, WAN Lintao2, XU Linfeng3, DING Mingquan1, ZHOU Wei1
(1.The Key Laboratory for Quality Improvement of Agricultural Products of Zhejiang Province, School of Agriculture and Food Science, Zhejiang A & F University, Lin’an 311300, Zhejiang, China; 2.The Crop Technical Extension Station of Kaihua County, Kaihua 324300, Zhejiang, China; 3.Zhejiang Wuwangnong Seeds Science Research Institute Co., Ltd., Hangzhou 310020, Zhejiang, China)
Abstract:Grain weight(GW), a quantitative trait determined by several genes, is one of three key wheat yield components and is sensitive to environmental variation.Researchers at home and abroad have done many studies on the genetic traits and molecular regulation mechanism of GW formation, and have made some research progress.How to make innovations to improve unit yield of wheat based on the existing research is an important work for the researchers.In this study, the latest research progresses on components, genetic traits, genetic mapping of QTLs(quantitative trait loci, QTLs), candidate gene cloning and molecular regulation of GW in wheat were reviewed, and then the problems of existing research and the future research direction involved in our recent research were also sorted out and discussed.In order to get a comprehensive knowledge about the molecular mechanism on the production of GW, researchers should pay more attention to three key items.First-book=349,ebook=170ly, the variation of hormone in the development of GW should be concerned and measured.Secondly, GWAS (genome-wide association study, GWAS)together with high throughput sequencing should be adopted to exploit SNP(single nucleotide polymorphism, SNP)markets conferring to some special agricultural trait.Finally, the candidate gene should be mapped based on SNP marker-assisted selection in the mapping population, and then the candidate genes should be cloned and their function in the regulatory network involved in the formation of GW should be covered.This work will provide a good reference for further research.[Ch, 1 tab.52 ref.]
Key words:crop genetics and breeding; wheat; grain weight; yield; molecular regulation; review
作者简介:魏玮,从事植物分子遗传研究。E-mail:1187374847@qq.com。通信作者:周伟,副教授,博士,从事植物分子遗传与种质资源创新研究。E-mail:zhouwei19810501@163.com
基金项目:国家自然科学基金资助项目(31201208);2014年度浙江省科技创新活动计划(新苗人才计划)项目(2014R412048);浙江省旱粮农业新品种选育重大科技专项(2012C12902-2-6);浙江省科技创新团队项目(2011R50026-23);浙江农林大学人才启动基金项目(2012FR028,2010FK040)
收稿日期:2015-06-11;修回日期:2015-08-30
doi:10.11833/j.issn.2095-0756.2016.02.022
中图分类号:S512.1
文献标志码:A
文章编号:2095-0756(2016)02-0348-09
