新型硅基固载材料的制备及固定化酶性能
2016-04-27傅小萍姚珊珊浙江农林大学理学院浙江临安311300
傅小萍,姚珊珊,王 莹,郭 明(浙江农林大学理学院,浙江临安311300)
新型硅基固载材料的制备及固定化酶性能
傅小萍,姚珊珊,王莹,郭明
(浙江农林大学理学院,浙江临安311300)
摘要:利用溶胶-凝胶原理,以正硅酸乙酯(TEOS)为原料,3-缩水甘油醚氧丙基三甲氧基硅烷(KH-560)为偶联剂,在酸性条件下发生缩合反应制备新型基质材料,通过红外光谱(FT-IR),固体核磁共振波谱(CP/MAS(13)C NMR)和X-射线衍射(XRD)对基质载体进行结构表征。通过交联-包埋固定化法制备新型纤维素固载酶,分析研究了固载酶及游离酶酶解不同微观尺度纤维素基质的酶学性能。结果表明:固载酶进行酶促反应的最优pH 4.0,最优温度为60℃,表明固载酶的热稳定性优于游离酶;测得固载酶的米氏常数与游离酶无显著差异;固定化纤维素酶的重复使用性和储存稳定性较游离酶均有较大改善。有关研究可为制备性能优良的固载酶提供一定借鉴。图9表2参20
关键词:纤维素酶;交联-包埋;固定化;催化性能
酶是一类具有高效催化能力的生物活性物质,生命活动中许多复杂而有规律的物质和能量变化均离不开酶的催化作用。其中,纤维素酶是一类能够将纤维素降解为葡萄糖的多组分酶系的总称,现已确定的主要组分为内切型葡聚糖苷酶、外切型葡萄糖苷酶和纤维二糖酶,它们协同作用,最终水解产物为葡萄糖。纤维素酶主要来源于细菌和放线菌等微生物,原生动物、软体动物,昆虫和植物的一些组织也能产生纤维素酶[1]。纤维素类物质是地球上产量巨大却又未得到充分利用的可再生资源。地球上植物光合作用可产生大于100亿t·a-1的植物干物质,其中一半以上是纤维素和半纤维素,合理利用纤维素可为社会的可持续发展做出贡献[2]。由于纤维素的充分利用与纤维素酶息息相关,使纤维素酶在生活中的许多领域都有广泛的应用,如织物整理[3]、蔬菜汁加工[4]、废纸脱墨[5]等,可创造巨大的经济效益和社会效益,但游离纤维素酶不易与底物分离,存在重复利用性和储藏稳定性差等缺点,大大增加了生产成本,因此,采用新技术新方法对纤维素酶进行改性十分重要。其中人们为了提高纤维素酶的重复利用性和储藏稳定性,常常制成各种固定化纤维素酶。酶的固定化是用物理或化学方法处理水溶性酶,使之不溶于水或固定于固相载体的一种技术,极大地拓宽了酶的应用范围,成为当前研究的热点领域。固载材料的制备是获得性能优越的固载酶的一个关键步骤。为了克服酶对热、酸、碱等因素的不稳定性,提高酶的催化活性,人们对酶的固定化进行了广泛深入的研究,制备出许多新的固定化材料[6-8]。相比较而言,无机载体比有机载体更耐生物降解,有更高的热稳定性且价格更低。本工作在前人研究的基础上,分析比较现有固载材料和方法[9-10],通过正硅酸乙酯(TEOS)的酸性水解产物和偶联剂3-缩水甘油醚氧丙基三甲氧基硅烷(KH-560)的缩合反应合成新型基质载体,并用红外光谱分析固体核磁谱(13C NMR)分析和X-射线衍射分析对基质载体进行结构表征;通过交联-包埋方法[11-12]制备新型纤维素固载酶,测定固载酶不同微观尺度纤维素基质的酶学性能。实验结果表明,所制备的纤维素固载酶除保持了酶的高效、专一、温和及活性可调控等催化特性外,热稳定性也有较大幅度提高,并且具有易分离回收、可重复使用、储存稳定性好等诸多优点,对实现纤维素酶的高效利用具有较好的借鉴意义。
1 实验部分
1.1试剂与仪器
正硅酸乙酯(CP化学纯,≥28.0%,江苏强盛功能化学股份有限公司);乙醇(AR分析纯,≥99.7%,国药集团化学试剂有限公司);乙酸(AR分析纯,≥99.5%,永华化学科技有限公司);3-缩水甘油醚氧丙基三甲氧基硅烷(97.0%,上海晶纯生化科技股份有限公司);羧甲基纤维素钠(CP化学纯,国药集团化学试剂有限公司);纳米纤维素溶液(湿)质量分数为0.6 %,实验室自制);纤维素酶(16.67×10-5kat· g-1,上海晶纯生化科技股份有限公司);3,5-二硝基水杨酸(CP化学纯,≥98.0%,国药集团化学试剂有限公司);氢氧化钠(AR分析纯,≥96.0%,西陇化工股份有限公司);酒石酸钾钠(AR分析纯,≥99.0%,天津市永大化学试剂有限公司);苯酚(AR分析纯,天津市永大化学试剂有限公司);无水硫酸钠(AR分析纯,99.0%,浙江三鹰化学试剂有限公司);实验用水为双蒸水。集热式恒温加热磁力搅拌器(DF-101S型,中国巩义市予华仪器有限责任公司);电热恒温鼓风干燥箱(DHG-9123A型,中国上海一恒科学仪器有限公司);循环水式多用真空泵(SHZ-C型,中国巩义市予华仪器有限责任公司);Zeta电位及粒度分析仪(90Plus Zeta型,美国Brookhaven公司);傅里叶变换红外光谱仪(IR Prestige-21型,日本Shimadzu公司);X-射线衍射仪(XRD-6000型,日本Shimadzu公司);核磁共振波谱仪(AVANCE II 400MHz型,瑞士Bruker公司);紫外可见分光光度计(T6系列型,中国北京普析通用仪器有限责任公司)。
1.2硅基质载体材料的合成[13-15]
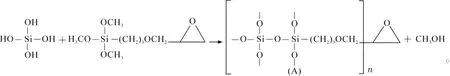
25.0mL正硅酸乙酯(TEOS)溶解在50.0 mL乙醇中,40℃恒温加热搅拌5 min,加入50.0 mL水继续搅拌10 min,加入乙酸调节酸碱度至pH 2~3,升温至80℃,搅拌1 h;加入5.0 mL偶联剂3-缩水甘油醚氧丙基三甲氧基硅烷(KH-560),搅拌4 h;烘箱100℃烘15 h至干燥;用水淋洗基质载体数次,再用乙醇淋洗数次,然后烘箱70℃烘4 h至完全干燥,得到白色固体颗粒,再用研钵研磨,得到白色粉末状环氧化二氧化硅基质载体。基质载体合成的方程式如下:

以乙醇为溶剂,在乙酸催化作用下,使正硅酸乙酯(TEOS)水解,得到水解产物。
以KH-560为偶联剂,与前述步骤中得到的水解产物进行缩合反应,制备含高活性基团的环氧化二氧化硅基质载体,该基质载体为稳定固体状凝胶。
1.3环氧化二氧化硅基质载体的结构表征
红外光谱(FT-IR)分析:采用傅里叶变换红外光谱仪,溴化钾(KBr)压片制样,扫描波数范围为4 000~500 cm-1。
13C NMR固体核磁谱分析:采用核磁共振波谱仪测定产物的固体核磁CP/MAS13C NMR谱,观测频率75.0 MHz,魔角自旋速度3.8 MHz,分辨率4.88 Hz;内参考物:氨基乙酸。
X-射线衍射分析:采用X-射线衍射仪分析样品结晶度。扫描方式:定性,步进扫描;扫描速度:10°·min-1;扫描范围为2θ:10°~50°;步长:0.02°;电压/电流:35 kV/30 mA;Cu2+靶。
1.4纤维素固载酶的制备
准确称取1.5 g环氧化二氧化硅基质载体,加入25.0 mL pH 5.0的1.0 g·L-1纤维素酶的磷酸氢二钠-柠檬酸缓冲液,室温下浸渍2 h,过滤,获得固载酶,用pH 5.0的磷酸氢二钠-柠檬酸缓冲液淋洗固载酶数次,除去固载酶表面的游离酶。
固定化酶制备过程如下:
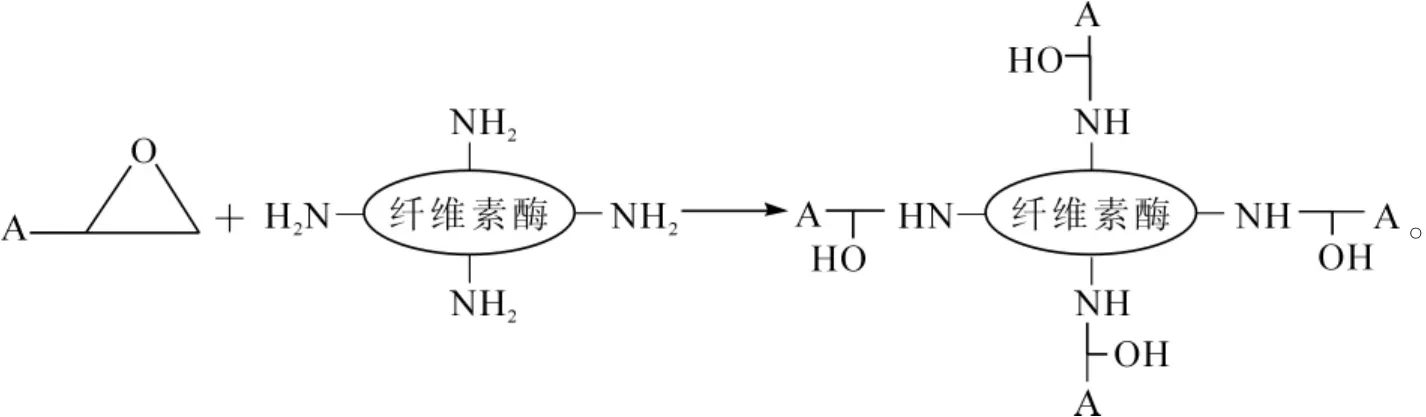
高温烘干凝胶并淋洗,再次烘干研磨后为白色粉末状。取基质载体与纤维素酶溶液反应,环氧化二氧化硅基质载体上的环氧基与纤维素酶上的氨基发生共价键联,实现纤维素酶的固定。
1.5纳米纤维溶液制备
根据文献[16],按照m(纳米纤维)∶m(溶剂)=1∶50,将纳米纤维溶解在9.0 moL·L-1的硫氰酸锂(LiSCN)溶液中,搅拌溶解过滤,去离子水透析3 d后,再将所得溶液配制成质量分数为0.6%的纳米纤维溶液。
1.6纳米纤维溶液表征
Zeta电位和粒度分析,Zeta电位是表征颗粒分散系稳定性的重要指标[17],因此,纳米纤维溶液的Zeta电位也是表征纳米纤维能否在溶液中稳定存在及粒径大小的重要指标。将所得质量分数为0.6%纳米纤维溶液配成0.06 g·mL-1水溶液,采用90 Plus Zeta型Zeta电位及粒度分析仪测试样品的粒径及Zeta电位。
1.7酶学性能测定
1.7.1 pH值和温度对纤维素酶活性的影响取0.5 g固载酶和游离酶在40℃,pH 3.0~8.0条件下,分别与2.0 mL 6.0 g·L-1的羧甲基纤维素钠(CMC)溶液和纳米纤维素(NCC)溶液进行酶促反应,反应20 min,采用滤纸酶活(FPA)测定酶活[18],考察pH值对酶活性的影响。将固载酶和游离酶在40~80℃温度范围内和pH 5.0条件下,分别与2.0 mL 6.0 g·L-1CMC溶液和NCC溶液进行酶促反应,反应20 min,测定酶活,考察温度对酶活性的影响。
1.7.2纤维素酶的重复利用性和储藏稳定性的测定将纤维素固载酶和纤维素游离酶分别与2.0 mL 6.0 g·L-1CMC溶液和NCC溶液在40℃,pH 5.0的条件下,反应20 min,重复反应6次,测定酶活,考察酶的重复利用性。将纤维素固载酶和纤维素游离酶储存在4℃冰箱内,隔7 d取定量0.5 g的固定化酶和游离酶在40℃,pH 5.0条件下,分别与2.0 mL 6.0 g·L-1羧甲基纤维素钠(CMC)溶液和纳米纤维素(NCC)进行酶促反应,测定酶活,考察酶的储藏稳定性。
1.7.3纤维素酶的米氏常数的测定将固载酶与纤维素游离酶分别与1.0,2.0,3.0,4.0,5.0,6.0 g·L-1的CMC溶液和NCC溶液进行反应,20 min后,分别在之后的第2,5,8,11,14,17,20 min条件下测定酶活,以反应速率的倒数对底物浓度的倒数作图,经线性拟合得出米氏方程和米氏常数Km值[19]。
2 实验结果与讨论
2.1新型固载材料的表征
基质载体的红外光谱(FT-IR)分析结果如图1所示。由图1可见:中间产物二氧化硅和基质载体在3 650 cm-1处都有—OH的特征吸收峰;在1 110和1 100 cm-1处出现的特征吸收峰较宽,是由Si—O和C—O键特征吸收峰的重叠造成的;在798和800 cm-1处为环氧基的特征吸收峰;在2 940 cm-1处,中间产物无—CH2—的特征吸收峰,基质载体有该特征吸收峰,说明中间产物二氧化硅和偶联剂KH-560实现了共价键联,从对IR的分析,可以初步判断基质载体合成成功。

图1 中间产物二氧化硅和基质载体的IR谱Figure 1 IR spectra of the intermediate and the carrier
基质载体的13C NMR固体核磁谱分析结果如图2所示。由图2可知:在0~50 mg·L-1间存在强度约为1∶2∶1的13C信号峰,说明合成的基质载体含有R—CH2—R结构,在50~80 mg·L-1存在13C信号峰,说明了基质载体中C—O的存在,与目标基质载体环氧化二氧化硅结构相符,说明基质载体合成成功。

图2 基质载体的CP/MAS13CNMR谱Figure 2 CP /MAS13C-NMR spectroscopy of intermediates and the carrier
基质载体的X-射线衍射(XRD)分析结果如图3所示。
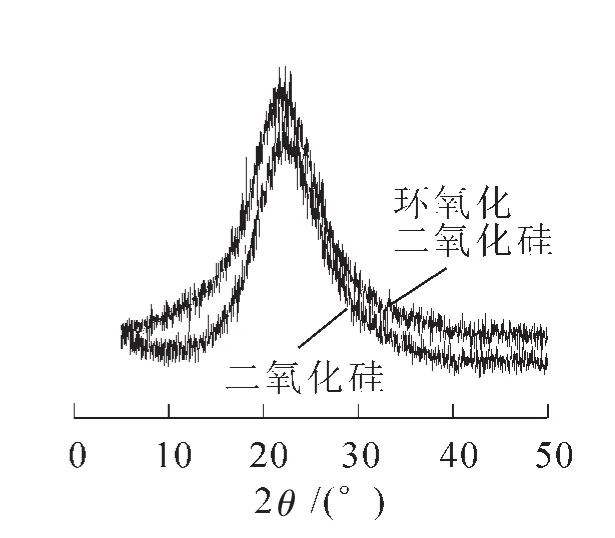
图3 中间产物及基质载体的X-射线衍射图谱Figure 3 X-ray diffraction spectra of intermediates and the carrier
由图3数据,结晶度按式(1)计算,数据列于表1。


表1 基质载体的结晶度Table 1 Degree of crystallinity of intermediate and the carrier
式(1)中:Xc为结晶度,Sc为X-射线衍射图谱中结晶区部分面积,k为校正因子,Sa为X-射线衍射图谱中非结晶区部分面积。
由图3可知:缩合反应前后峰的形状没有发生太大变化,中间产物的结晶度为46.30%,基质载体的结晶度43.54%,仅略有减小,说明偶联剂KH-560的加入对中间产物二氧化硅试样的结构并无太大影响。综合分析表明,成功合成获得了新型硅基载体材料。
2.2固载酶及游离酶酶解不同微观尺度下的纤维素基质性能
2.2.1自制纳米纤维粒径的测定自制纳米纤维素粒子数量与粒径的分布关系如图4所示。由图4可知:纳米纤维素的粒径分布在105 nm取得最大值,纳米纤维素的平均粒径接近纳米尺寸,粒径较小。
2.2.2 Zeta电位的测定一般文献认为[20],对于非纳米粒子,Zeta电位绝对值在30 mV以上的稳定性较好,但是由于纳米粒子的粒径较小,单个粒子表面提供电荷的官能团的数量较少,可能会引起所测得的Zeta电位绝对值偏低。本工作由Zeta电位仪测得所制备的纳米纤维素的Zeta电位为-29.72 mV,可认为稳定性较好。

图4 数量-粒径分布关系图Figure 4 Graph of relationship between number and the particle size distribution
2.2.3固定化酶最适pH值的范围将纤维素固载酶和游离酶在pH 3.0~8.0的范围内与分别与CMC溶液和NCC溶液反应,测定固载酶和游离酶的活性,结果见图5。由图5可知:无论底物是CMC溶液,还是NCC溶液,固载酶的最适pH值都为pH 4.0,游离酶的最适pH值都为pH 5.0。CMC与2种形态酶的反应程度都较NCC高,可能原因为自制纳米纤维溶液溶质粒径虽达到纳米级要求,但是颗粒大小不均匀,因此,底物为CMC时的酶促反应效果较底物为NCC时好。

图5 pH对酶活性的影响Figure 5 Effect of pH value on the enzymatic activity
2.2.4固定化酶最适温度的范围将纤维素固载酶和游离酶在40~80℃的范围内和pH 5.0的条件下,分别与CMC溶液和NCC溶液反应,测定固载酶和游离酶的活性,结果如图6所示。由图6可知:无论底物是CMC溶液,还是NCC溶液,固载酶的最适温度都为60℃,游离酶的最适温度都为50℃,说明固载酶较游离酶有更好的热稳定性。这是因为纤维素固载酶的接枝长链对纤维素酶具有一定的包埋作用,使固载酶的刚性增加,必须升高温度增加柔性,才能和底物分子结合。
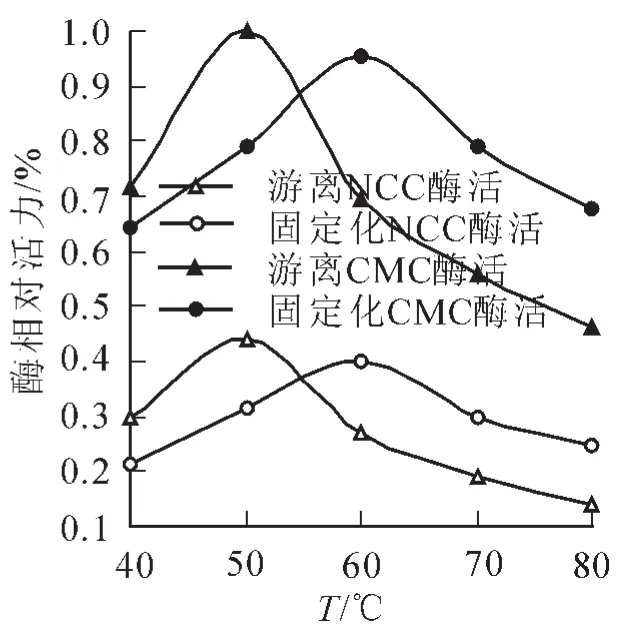
图6 温度对酶活性的影响Figure 6 Effect of tempertature on the enzymatic activity
2.2.5固定化酶的重复使用性将固载酶和游离酶在pH 5.0和40℃条件下与CMC溶液与NCC溶液反应,测定固载酶和游离酶的活性。重新装入底物溶液,再次反应后测定酶活性,如此反复操作6次,结果见图7。由图7可知:经过6次反应后,固载酶对于底物CMC溶液的酶活性高于NCC溶液,表明固载酶对于CMC溶液有更好的重复利用性。酶活性逐步下降的可能原因为底物逐步进入基质载体的孔道,与固载酶发生作用或部分以游离形态被束缚在基质载体中的酶随反应进行逐步与基质载体脱离从而与底物发生作用,使得酶不断被消耗数量减少,表现为活性降低。
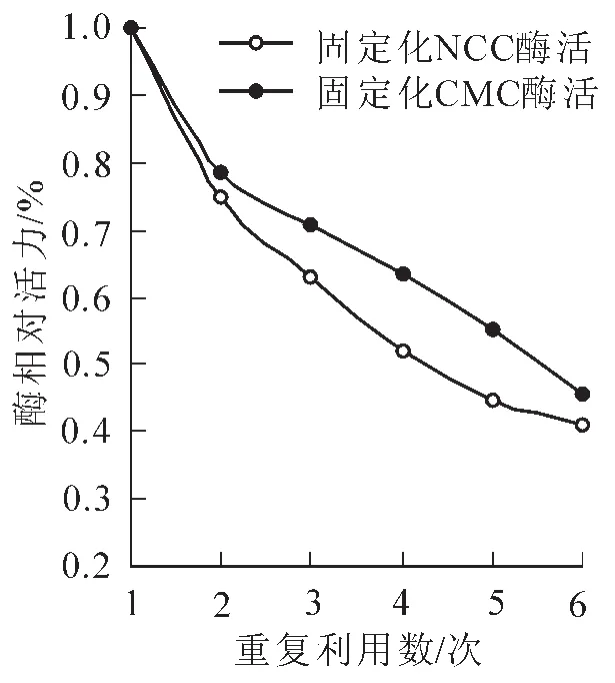
图7 酶的重复利用性Figure 7 Reusability of cellulase
2.2.6纤维素酶的储藏稳定性将固载酶和游离酶储存于4℃的冰箱内,隔7 d,测定1次酶活,连测28 d,结果见图8。由图8可知:28 d后,无论底物是CMC溶液,还是NCC溶液,固载酶的酶活性都高于游离酶,说明固载酶较游离酶有更好的储藏稳定性。这是因为酶与基质载体结合生成固载酶以后结构更加稳定,抵抗外界环境对酶活的影响。

图8 酶的储藏稳定性Figure 8 Storage stability of cellulase
2.2.7纤维素酶米氏常数的测定在温度、pH值及酶浓度恒定的条件下,底物浓度对酶促反应速度有很大的影响。底物浓度很低时,酶促反应的速度随底物浓度的增加迅速增加,随反应底物浓度继续增加,反应速度的增加开始减慢,当底物浓度增加到一定值时,反应速度达到最大极限。底物浓度[S]与酶反应速率v间的定量关系由米氏方程给出:


用酶反应速率的倒数对底物浓度的倒数作图,经线性拟合,结果列于图9和表2。结果表明:固载酶与CMC溶液和NCC溶液作用的米氏常数分别为1.58 g·L-1和2.36 g·L-1;游离酶与CMC溶液和NCC溶液作用的米氏常数分别为1.40 g·L-1和2.12 g·L-1,表明固载酶与底物的亲和力较游离酶有所减小,可能原
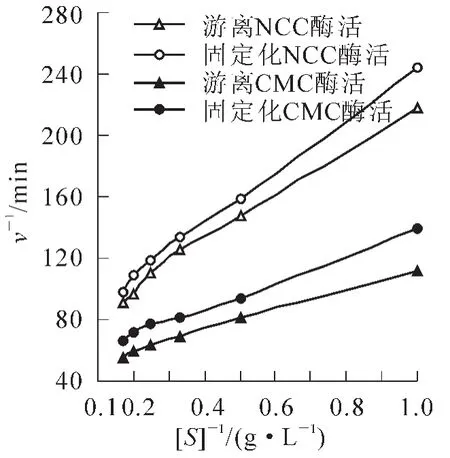
图9 Lieweaver-Burk曲线Figure 9 Lieweaver-Burk curves
式(2)中:v为反应初速率,V为最大反应速率,[S]为底物浓度,Km为米氏常数,Km值等于酶促反应速度达到最大反应速度一半时所对应的底物浓度。Km是酶的特性常数之一,它包含着酶与底物结合和解离的性质,不同的酶Km值不同,同一种酶与不同底物反应Km值也不同。Km值可近似地反映酶与底物的亲和力大小:Km值大,表明亲和力小;Km值小,表明亲和力大。米氏方程两边同时取倒数,得到:因为固载酶由于基质载体的阻碍作用,减少了酶与底物的接触面积,使得相较游离酶亲和力有所减小。2种形态的纤维素酶对CMC的亲和力比对NCC的亲和力强,可能原因为自制纳米纤维溶液溶质粒径虽达到纳米级要求,但由于NCC颗粒大小的不均匀性,使得较底物为CMC时酶促效果稍差,表现为亲和力有所减小。

表2 游离酶与固定化酶的米氏常数Table 2 Kmvalue of free and immobilized cellulose
3 结论
自制纤维素溶液的粒径分布在105 nm左右,接近纳米纤维素级别;Zeta电位为-29.72 mV,说明纳米纤维素溶液稳定性较好。将所制备的纤维素固载酶的酶学性能与纤维素游离酶相比较的结果表明:无论底物是羧甲基纤维素钠,还是纳米纤维素,此固载酶进行酶促反应的最优pH值都为pH 4.0左右,最优温度都为60℃,比游离酶提高10℃,表明固载酶的热稳定性优于游离酶。此外,固载酶的重复利用性和储藏稳定性与游离酶相比都有较大的提高。测得固载酶的米氏常数比游离酶稍大,表明其与底物的亲和力与游离酶相比有所减小。
4 参考文献
[1]DONG Zeyuan, ZHU Junyan, LUO Quan, et al.Understanding enzyme catalysis by means of supramolecular artificial enzymes[J].Sci China Chem, 2013, 56(8): 1067 - 1074.
[2]CARPITA N C.Update on mechanisms of plant cell wall biosynthesis: how plants make cellulose and other(1,4)-β-D-glycans[J].Plant Physiol, 2011, 155(1): 171 - 184.
[3]周秀梅,夏黎明.纤维素酶在织物整理中的应用[J].纺织学报,2004,25(3):114 - 115.ZHOU Xiumei, XIA Liming.The application of cellulase in bio-finishing of cellulosic fabrics[J].J Text Res, 2004, 25 (3): 114 - 115.
[4]任大明,陈祖洁.纤维素酶在蔬菜汁加工中的应用研究[J].沈阳农业大学学报,1994,25(1):79 - 82.REN Daming, CHEN Zujie.The application of cellulase in vegetable juice processing[J].J Shenyang Agric Univ, 1994, 25(1): 79 - 82.
[5]汪顺才,肖宝清,张强.纤维素酶在废纸脱墨中的应用[J].中国矿山工程,2005,34(2):38 - 41.WANG Shuncai, XIAO Baoqing, ZHANG Qiang.Application of cellulase in waste paper deinking[J].China Mine Eng, 2005, 34(2): 38 - 41.
[6]李存存,张光亚.酶定向固定化方法及应用的研究进展[J].化工进展,2013,32(10):2467 - 2474.LI Cuncun, ZHANG Guangya.Research progress of site-specific immobilization of enzymes and application[J].Chem Ind Eng Progr,2013,32(10):2467 - 2474.
[7]闵丹丹,何文,杜晓永,等.酶固定化无机载体材料的研究进展[J].山东陶瓷,2011,34(5):11 - 16.MIN Dandan, HE Wen, DU Xiaoyong, et al.Research progress of inorganic materials used as enzyme immobilization carrier[J].Shandong Ceram,2011,34(5):11 - 16.
[8]张蕾蕾,王固宁,朱遂一,等.酶固化技术最新研究进展[J].现代生物医学进展,2011,11(22):4386 -4397.ZHANG Leilei, WANG Guning, ZHU Suiyi, et al.Recent advancement of enzyme immobilized technology[J].Progr Mod Biomed,2011,11(22):4386 - 4397.
[9]崔少伟,唐正华,葛建芳.正硅酸乙酯溶胶-凝胶制备壳聚糖-SiO2杂化材料[J].中北大学学报,2012,33(3):313 - 319.CUI Shaowei, TANG Zhenghua, GE Jianfang.Preparation of chitosan-SiO2hybrid composite material via tetraethy loxy silane sol-gel process[J].J North Univ China, 2012, 33(3): 313 - 319.
[10]廖明霞,李晔,杨惠,等.包埋生物分子的SiO2载体材料的研究进展[J].有机硅材料,2009,23(4):265 -268.LIAO Mingxia, LI Ye, YANG Hui, et al.Research on SiO2carrier for entrapment of biomolecules[J].Silicone Mat,2009, 23(4): 265 - 268.
[11]厉瑾,宋锡瑾,徐佳音,等.蛋白质的单分子包埋[J].化学通报,2011,74(1):10 - 15.LI Jin, SONG Xijin, XU Jiayin, et al.The encapsulation of single protein[J].Chem Rep, 2011, 74(1): 10 - 15.
[12]孙玉英,张继泉.吸附交联法和包埋法固定化混合酶研究[J].淮海工学院学报:自然科学版,2013,22(3):82 - 88.SUN Yuying, ZHANG Jiquan.Comparative study of crude enzyme immobilization by cross-linking and entrapment methods[J].J Huaihai Inst Technol Nat Sci Ed, 2013, 22(3): 82 - 88.
[13]陈奎,李伯耿,曾光明.有机硅氧烷水解、缩聚的影响因素研究[J].化工新型材料,2010,38(1):110 - 111.CHEN Kui, LI Bogeng, ZENG Guangming.Influence factors of hydrolysis and condensation of organic silicon oxygen alkyl[J].New Chem Mat, 2010, 38(1): 110 - 111.
[14]李峰,李红强,赖学军,等.γ-巯丙基三甲氧基硅烷对纳米二氧化硅表面接枝改性的研究[J].无机盐工业,2014,46(4):33 - 36.LI Feng, LI Hongqiang, LAI Xuejun, et al.Suface grafting modifecation of nano-sized silica with 3-mercaptopropyl trimethoxysilane[J].Inorganic Chem Ind,2014,46(4):33 - 36.
[15]雷鸣,王艳,赵昊,等.C型硅胶与偶联剂KH-560键合反应初探[J].化工进展,2012,31(6):1263 - 1273.LEI Ming, WANG Yan, ZHAO Hao.Study on the reaction of typy C silica gel and KH-560 coupling agent[J].Chem Ind Eng Progr, 2012, 31(6): 1263 - 1273.
[16]王晓磊,戴卫国,何建新,等.柞蚕丝素水溶液静电纺纳米纤维的制备[J].材料科学与工程学报,2012,30 (2):287 - 290.WANG Xiaolei, DAI Weiguo, HE Jianxin, et al.Electrospun nanofibers from TSF aqueous solution[J].J Mat Sci & Eng, 2012, 30(2): 287 - 290.
[17]MURDOCH C, REEVES K J, HEARNDEN V, et al.Internalization and biodistribution of polymersomes into oral squamous cell carcinoma cells in vitro and in vivo[J].Nanomedicine, 2010, 5(7): 1025 - 1036.
[18]张瑞萍.纤维素酶活力测定方法[J].印染,2002,28(8):38 - 40.ZHANG Ruiping.Activity determination of cellulose[J].Dye Finish, 2002, 28(8): 38 - 40.
[19]GUAN Zhengjun, LUO Qian, CHEN Xi, et al.Saline soil enzyme activities of four plant communities in Sangong River basin of Xinjiang, China[J].J Arid Land, 2014, 6(2): 164 - 173.
[20]ROBINSON K L, de PAZ-BÁÑEZ M V, WANG X S, et al.Synthesis of well-defined, semibranched,hydrophilic-hydrophobic block copolymers using atom transfer radical polymerization[J].Macromolecules, 2001, 34(17): 5799 -5805.
Preparation and performance of novel immobilized cellulase
FU Xiaoping, YAO Shanshan, WANG Ying, GUO Ming
(School of Sciences, Zhejiang A & F University, Lin’an 311300, Zhejiang, China)
Abstract:A novel carrier was synthesized by condensation reaction with an acid catalytic action using tetraethyl orthosilicate and KH-560 as the silica resource and coupling reagent, respectively.The composition and structure of the carrier were characterized by infrared absorption spectroscopy,(13)C nuclear magnetic resonance, and X-ray diffractometry.The novel immobilized cellulase was prepared by the crosslinking-embedding immobilized method.The enzymatic characteristics of the immobilized cellulase were tested and compared with that of free cellulase.Experimental results showed that the immobilized cellulase maintained higher activity in the broader ranges of pH and temperature.The Michaelis constant(Km)of immobilized cellulase(1.58 g·L(-1))is similar as the free cellulase(1.40 g·L(-1)).Thus, immobilized cellulase could have a stronger affinity, reusability, and storage stability; and could provide a reference for preparing immobilized enzymes to perform better.[Ch, 9 fig.2 tab.20 ref.]
Key words:cellulase; crosslinking and embedding; immobilized; catalytic property
作者简介:傅小萍,从事生物质材料研究。E-mail:1940468653@qq.com。通信作者:郭明,教授,博士,从事生物质材料研究。E-mail:guoming@zafu.edu.cn
基金项目:浙江省大学生科技创新活动计划暨新苗人才计划资助项目(2014R412026, 201111030107)
收稿日期:2014-04-20;修回日期:2015-06-29
doi:10.11833/j.issn.2095-0756.2016.02.018
中图分类号:TQ352.2;S7-05
文献标志码:A
文章编号:2095-0756(2016)02-0315-07
