猪圆环病毒2型实时荧光定量PCR检测方法的建立
2016-04-27劳秀杰陈彦永何小江赵阿勇王晓杜宋厚辉浙江农林大学动物科技学院浙江临安311300
于 静,劳秀杰,陈彦永,何小江,代 兵,赵阿勇,王晓杜,宋厚辉(浙江农林大学动物科技学院,浙江临安311300)
猪圆环病毒2型实时荧光定量PCR检测方法的建立
于静,劳秀杰,陈彦永,何小江,代兵,赵阿勇,王晓杜,宋厚辉
(浙江农林大学动物科技学院,浙江临安311300)
摘要:猪圆环病毒2型(porcine circovirus 2, PCV2),是感染猪Sus scrofa domestica的一种单链DNA病毒。建立一种快速、灵敏的检测方法,对于PCV2感染猪的筛选和疾病预防非常重要。根据PCV2 ORF2基因保守区,设计了荧光定量聚合酶链式反应(PCR)引物,利用SYBR Green作为荧光染料建立了一种定量检测PCV2的PCR方法。结果表明:该方法具有灵敏度高、特异性强和重复性好的优点,每微升的最低检测限低至101拷贝DNA。利用该方法对34份PCV2阳性临床样本进行检测,检测符合率为100%,明显高于普通PCR方法的50.0%。因此,本研究建立的PCV2实时荧光定量PCR检测方法为该疾病的预防和控制提供一种有效的检测工具。图4表4参26
关键词:动物学;猪;猪圆环病毒2型;实时荧光定量PCR
猪圆环病毒2(porcine circovirus 2,PCV2),是最小的DNA病毒,断奶仔猪Sus scrofa domestica多系统衰竭综合征(postweaning multisystemic wasting syndrome, PMWS)的主要病原,成为严重阻碍养猪业发展的主要病原之一[1-3]。国内外针对PCV2致病机制、诊断方法以及疫苗研制等方面开展了大量的研究[1, 4]。然而,PCV2依然阻碍着养猪业的发展,主要原因可能是其临床发病与亚临床感染猪群中病毒量的不同,检测过程容易造成漏检,导致错误诊断。因此,发展一种高灵敏度、快速检测PCV2的方法尤为重要。猪圆环病毒(PCV)分为PCV1和PCV2等2种基因型,它们基因组结构相似,均含有ORF1和ORF2等2个主要的开放阅读框。ORF1是引起PCV1和PCV2抗原交叉反应的主要原因,其变异很小,同源性高达85%;而ORF2基因是PCV2的重要抗原基因,编码病毒衣壳蛋白(Cap蛋白)[5],其变异较大,在两型PCV之间不存在抗原交叉反应,被视为PCV1和PCV2的特异性鉴别抗原[6-8],并在临床检测中取得了良好的效果。基于ORF2的较大变异,可以设计特异性引物对PCV的2个基因型进行鉴定,已成为PCR方法鉴定PCV2的重要靶基因[9]。基于ORF2的这些优势,本研究也选择ORF2作为鉴定引物设计的首选基因。聚合酶链式反应(PCR)方法简单、方便、快速、敏感,在疾病检测中广泛应用,但其高假阳性和易污染的缺点依然存在。PCV2的抗体检测,敏感性和特异性都比较好,但是价格昂贵,技术要求较高。像多重PCR、巢式PCR等技术,虽然也可以达到很高的灵敏度,但是却不能定量。实时荧光定量PCR方法,不仅操作简便、敏感性高、重复性好、省时和可定量分析等优点,是病毒检测的重要方法。因此,本试验利用实时荧光定量PCR技术构建快速、灵敏检测PCV2的方法,以适应实验室和临床中对PCV2的实时定量检测。
1 材料与方法
1.1材料和临床病料
PCV2,猪蓝耳病毒(PRRSV,lelystad virus),猪细小病毒(porcine parvovirus,PPV)和猪瘟病毒(CSFV,hogcholera virus)等菌株由浙江农林大学动物预防医学与公共卫生实验室保存。19份病灶样品采自杭州国茂生态农业科技开发有限公司(简称:国茂),11份阳性病料和4份阴性对照由杭州检疫中心(杭州国正检测技术有限公司,简称:国正)惠赠。
1.2引物设计与合成
ORF2是PCV2的主要免疫原基因,也是主要用于PCR鉴别的基因[9]。根据GenBank公布的PCV2 ORF2基因序列,应用Primer 5.0软件设计ORF2基因全长克隆、普通PCR以及实时荧光定量PCR引物,并通过BLAST对其特异性进行分析。引物由上海生工生物工程公司合成,引物序列详见表1。
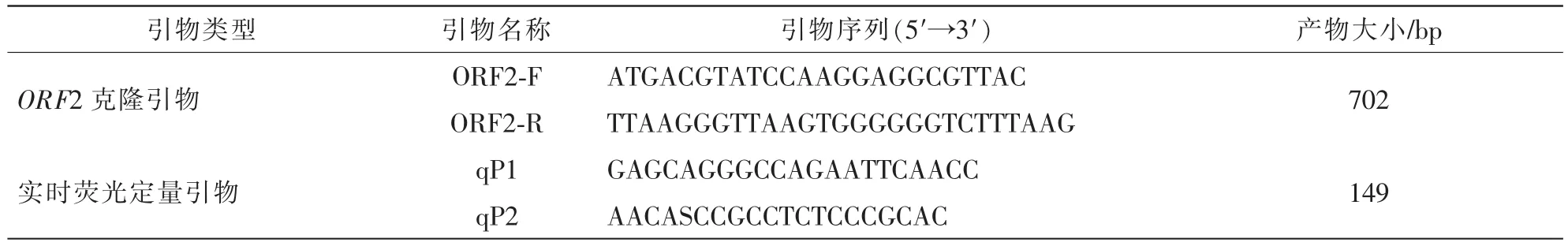
表1 实验中所用引物Table 1 Primers used in this study
1.3阳性质粒的制备与稀释
将扩增的ORF2片段与pZERO-blunt载体连接,转化大肠埃希菌Escherichia coli DH5α,提取重组质粒,并进行测序。用紫外分光光度计测定重组质粒的吸光度D(260)和D(280),计算出重组质粒的拷贝数,用EASY Dilution试剂将阳性重组质粒稀释到1010拷贝·μL-1,再进行10倍梯度稀释,以108,107,106,105,104,103,102,101,100拷贝·μL-19个拷贝数梯度作为标准模板,-20℃冻存备用。质粒质量浓度(g·L-1)=D(260)×50(g·L-1)/1 000×准模板释稀释倍数。
拷贝数计算公式:拷贝数(拷贝·μL-1)=质粒浓度(g·μL-1)×阿弗加德罗常数/重组质粒分子量。
1.4实时荧光定量反应条件
实时荧光定量PCR反应采用20 μL体系,其组分如下:SYBRRPremix Ex Taq GC(2×)10 μL,qP1 (10 μmol·L-1)0.4 μL,qP2(10 μmol·L-1)0.4 μL,ROX Reference Dye II(50×)0.4 μL,双蒸水7.8 μL,模板1 μL。PCR扩增条件:95℃预变性30 s,按95℃10 s,60℃20 s,72℃30 s,进行40个循环。
1.5标准曲线的建立
以重组质粒为标准品,进行10倍梯度稀释,取108~100拷贝·μL-1质粒为模板,用优化的实时荧光定量PCR体系及程序进行检测,同时设空白对照,每个标准品及空白对照均为3个平行重复。以起始模板拷贝数为x轴,循环阈值(Ct)值为y轴做回归曲线,建立PCV2实时荧光定量PCR检测的标准曲线。
1.6实时荧光定量PCR方法的重复性分析
对不同比例的标准品DNA 104, 103和102拷贝·μL-1进行批间和批内重复性试验。样本有3个平行重复(批内重复),分别进行3次重复(批间重复)。对所得Ct值的平均值、标准差和变异系数进行分析。
1.7敏感性和特异性分析
敏感性分析:以不同梯度标准品为模板,分析最低检出限,比较常规PCR与实时荧光定量PCR的敏感性差别。特异性分析:用所建立的实时荧光定量PCR方法对已知阳性样品猪圆环病毒2(PCV2),猪细小病毒(PPV),猪瘟病毒(CSFV)和猪蓝耳病毒(PRRSV)病毒DNA(或cDNA)进行检测,确定该方法的特异性。
1.8临床样本的检测
对采集的34份临床样品进行检测。用试剂盒提取DNA,用上述建立的方法进行检测。
2 结果与分析
2.1标准质粒的制备
以PCV2 DNA为模板,ORF2全长引物ORF2-F与ORF2-R进行PCR扩增,目的片段大小为702 bp,连接到pZERO-blunt载体上,并用载体上的酶切位点进行双酶切,出现载体片段和目的基因片段大小与预期一致,表明重组质粒构建正确(图1)。测序结果与目的片段序列也完全一致。抽提重组质粒,并梯度稀释为108,107,106,105,104,103,102,101,100拷贝·μL-19个比例的质粒为标准模板。
2.2实时荧光定量PCR标准曲线的建立
以梯度稀释重组质粒为模板进行标准曲线的制作。根据PCV2扩增动力学曲线,系统自动生成标准曲线,拷贝数(x)与循环阈值(Ct)之间的线性关系曲线表达式(图2C)为:Ct=-3.38× lgx + 35.98,其斜率为-3.38,相关系数(R2)为1,表明该标准曲线的线性度较好;PCR的扩增效率为97.6%,且表明实时荧光定量PCR最低检测线为101拷贝·μL-1。扩增曲线平滑(图2A),每个样品之间间隔均匀,阳性样品Ct值均在33以下,阴性对照样品没有扩增,最低检出限为101,因此,可以认为Ct值为33时是阴性样品和阳性样品的临界值,即Ct≤33可判为阳性,Ct>33判为阴性。溶解曲线分析可以反映扩增产物的正确性,是否有非特异性以及荧光信号是否由引物二聚体造成。本实验溶解曲线(图2B)特征峰单一,Tm值(解链温度)在86℃左右,表明是特异扩增。由此可以证明本研究建立的实时荧光定量PCR检测PCV2方法完全可信,可用于后续实验分析。
2.3实时荧光定量PCR方法的重复性分析
实验重复性是方法稳定性的标志。为了验证本研究建立的实时荧光定量PCR的重复性,我们以不同比例的标准品DNA 104,103和102拷贝·μL-1进行批间重复性试验,3份模板的3次批内(表2)和批间(表3)重复检测的Ct值误差均不到0.5,变异系数均小于2%,结果表明该方法具有较高的重复性。
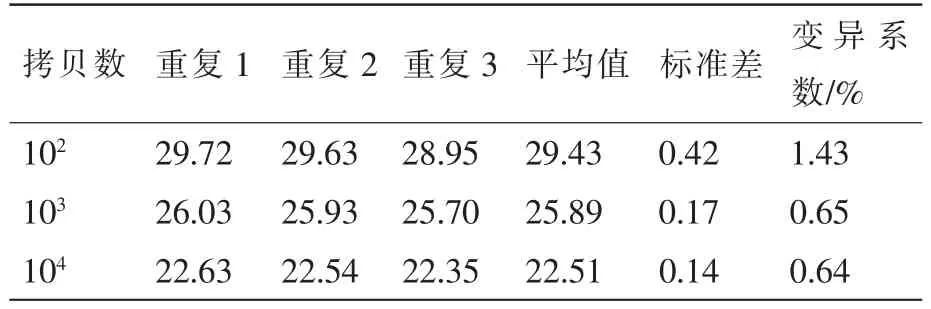
表2 实时荧光定量PCR方法的批内重复性实验结果Table 2 Repetitive experimental results of intra-assay ofreal-time PCR method

表3 实时荧光定量PCR方法的批间重复性实验结果Table 3 Repetitive experimental results inter-assay of real-time PCR method
2.4特异性分析
PCR扩增易出现假阳性,会造成误检,给生产带来负面效应。因此,我们对本研究建立的实时荧光定量PCR方法特异性进行分析,结果表明(图3):经实时荧光定量PCR检测,只有PCV2在Ct为18左右出现特异性扩增曲线,而检测的猪细小病毒(PPV),猪瘟病毒(CSFV),猪蓝耳病毒(PRRSV)等样品Ct值均大于33或无扩增,被判定为阴性。以上结果证明:本研究建立的实时荧光定量PCR检测PCV2的方法特异性高,可以用于后续临床样品分析。
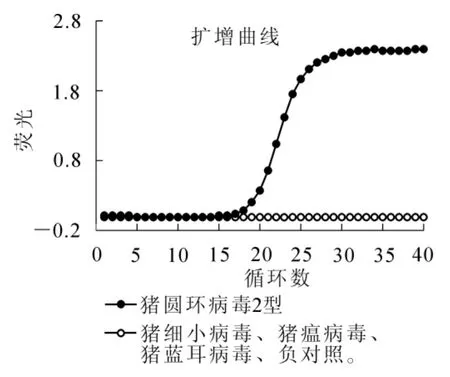
图3 特异性实验结果Figure 3 Result of specific analysis
2.5敏感性分析
敏感性对评价检测方法的灵敏性非常重要,因此,我们分析了普通PCR和实时荧光定量PCR这2种方法的敏感性。结果发现:普通PCR有扩增条带的模板浓度为104拷贝·μL-1,而实时荧光定量PCR方法在模板比例为101拷贝·μL-1(图4)时有扩增,也就表明实时荧光定量PCR检测PCV2的敏感性比普通PCR的敏感性高1 000倍。以上结果表明:本研究建立的实时荧光定量PCR检测PCV2的方法敏感性高。
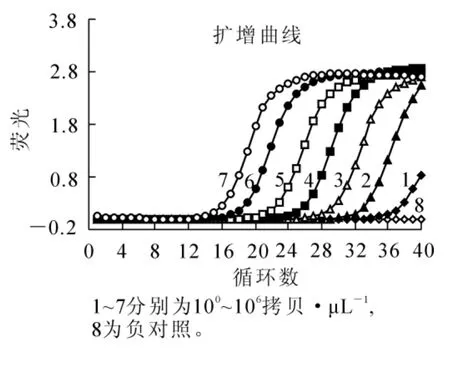
图4 敏感性实验结果Figure 4 Results of sensitivity analysis
2.6临床样本的检测
临床样品检测是技术推广的前提。本研究从杭州周围猪场采集的34份样品,其中阳性病灶样品30份,阴性样品4份,通过检测发现普通PCR检测方法符合率为50.0%,实时荧光定量PCR检测符合率为100%(表4),且带病样品的拷贝数为101~104拷贝·μL-1。以上结果表明:本研究建立的实时荧光定量PCR检测PCV2方法比普通PCR方法灵敏度高,能完全适合猪场疾病的检测,且能够定量分析样品的病毒量。

表4 临床样品检测结果Table 4 Analysis of clinical samples
3 讨论
Ⅱ型猪圆环病毒可以引起断奶仔猪多系统衰竭综合征(PMWS),育肥猪皮炎与肾病综合征(PDNS),增生性坏死性肺炎(PNP),猪呼吸道综合征,怀孕母猪的繁殖障碍、新生仔猪的先天性震颤(CT)和新生仔猪腹泻病等疾病[2, 10-14]。中国很多地方猪养殖场PCV2阳性率高达100%,仔猪死亡率高达30%。目前,对PCV2引起疾病的诊断标准、致病机理以及对病毒本身的防治研究还不清晰[15]。PCV2引起疾病的预防主要通过注射疫苗,但是免疫效果不理想。
PCV2引起疾病的诊断主要采用临床症状、病理剖解和实验室诊断等,这些方法诊断结果准确,但耗时长、工作量大,实际生产中难以推广应用[16]。此外,这些方法对亚临床感染猪的诊断经常会遭遇困难。为了解决这些问题,实验室开展了血清中和实验、ELISA、胶体金试纸和PCR等方法用于检测PCV2[17-21]。研究发现,猪圆环病毒2-dCap-ELISA抗体检测试剂盒在检测PCV2中具有成本低、不需要特殊仪器且能满足基层需要的优点[18],但是操作过程比较繁琐,中间环节可能会带来污染。而琼脂扩散试验和圆环病毒抗体胶体金试纸条检测PCV2的方法,虽然特异性、稳定性、符合率等都很高[17],但是依然存在较高假阳性问题。近年来,实时荧光定量PCR方法在疾病检测方面的应用,进一步提高了检测的灵敏度,缩短了检测时间。
本研究根据PCV2 ORF2基因设计实时荧光定量PCR引物。ORF2编码病毒的核衣壳蛋白(Cap),该蛋白可引起感染猪产生高含量的抗体,且在2个血清型(PCV1和PCV2)之间无交叉反应性,是检测病毒抗体水平的良好抗原[22]。因此,ORF2也成为PCR鉴别PCV2的重要基因[9]。郭慧娟等[23]根据ORF2设计TaqMan实时荧光定量PCR引物,建立了PCV2检测方法,其灵敏度高达到4.53×102拷贝·μL-1,而曹伟伟等[16]TaqMan实时荧光定量PCR方法的最低检测限度为5.06拷贝·μL-1。而SYBR Green I Realtime PCR检测方法的灵敏度基本在10~100拷贝·μL-1,比普通PCR检测方法检测灵敏度提高100~1 000倍[24-25]。
本研究建立的实时荧光定量PCR检测PCV2的方法能够对处于亚临床状态猪进行检测,可以为该病的治疗抢得宝贵时间。本研究建立的实时荧光定量PCR方法与普通PCR相比,灵敏度提高了1 000倍,和已报道实时荧光定量PCR[16, 23, 25-26]检测PCV2的灵敏度相似。总体来说,实时荧光定量PCR方法检测费用较高,所需仪器和操作环境要求较高。但是,本研究建立的实时荧光定量PCR检测PCV2的方法重复性和特异性高,不会造成错诊,会大大减少因病毒蔓延导致的猪场经济损失。此外,本研究建立的实时荧光定量PCR还可以对PCV2进行准确定量,对感病猪的早期诊断和猪场分类防治管理提供了重要的依据。
4 参考文献
[1]GRAU-ROMA L, FRAILE L, SEGALES J.Recent advances in the epidemiology, diagnosis and control of diseases caused by porcine circovirus type 2[J].Vet J, 2011, 187(1): 23 - 32.
[2]ALLAN G M, ELLIS J A.Porcine circoviruses: a review[J].J Vet Diagn Invest, 2000, 12(1): 3 - 14.
[3]陈溥言,华修国.断奶仔猪多系统消耗综合征[J].畜牧与兽医, 2002, 34(7): 33 - 35.CHEN Puyan, HUA Xiuguo.Postweaning multisystemic wasting syndrome[J].Anim Husb & Vet Med, 2002, 34(7): 33 - 35.
[4]田晓婷,李宝玉,柳纪省.猪圆环病毒的分子生物学与检测方法的研究现状[J].中国农学通报, 2012, 28(14): 66 - 72.TIAN Xiaoting, LI Baoyu, LIU Jixing.A review for the molecular biology characteristics and molecular diagnosis methods of porcine circovirus[J].Chin Agric Sci Bull, 2012, 28(14): 66 - 72.
[5]NAWAGITGUL P, MOROZOV I, BOLIN S R, et al.Open reading frame 2 of porcine circovirus type 2 encodes a major capsid protein[J].J Gen Virol, 2000, 81(9): 2281 - 2287.
[6]BLANCHARD P, MAHE D, CARIOLET R, et al.An ORF2 protein-based ELISA for porcine circovirus type 2 antibodies in post-weaning multisystemic wasting syndrome[J].Vet Microbiol, 2003, 94(3): 183 - 194.
[7]陈陆,杨霞,王江辉,等.猪圆环病毒2型(PCV2)河南分离株进化分析及ORF2基因的表达[J].农业生物技术学报, 2009, 17(4): 561 - 566.CHEN Lu, YANG Xia, WANG Jianghui, et al.Phylogenetic analysis of porcine circovirus 2(PVC2)isolated from Henan province and expression of the ORF2 gene in Escherichia coli[J].J Agric Biotechnol, 2009, 17(4): 561 - 566.
[8]王子馨,李坤,刘金朋,等.PCV2 ORF2基因与猪IL-18基因共表达DNA疫苗的免疫原性[J].中国兽医学报, 2013,33(4): 532 - 537.WANG Zixin, LI Kun, LIU Jinpeng, et al.Enhancement of DNA vaccine potency against PCV2 by coexpression of PCV2 ORF2 and IL-18 genes[J].Chin J Vet Sci, 2013,33(4): 532 - 537.
[9]CHEUNG A K.Transcriptional analysis of porcine circovirus type 2[J].Virology, 2003, 305(1): 168 - 180.
[10]BRUNBORG I M, FOSSUM C, LIUM B, et al.Dynamics of serum antibodies to and load of porcine circovirus type 2 (PCV2)in pigs in three finishing herds, affected or not by postweaning multisystemic wasting syndrome[J].Acta Vet Scand, 2010, 52: 22 - 31.
[11]GUO Longjun, LU Yuehua, WEI Yanwu, et al.Porcine circovirus type 2(PCV2): genetic variation and newly emerging genotypes in China[J].Virol J, 2010, 7(1): 273 - 285.
[12]KURTZ S, GRAU-ROMA L, CORTEY M, et al.Pigs naturally exposed to porcine circovirus type 2(PCV2)generate antibody responses capable to neutralise PCV2 isolates of different genotypes and geographic origins[J].Vet Res, 2014, 45: 29 - 38.
[13]OPRIESSNIG T, MENG Xiangjin, HALBUR P G.Porcine circovirus type 2-associated disease: update on current terminology, clinical manifestations, pathogenesis, diagnosis, and intervention strategies[J].J Vet Diagn Invest, 2007, 19(6): 591 - 615.
[14]XIAO C T, HALBUR P G, OPRIESSNIG T.Global molecular genetic analysis of porcine circovirus type 2(PCV2)sequences confirms the presence of four main PCV2 genotypes and reveals a rapid increase of PCV2d[J].J Gen Virol, 2015, 96: 1830 - 1841.
[15]STEINER E, BALMELLI C, GERBER H, et al.Cellular adaptive immune response against porcine circovirus type 2 in subclinically infected pigs[J].BMC Vet Res, 2009, 5(1): 45 - 57.
[16]曹伟伟,郭抗抗,许信刚,等.猪圆环病毒Ⅱ型TaqMan实时荧光定量PCR检测方法的建立与应用[J].西北农林科技大学学报:自然科学版, 2013, 41(1): 13 - 18.CAO Weiwei, GUO Kangkang, XU Xingang, et al.Establishment and application of Taq Man real-time fluorescent quantitative PCR for detecting porcine circovirus typeⅡ[J].J Northwest A & F Univ Nat Sci Ed, 2013, 41(1): 13 - 18.
[17]苗丽娟,刘玉茹,李静姬,等.Ⅱ型猪圆环病毒Cap蛋白琼脂扩散试验检测方法的建立[J].黑龙江畜牧兽医, 2013, 46(9): 105 - 106.MIAO Lijuan, LIU Yuru, LI Jingji, et al.Establishment of Cap protein agar diffusion assay for detection of porcine circovirus typeⅡ[J].Heilongjiang Animal Sci Vet Med, 2013, 46(9): 105 - 106.
[18]赵玉龙,焦玉兰,郁宏伟,等.一种猪圆环病毒Ⅱ型ELISA抗体检测试剂盒的临床应用[J].中国兽药杂志, 2011, 45(3): 31 - 34.ZHAO Yulong, JIAO Yulan, YU Hongwei, et al.Clinical applications of antibody detection ELISA kit for porcine circovirus type 2[J].Chin J Vet Drug, 2011, 45(3): 31 - 34.
[19]岳丰雄,崔尚金,冉多良,等.PCV2, PPV, PRV和PRRSV多重PCR检测方法的建立及初步应用[J].中国兽医科学, 2008, 38(8): 691 - 696.YUE Fengxiong, CUI Shangjin, RAN Duoliang, et al.Establishment and application of a multiplex PCR assay for simultaneous detection of PCV2, PPV, PRV and PRRSV[J].Chin Vet Sci, 2008, 38(8): 691 - 696.
[20]YUE Fengxiong, CUI Shangjin, ZHANG Chaofan, et al.A multiplex PCR for rapid and simultaneous detection of porcine circovirus type 2, porcine parvovirus, porcine pseudorabies virus, and porcine reproductive and respiratory syndrome virus in clinical specimens[J].Viru Gen, 2009, 38(3): 392 - 397.
[21]LIU Changming, IHARA T, NUNOYA T, et al.Development of an ELISA based on the baculovirus-expressed capsid protein of porcine circovirus type 2 as antigen[J].J Vet Med Sci, 2004, 66(3): 237 - 242.
[22]郭官鹏,刘畅,陈龙彪,等.猪圆环病毒2型ORF2基因截断表达及ELISA抗体检测方法的初步建立[J].中国兽医学报, 2014, 34(7): 1059 - 1064.GUO Guanpeng, LIU Chang, CHEN Longbiao, et al.Development of an indirecr ELISA based on prokaryotic expression of truncated ORF2 gene of porcine circovirus type 2[J].Chin J Vet Sci, 2014, 34(7): 1059 - 1064.
[23]郭慧娟,李秀丽,张国伟,等.猪圆环病毒2型TaqMan荧光定量PCR检测方法的建立[J].中国畜牧兽医, 2014, 41(5): 39 - 45.GUO Huijuan, LI Xiuli, ZHANG Guowei, et al.Establishment of Taq-Man real-time PCR for detection of porcine circovirus typeⅡ[J].China Anim Husb & Vet Med, 2014, 41(5): 39 - 45.
[24]张福良,宋长绪,杨鸣琦,等.猪圆环病毒2型荧光定量PCR检测方法的建立[J].中国兽医学报, 2006, 26 (3): 248 - 250.ZHANG Fuliang, SONG Changxu, YANG Mingqi, et al.Development of fluorescent quantitative PCR assay for PCV2 detection[J].Chin J Vet Sci, 2006, 26(3): 248 - 250.
[25]李鹏,郭军庆,金前跃,等.猪圆环病毒2型荧光定量PCR检测方法的建立[J].华北农学报, 2014, 29(2): 66 -70.LI Peng, GUO Junqing, JIN Qianyue, et al.Rapid detection of porcine circovirus type 2 using a SYBR Green I realtime PCR[J].Acta Agric Boreal-Sin, 2014, 29(2): 66 - 70.
[26]董林,王艳萍,魏凤,等.猪圆环病毒2型SYBR GreenⅠ实时荧光定量PCR检测方法的建立[J].中国兽医科学, 2013, 43(10): 1073 - 1078.DONG Lin, WANG Yanping, WEI Feng, et al.Development and application of a SYBR Green I real-time fluorescent quantitative PCR method for detection of type 2 porcine circovirus[J].Chin J Vet Sci, 2013, 43(10): 1073 - 1078.
A real-time PCR method for detection of porcine circovirus 2
YU Jing, LAO Xiujie, CHEN Yanyong, HE Xiaojiang, DAI Bing, ZHAO Ayong, WANG Xiaodu, SONG Houhui
(School of Animal Science and Technology, Zhejiang A & F University, Lin’an 311300, Zhejiang, China)
Abstract:To develop an accurate and rapid detection method for disease screening and prevention with porcine
circovirus type 2(PCV2), a single-strand DNA virus that infects pigs, primers targeted to the ORF2 fragment of the PCV2 conserved region were designed.A real time polymerase chain reaction(PCR)method was developed using SYBR Green as a fluorescent dye and serial dilutions of ORF2 recombinant plasmid to construct a standard curve for an absolute quantification.Results showed that the detection limit was obtained with 101
copy DNA per microliter.This method exhibited 1 000 times higher sensitivity than conventional PCR, only specific identification of PCV2, and better repeatability with the less than 2% variation coefficient of intra- or inter-assay experiments.A total of 34 PCV2 positive clinical samples were confirmed using this real time PCR method, demonstrating 100% agreement in comparison with the conventional PCR having only 50% agreement.This real time PCR method could provide a valuable tool for PCV2 prevention and control.[Ch, 4 fig.4 tab.26 ref.]
Key words:zoology; porcine; porcine circovirus 2; real-time PCR
作者简介:于静,讲师,博士,从事畜禽遗传与疾病控制研究。E-mail: yujing_2009@163.com。通信作者:宋厚辉,研究员,博士,从事动物疫病防控和公共卫生研究。E-mail: songhh@zafu.edu.cn
基金项目:浙江省科学技术公益项目(2014C32061);浙江农林大学人才启动项目(2011FR025,2013FR077);浙江省自然科学基金资助项目(LQ14C010007);浙江农林大学大学生科技创新训练计划项目(201301017);浙江农林大学面上基金项目(2013FK001)
收稿日期:2015-04-19;修回日期:2015-06-22
doi:10.11833/j.issn.2095-0756.2016.02.023
中图分类号:S852.3
文献标志码:A
文章编号:2095-0756(2016)02-0357-07
