线粒体靶向小清蛋白表达载体构建及其对肝癌细胞线粒体钙稳态的影响
2016-04-18张卉王姣姣任婷婷金明朋朱剑军张洪新吴有盛
张卉,王姣姣,任婷婷,金明朋,朱剑军,张洪新,吴有盛
(1第四军医大学唐都医院,西安710026;2国家肿瘤生物学重点实验室·第四军医大学基础部教学实验中心)
线粒体靶向小清蛋白表达载体构建及其对肝癌细胞线粒体钙稳态的影响
张卉1,王姣姣2,任婷婷2,金明朋2,朱剑军2,张洪新1,吴有盛2
(1第四军医大学唐都医院,西安710026;2国家肿瘤生物学重点实验室·第四军医大学基础部教学实验中心)
摘要:目的构建线粒体靶向小清蛋白(PVALB)表达载体,探讨线粒体靶向PVALB在肝癌细胞(MHCC97H)中的表达及对线粒体内钙稳态的影响。方法 以骨骼肌细胞的cDNA为模板,通过PCR法扩增得到PVALB,经酶切后与MTS、pcDNA3.1(+)载体连接;重组质粒经酶切分析及测序鉴定后,用脂质体转染法转染肝癌细胞MHCC97H,用激光共聚焦显微镜检测PVALB定位及转染后MHCC97H线粒体中钙离子浓度。结果pcDNA3.1(+)-MTS-PVALB经酶切、测序鉴定完全正确,真核表达载体构建成功;表达的MTS-PVALB定位于线粒体;MTS-PVALB可下调线粒体内钙离子浓度。结论 成功构建pcDNA3.1(+)-MTS-PVALB线粒体靶向真核表达载体,MTS-PVALB定位于MHCC97H线粒体并调节线粒体钙稳态。
关键词:肝肿瘤;小清蛋白;线粒体;钙稳态;载体构建
线粒体的钙稳态在细胞中起着重要的生物学作用,与细胞的凋亡、有氧代谢和活性氧的产生等紧密相关,对胞质内钙离子信号转导、细胞凋亡途径的激活都具有广泛的调控作用。研究表明,钙稳态失调将导致线粒体功能异常,与肿瘤的发生密切相关[1,2]。小清蛋白(PVALB)是细胞内重要的水溶性钙结合蛋白,是EF手臂钙结合蛋白成员之一,对钙离子具有高亲和力[3],能有效调控细胞内钙离子交换,进而调控细胞生物学功能。线粒体靶向定位信号(MTS),能够引导蛋白进入线粒体。本研究拟通过构建融合MTS的PVALB真核表达载体,探讨其对肝癌细胞(MHCC97H)线粒体中钙稳态的调控作用。
1材料与方法
1.1材料pcDNA3.1(+)载体、TRIzol、Lipofectamine2000、MitoTracker®Red CMXRos、Rhod-2 AM、PVDF膜购自Invitrogen公司;高糖DMEM培养基和胎牛血清购自Gibco公司; 胞质线粒体分离试剂盒(C3601)购自碧云天生物技术研究所;抗Parvalbumin (ab11427)多抗、羊抗兔二抗(ab6721)购自Abcam;限制性核酸内切酶NheⅠ、Hind Ⅲ、BamHⅠ、T4 DNA 连接酶、DNA marker DL2000购自TaKaRa公司;PCR所用的高保真DNA聚合酶购自TOYOBO公司;DNA胶回收试剂盒和质粒提取试剂盒购自Omega BIO-TEK公司;蛋白质预染Marker(SM 0671)购自Thermo Scientific公司;实验所用引物由生工生物工程(上海)股份有限公司合成;MHCC97H购自上海中科院细胞库;293T细胞由第四军医大学基础部教学实验中心培养。
1.2目的基因获取线粒体靶向序列按人细胞色素C氧化酶亚基Ⅷ相应合成;PVALB序列以骨骼肌细胞cDNA为模板,PCR扩增获取;EGFP扩增以pEGFP-N2质粒为模板。PCR反应体系(50 μL):10×PCR Buffer for KOD-Plus-Neo 5 μL、dNTPs(2 mmol/L) 5 μL、MgSO4(25 mmol/L) 3 μL、上下游引物各1.5 μL、KOD-Plus-Neo(1 U/μL) 1 μL、模板1 μL、去离子水32 μL。PCR反应条件: 94 ℃预变性2 min、98 ℃变性10 s、68 ℃退火和延伸 30 s,循环30次。PCR产物用1%琼脂糖凝胶电泳分离,按照DNA胶回收试剂盒说明操作,回收目的PVALB、EGFP DNA片段。
1.3pcDNA3.1(+)-PVALB、pcDNA3.1(+)-EGFP表达载体构建回收的DNA片段及pcDNA3.1(+)载体用Hind Ⅲ和BamHⅠ双酶切1 h后,1%琼脂糖凝胶电泳分离,胶回收并定量。将酶切后的PVALB、EGFP DNA片段与pcDNA3.1(+)载体16 ℃连接过夜。将每个连接体系转化50 μL的TOP10感受态,于37 ℃恒温培养箱中过夜。次日挑取平板中独立的单克隆菌落,接种于5 mL含氨苄抗性的液体LB培养基中,置37 ℃恒温摇床中,240 r/min过夜。收集3 mL菌液,按照质粒提取试剂盒说明提取质粒并定量,并用HindⅢ和BamHⅠ双酶切,1%琼脂糖凝胶电泳鉴定,切下片段与目的DNA大小一致的质粒载体命名为pcDNA3.1(+)-PVALB和pcDNA3.1(+)-EGFP。
1.4靶向表达载体的构建取构建好的pcDNA3.1(+)-PVALB、pcDNA3.1(+)-EGFP表达载体,用NheⅠ和Hind Ⅲ双酶切2 h后,1%琼脂糖凝胶电泳分离,按照DNA胶回收试剂盒说明操作,回收酶切后的载体并定量。各取酶切后的载体与退火后的MTS 16 ℃连接过夜。 按照之前方法转化连接产物,并挑取单克隆菌落,扩增,提取重组后质粒载体,用NheⅠ和Hind Ⅲ双酶切1 h,1%琼脂糖凝胶电泳鉴定,切下片段与目的DNA大小一致的质粒命名为pcDNA3.1(+)-MTS-PVALB、pcDNA3.1(+)-MTS-EGFP。按上述方法,用BamHⅠ和NheⅠ双酶切pcDNA3.1(+)-MTS-PVALB,插入EGFP序列,构建pcDNA3.1(+)-MTS-PVALB -EGFP真核表达载体。
1.5MHCC97H中MTS-PVALB融合蛋白表达定位将MHCC97H以5×105/孔接种于6孔板内,24 h后使用Lipofectamine 2000转染试剂(8 uL/孔)转染融合表达pcDNA3.1(+)-MTS-EGFP、pcDNA3.1(+)-MTS-PVALB -EGFP载体(4 μg/孔)。24 h后消化、重悬、计数,再取适量细胞接种于激光共聚焦专用培养皿中。待细胞贴壁后,使用HBSS洗涤3次,在各培养皿底部加入200 μL浓度为250 nmol/L(用37 ℃预热HBSS稀释)Mito Tracker®Red 染料,37 ℃,染色25 min,HBSS清洗3次,使用Olympus (FV1000)共聚焦显微镜拍照。
1.6MHCC97H线粒体中MTS-PVALB融合蛋白定位检测按照碧云天细胞线粒体分离试剂盒说明,提取转染了pcDNA3.1(+)-MTS-PVALB和pcDNA3.1(+)-MTS-EGFP的MHCC97H细胞线粒体及去除线粒体的胞质蛋白(细胞数约5×107个),用150 μL细胞全蛋白裂解液(含Sodium Vanadate 2 mmol/L、Aprotinin 1 μg/mL、leupetin 1 μg/mL、PMSF 1 mmol/L)裂解提取的线粒体,胞质蛋白和线粒体蛋白测定浓度。检测时取等质量蛋白上清25 μL,加5 μL 6×还原型上样缓冲液煮沸10 min,使蛋白变性,12 000 r/min离心5 min,取上清和预染Marker用15%的SDS-PAGE凝胶加样电泳,Western blotting法检测蛋白。
1.7MHCC97H线粒体中钙离子动态检测将转染pcDNA3.1(+)-MTS-EGFP真核表达载体及转染了pcDNA3.1(+)-MTS-PVALB真核表达载体的MHCC97H分别接种于共聚焦专用培养皿中,待细胞贴壁后,用浓度为 4 μmol/L的 Rhod-2 AM荧光染料,37 ℃染色30 min后,用HBSS清洗3次,再次置于37 ℃继续孵育30 min。使用Olympus荧光显微镜检测细胞,激发波长545 nm,发射波长565 nm。使用专用软件,拍照设置间隔1张/s×500张,达到1 min基线后加入10 μmol/L组胺,记录荧光强度曲线并加以分析。
2结果
2.1真核表达载体构建结果PCR法扩增的PVALB 和EGFP片段的产物经电泳后鉴定分别为330 bp 和720 bp,与预期大小一致。构建的真核表达载体pcDNA3.1(+)-MTS-PVALB、pcDNA3.1(+)-MTS-EGFP、 pcDNA3.1(+)-MTS-PVALB-EGFP经限制性内切酶酶切、琼脂糖凝胶电泳鉴定大小与预期大小一致,证明目的基因已成功连接到载体中,经进一步测序确认,所构建的载体序列、目的基因融合顺序均正确。
2.2MTS-PVALB融合蛋白的定位情况MTS特异性地引导蛋白定位于线粒体。本实验中构建的表达载体转染细胞后,融合蛋白可正常表达。激光共聚焦显微镜拍照结果表明,表达的融合蛋白精确定位于线粒体中。
2.3PVALB对细胞内钙稳态的影响表达MTS-PVALB融合蛋白的MHCC97H内钙离子浓度降低,在组胺诱导细胞内钙震荡后,可很好地调节细胞内钙稳态,震荡幅度变小,防止线粒体钙超载。见图1。
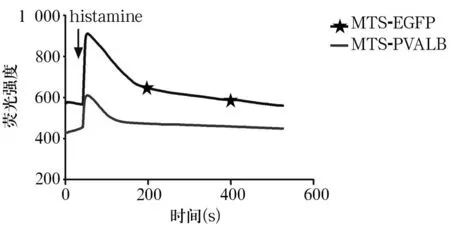
图1 MTS-PVALB调节MHCC97H线粒体内钙浓度动态曲线
3讨论
线粒体钙稳态与细胞的生物学功能密切相关,影响细胞的能量代谢和活性氧的产生,对胞质内钙离子信号和震荡发挥缓冲作用,调控细胞的凋亡途径[4,5]。无论是分离的还是体内的线粒体都可以自发吸收和释放钙离子,在维持细胞钙稳态中起到非常重要的作用[6]。钙超载容易导致线粒体损伤,诱导细胞凋亡和炎症发生[7,8],钙稳态的失调可导致线粒体功能紊乱,因此维持合适钙离子水平对细胞正确发挥功能必不可少。
线粒体钙稳态的调控涉及钙的吸收、释放和存储。最近研究发现,定位于线粒体内膜的分子线粒体钙离子单向转运蛋白(MCU)及其受体(MCUR1)能够正向调节线粒体钙离子摄取,促进线粒体钙离子内流,提高线粒体对胞质钙离子的缓冲能力[9,10]。与Parvalbumin蛋白一样,线粒体钙离子调节蛋白具有两个典型的EF-hand结构域,可感知钙离子的变化,作为调控线粒体钙摄入的重要分子,其表达与功能发挥是调节线粒体钙稳态的关键。原发性肝癌组织中MCUR1蛋白表达异常增高,提示MCUR1异常表达可能与肝癌恶性发展相关。有研究也发现,线粒体钙摄入减少能够增强肿瘤细胞对于凋亡诱导剂的抵抗能力[11]。这些研究都反映了线粒体钙稳态与肿瘤发生相关。
Parvalbumin是细胞内对钙离子具有高亲和力的钙结合蛋白,是EF-hand钙结合蛋白成员之一,是细胞内钙离子缓冲系统重要组成部分[12,13],主要表达于骨骼肌细胞和少数神经元细胞中。Parvalbumin在神经元分布与γ-氨基丁酸能神经元的分布高度一致,可能与神经冲动传递、短期突触可塑性、抑制性神经递质释放等有关[14,15]。MTS能够引导融合蛋白进入线粒体,本研究中构建了MTS-PVALB融合蛋白真核表达载体,实现了目的蛋白定位于线粒体中,表达MTS-PVALB融合蛋白的细胞内钙离子浓度降低,在组胺诱导细胞内钙震荡后,可很好地调节细胞内钙稳态,震荡幅度变小,降低钙波的传播幅度和速度,防止线粒体功能异常。
参考文献:
[1] Boland ML, Chourasia AH, Macleod KF. Mitochondrial dysfunction in cancer[J]. Front Oncol, 2013,3:292.
[2] 张百红,岳红云.线粒体在肿瘤发生中的作用[J].国际肿瘤学杂志,2013,40(7):486-488.
[3] 农小献,宾石玉,蒙涛,等.小清蛋白研究进展[J].生物技术通讯,2011,22(6):887-891.
[4] Hoppe UC. Mitochondrial calcium channels[J]. FEBS Lett, 2010,584(10):1975-1981.
[5] 徐欢成,郑明学,古少鹏,等.钙信号转导对细胞凋亡的影响[J].动物医学进展,2013,34(1):112-115.
[6] 陆久维,翟宇佳,孙飞.线粒体钙离子转运的研究进展[J].生物物理学报,2013,29(3):167-180.
[7] 唐海林,苏琦.钙离子信号与细胞凋亡关系的研究进展[J].南华大学学报(医学版),2006,34(5):663-666.
[8] 齐卡,冯哲,洪权,等.尿酸通过诱导线粒体钙稳态失衡介导内皮细胞炎症反应[J].山东医药,2010,50(20):15-18.
[9] Mallilankaraman K, Doonan P, Cárdenas C, et al. MICU1 is an essential gatekeeper for MCU-mediated mitochondrial Ca2+uptake that regulates cell survival[J]. Cell, 2012,151(3):630-644.
[10] 郭晓强,计惠民.线粒体钙离子单向转运蛋白MCU及调节蛋白MICU1[J].生命的化学,2012,32(3):228-230.
[11] Tina Pangrsic, Mantas Gabrielaitis, Susann Michanski, et al. EF-hand protein Ca2+buffers regulate Ca2+influx and exocytosis in sensory hair cells[J]. PNAS, 2015,112(9):E1028-E1037.
[12] Henzi T, Schwaller B. Antagonistic regulation of parvalbumin expression and mitochondrial calcium handling capacity in renal epithelial cells[J]. PLoS One, 2015,10(11):e0142005.
[13] Marchi S, Lupini L, Patergnani S, et al. Downregulation of the mitochondrial calcium uniporter by cancer-related miR-25[J]. Curr Biol, 2013,23(1):58-63.
[14] 颜焱华,郑德枢.钙结合蛋白Parvabmin(小白蛋白)及其在中枢神经系统中的分布[J].神经解剖学杂志,1992,8(1):17-22.
[15] Ellender TJ, Raimondo JV, Irkle A, et al. Excitatory effects of parvalbumin-expressing interneurons maintain hippocampal epileptiform activity via synchronous afterdischarges[J]. J Neurosci, 2014,34(46):15208-15222.
Construction of mitochondria targeted parvalbumin expressing vector and its effect on mitochondrial calcium homeostasis of hepatocellular carcinoma cells
ZHANGHui1,WANGJiaojiao,RENTingting,JINMingpeng,ZHUJianjun,ZHANGHongxin,WUYousheng
(1TangduHospital,TheFourthMilitaryMedicalUniversity,Xi'an710026,China)
Abstract:ObjectiveTo construct mitochondria targeted parvalbumin (PVALB) expression vector and to investigate the mitochondrial targeting PVALB expression in human hepatocellular carcinoma cells MHCC97H and its effect on mitochondrial calcium homeostasis. MethodsUsing skeletal muscle cells cDNA as the template, the PVALB was amplified by PCR, and then the digested PVALB was connected with MTS and pcDNA3.1 (+) vector. After identifying by enzyme digestion analysis and sequencing, the recombinant plasmid was transfected into MHCC97H by liposome. The expression and localization of PVALB, calcium concentration in MHCC97H were detected by laser scanning confocal microscopy after transfection. ResultspcDNA3.1 (+)-MTS-PVALB was successfully constructed and was verified by restriction enzyme digestion and DNA sequencing. The expression of MTS-PVALB was located in the mitochondria, and MTS-PVALB could down-regulate the concentration of calcium. ConclusionpcDNA3.1 (+)-MTS-PVALB was successfully constructed. The expressed MTS-PVALB was located in MHCC97H mitochondria and regulated mitochondrial calcium homeostasis.
Key words:liver neoplasms; parvalbumin; mitochondria; calcium homeostasis; vector construction
(收稿日期:2015-12-28)
中图分类号:R735.7
文献标志码:A
文章编号:1002-266X(2016)09-0004-03
doi:10.3969/j.issn.1002-266X.2016.09.002
通信作者简介:张洪新(1966-),男,博士,教授,主要研究方向为肿瘤防治。E-mail:zhhxtdjr@163.com吴有盛(1975-),男,硕士,实验师,主要研究方向为线粒体生物学及肿瘤防治。E-mail:wuys@fmmu.edu.cn
作者简介:第一张卉(1988-),女,硕士研究生,主要研究方向为肿瘤代谢。E-mail:grass1010@qq.com
基金项目:国家自然科学基金资助项目(81572727;81572304)。
