血清HIF-1、Ngb检测对脑梗死合并OSAHS患者决策功能障碍的评估价值
2016-04-18李立群杨瑞王红阳李建民
李立群,杨瑞,王红阳,李建民
(华北理工大学附属医院,河北唐山063000)
血清HIF-1、Ngb检测对脑梗死合并OSAHS患者决策功能障碍的评估价值
李立群,杨瑞,王红阳,李建民
(华北理工大学附属医院,河北唐山063000)
摘要:目的探讨血清低氧诱导因子1(HIF-1)、脑红蛋白(Ngb)检测对脑梗死合并阻塞性睡眠呼吸暂停低通气综合征(OSAHS)患者决策功能障碍的评估价值。方法选择脑梗死患者332例,伴OSAHS 164例(观察组,OSAHS轻度67例、中度52例、重度45例)、不伴OSAHS 168例(对照组)。酶联免疫吸附法检测两组血清HIF-1、Ngb水平,爱荷华赌博任务(IGT)测评决策功能,用Pearson相关分析参数的关系,用受试者工作特征(ROC)曲线评估血清HIF-1、Ngb对决策功能障碍的预测效能。结果与对照组比较,观察组血清HIF-1、Ngb水平升高,IGT评分降低(P均<0.05);OSAHS轻度、中度、重度患者血清HIF-1、Ngb水平比较差异有统计学意义(P均<0.05)。血清HIF-1、Ngb水平与IGT评分呈负相关(r分别为-0.665、-0.664,P均<0.05)。血清HIF-1、Ngb水平预测决策功能障碍的ROC曲线下面积分别为0.858、0.884。结论 血清HIF-1、Ngb检测有助于早期预测脑梗死合并OSAHS患者的决策功能障碍。
关键词:阻塞性睡眠呼吸暂停低通气综合征;脑梗死;决策功能障碍;低氧诱导因子-1;脑红蛋白
阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是脑血管疾病独立危险因素,而脑梗死合并OSAHS患者不仅病死率增加,且加重遗留的神经功能障碍尤其是认知功能障碍[1,2]。但目前临床缺乏判断患者认知功能障碍加重的早期敏感指标。低氧诱导因子1(HIF-1)和脑红蛋白(Ngb)参与缺血缺氧脑损伤病理进程,对维持脑内环境稳态和神经细胞功能起重要作用[3,4],且与神经功能障碍有关。本研究探讨血清HIF-1、Ngb检测对脑梗死合并OSAHS患者决策功能障碍的评估价值。
1资料与方法
1.1临床资料选择2013年3月~2014年10月本院收治的脑梗死患者332例,均符合中国急性缺血性脑卒中诊治指南2010中脑梗死的诊断标准[5],并经头颅CT或MRI检查证实。排除脑梗死前有持续缺氧性疾病、严重精神疾病者;发病2~3周内有意识障碍、严重构音障碍、失语、耳聋和严重的视力障碍而影响检查者;色盲或色弱者;已确诊为糖尿病患者;蛛网膜下腔出血者;不能理解或完成测试者。其中男167例、女165例,年龄50~70(60.92±10.36)岁,BMI(24.68±4.42)kg/m2,梗死部位:颞叶139例、非颞叶193例,梗死面积<10 mm2127例,10~50 mm2205例,经多导睡眠仪(PSG)进行睡眠监测确诊合并OSAHS 164例(观察组),不伴OSAHS 168例(对照组)。两组性别、年龄、BMI等比较差异无统计学意义。
1.2PSG监测患者均进行PSG监测,PSG判读以美国睡眠医学会睡眠及其相关事件判读手册为标准[6],观测指标包括呼吸暂停低通气指数(AHI)、夜间睡眠最低动脉血氧饱和度(LSaO2),依据AHI将观察组患者分为轻度OSAHS 67例、中度52例、重度45例,检查者试验前1周禁用兴奋、催眠类药物。
1.3血清HIF-1、Ngb检测患者于入院次日晨抽取空腹静脉血5 mL注入含EDTA的抗凝管中混匀,分离血清,采用酶联免疫吸附法检测血清HIF-1、Ngb水平。
1.4决策功能测评采用计算机版本的爱荷华赌博任务(IGT),分为5个阶段进行测试,参照Bechara的方法,以所有研究对象的IGT总净分数的平均数为界值,分为有决策功能障碍者和无决策功能障碍者。

2结果
2.1两组血清HIF-1、Ngb水平及AHI、LSOa2比较与对照组比较,观察组血清HIF-1、Ngb水平及AHI均升高,LSOa2降低(P均<0.05);且观察组内轻度、中度、重度患者血清HIF-1、Ngb水平及AHI、LSOa2比较差异有统计学意义(P均<0.05),见表1。
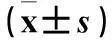
表1 两组血清HIF-1、Ngb水平及AHI、LSOa2比较
注:与对照组比较,*P<0.05。
2.2两组决策功能测评结果比较经测评,对照组有决策功能障碍57例(33.93%),观察组78例(48.17%),比较差异有统计学意义(P<0.05)。第一、二阶段两组IGT评分比较差异无统计学意义(P均>0.05),其余各阶段两组IGT评分比较差异有统计学意义(P均<0.05)。且观察组内轻度、中度、重度患者IGT评分比较差异有统计学意义(P均<0.05)。见表2。
2.3各指标间的相关性经Pearson相关分析显示,观察组AHI与血清HIF-1、Ngb水平呈正相关(r分别为896、0.848,P均<0.01),LSaO2与血清HIF-1和Ngb水平呈负相关(r分别为-0.568、-0.564,P均<0.01);观察组血清HIF-1、Ngb水平与IGT评分呈负相关(r分别为-0.684和-0.775,P均<0.05)。

表2 两组IGT评分比较(分,
注:与对照组比较,*P<0.05。2.4血清HIF-1、Ngb预测脑梗死合并OSAHS患者决策功能障碍的ROC曲线分析血清HIF-1、Ngb水平预测决策功能障碍的ROC曲线下面积分别为0.858、0.884。
3讨论
本研究结果显示,脑梗死合并OSAHS患者IGT评分低于对照组,且与OSAHS程度有关,说明OSAHS可以加重脑梗死导致的决策功能障碍。脑梗死后某一个脑区受到损伤,或递质代谢紊乱造成神经环路及脑区功能受限,认知功能(包括决策)障碍[7];而OSAHS低通气事件、低氧血症及睡眠结构紊乱等导致脑内特定区域如与认知功能有关的海马杏仁核等部位对氧敏感性较高,加之OSAHS脑内多种神经递质发生改变,削弱脑组织对缺血缺氧的耐受力、加重血管内皮损伤和功能障碍[8],进一步加剧脑梗死合并OSAHS时决策功能障碍。
HIF-1是调节氧稳态平衡的主要调节因子,其表达水平受细胞氧浓度的严密调控。脑梗死病理进程中,脑组织血供不足,细胞能量不足,引起HIF-1水平升高[3,4]。OSAHS患者长时间处于慢性低氧血症和高碳酸血症病理状态,可对脑血流供应造成影响,脑血流减少明显。此外,长期低氧能够刺激患者体内促红细胞生成素表达增加、血管内皮生长因子以及可溶性血管内皮细胞黏附因子-1持续释放[3,9],因而脑梗死合并OSAHS时血清HIF-1水平升高。动物实验表明,脑组织缺血缺氧时高表达的HIF-1可通过调控一氧化氮合酶基因水平、上调细胞内p53水平,从而促进相关病理基因表达及神经细胞凋亡,导致神经功能损害[10,11]。本研究结果显示,脑梗死合并OSAHS患者HIF-1水平与决策功能障碍的严重程度有关,即决策功能障碍越严重,HIF-1水平越高,说明HIF-1参与脑梗死伴OSAHS患者决策功能障碍的病理过程。
Ngb具有极强的携氧能力,被誉为神经元内的呼吸球蛋白,对氧自由基有“清道夫”作用,在脑缺血缺氧时发挥保护作用。岳红梅等[12]报道血清Ngb水平升高可用于缺氧性脑损伤的预测,与本研究结果一致,即决策功能障碍越严重,Ngb水平越高。动物实验发现,应用神经保护剂或低氧预处理的方法改善脑损伤造成的动物学习记忆障碍时,伴随动物学习或记忆能力的改善,脑内尤其是与认知密切相关脑区如海马区和皮质区Ngb水平升高[4],说明Ngb与认知损伤有关。
OSAHS反复间断性低氧,产生强烈氧化应激反应,诱导HIF-1和Ngb水平持续升高,且进一步加重脑梗死患者脑损伤,导致决策功能障碍加重。本研究结果说明,脑梗死合并OSAHS患者血清HIF-1、Ngb水平变化主要受低氧影响,二者的变化反映患者决策功能障碍。血清HIF-1、Ngb水平预测决策功能障碍的ROC曲线下面积分别为0.858、0.884,说明HIF-1、Ngb对脑梗死合并OSAHS患者决策功能障碍的发生有较好的预测价值。
因此,对血清HIF-1、Ngb进行检测,有助于早期识别脑梗死合并OSAHS患者决策功能障碍的发生,以采取有效措施预防痴呆的形成。但本研究样本量小,有待扩大样本做进一步研究。
参考文献:
[1] 翟菊萍,黄惠芳,李洁.老年人阻塞性睡眠呼吸暂停低通气综合征患者血清同型半胱氨酸的水平[J].中国老年学杂志,2013,33(6):1380-1382.
[2] 蔡凯晋.睡眠呼吸暂停综合征与痴呆的关系[J].广州医学,2007,28(7):1189-1191.
[3] 陈忠余,赵世巧,李蔚,等.睡眠呼吸暂停低通气综合征患者血清HIF-1α、VEGF、sVCM1水平的变化及意义[J].重庆医学,2013,42(5):484-486.
[4] 刘永年,俞科贤,马祁生,等.间歇性低压缺氧预处理对大鼠全脑缺血/再灌注海马CAI区Ngb和Bcl-2蛋白表达的影响[J].中国病理生理杂志,2013,29(12):2240-2244.
[5] 中华医学会神经病学分会啮血管病学组急性缺血性脑卒中诊治指南撰写.中国急性缺血性脑卒中诊治指南2010[J].中华神经科杂志,2010,43(2):146-152.
[6] 阻塞性睡眠呼吸暂停低通气综合征诊治指南(草案)[J].中华结核和呼吸杂志,2012,35(1):9-12.
[7] Nair D, Zhang SX, Ramesh V, et al. Sleep fragmentation induces cognitive deficits via nicotinamide adenine dinucleotide phosphate oxidase-dependent pathways in mouse[J]. Am J Respir Crit Care Med, 2011,184(11):1305-1312.
[8] 李振,赵忠新,黄流清,等.快速眼球运动睡眠剥夺及γ-氨基丁酸能药物干预对大鼠认知功能的影响[J].中华神经科杂志,2011,44(8):538-543.
[9] 华威,周敏,刘微.RhEPO对脑梗死后缺氧诱导因子-1α作用的研究[J].哈尔滨医科大学学报,2013,47(3): 216-219.
[10] 胡强,吴聘,陈敬寅,等.蛛网膜下腔出血大鼠早期大脑皮层低氧诱导因子HIF-1α表达与细胞凋亡相关性研究[J].浙江大学学报医学版,2014,43(1):58-65.
[11] Palmer LA, Semenza GL, Stoler MH, et al. Hpoxia induces type П NOS gene expression in pulmonary artery indothelial cells via HIF-1[J]. Am J Physiol, 1998,274(2 Pt 1):L212-219.
[12] 岳红梅,王法红,胡梅叶,等.阻塞性睡眠呼吸暂停低通气综合征患者血清脑红蛋白水平的变化与早期脑损伤的相关性[J].兰州大学学报(医学版),2010,36(4):77-78.
(收稿日期:2015-11-12)
中图分类号:R743.33
文献标志码:B
文章编号:1002-266X(2016)09-0044-03
doi:10.3969/j.issn.1002-266X.2016.09.016
通信作者:王红阳(E-mail:szg123@163.com)
基金项目:河北省教育厅重点资助项目(Zp012046);河北省卫生厅重点医学项目(2015515)。
