水芫花提取物的体外抗氧化活性和抑菌活性研究①
2016-04-14徐盛颖干晶露张桑桑闻正顺曲有乐
徐盛颖,干晶露,张桑桑,闻正顺,曲有乐
(浙江海洋学院 食品与医药学院,浙江 舟山 316000)
水芫花提取物的体外抗氧化活性和抑菌活性研究①
徐盛颖,干晶露,张桑桑,闻正顺,曲有乐
(浙江海洋学院 食品与医药学院,浙江 舟山 316000)
摘要:目的:研究红树植物水芫花(Pemphis acidula)提取物的体外抗氧化活性和抑菌活性。方法:采用不同溶剂对水芫花进行超声辅助提取,分别得到石油醚提取物、氯仿提取物、乙酸乙酯提取物、丙酮提取物、乙醇提取物、蒸馏水提取物。测定不同提取物对DPPH自由基、羟基自由基(·OH)、超氧阴离子自由基(O2-·)的清除率及还原能力,并用Vc作阳性对照,评价其抗氧化活性;以平板打孔法、光密度法衡量不同提取物对常见致病菌的抑菌活性。结果:丙酮提取物得率最高为11.92%,石油醚提取物得率最低仅为2.11%,各提取物的抗氧化活性顺序为:乙醇提取物>丙酮提取物>乙酸乙酯提取物>石油醚提取物>氯仿提取物>蒸馏水提取物,抑菌活性顺序为:丙酮提取物、乙醇提取物>蒸馏水提取物、乙酸乙酯提取物>氯仿提取物、石油醚提取物。结论:水芫花提取物有一定抗氧化活性和抑菌活性。
关键词:水芫花提取物;抗氧化活性;抑菌活性;光密度法
水芫花(学名:Pemphis acidula),为千屈菜科水芫花属小灌木,分布范围狭窄偏远,主要分布于我国台湾岛南部海岸和其他东半球热带海岸,目前处于濒危状态。水芫花常被用来制作名贵盆景,目前研究主要集中在其生长环境与分布,分类学、生殖学和遗传多样性等[1],对于其植物体内成分及药理活性研究较少[2],本文对水芫花系统溶剂提取物的抗氧化活性和体外抑菌活性进行了初探,为其后续研究奠定了基础。
1实验材料与仪器
1.1样品来源及鉴定
水芫花样品于2010年8月采自海南省西沙永兴岛,经浙江海洋学院食品与医药学院海洋药物研究所所长曲有乐教授鉴定为千屈菜科水芫花属植物水芫花Pemphis acidula 的枝茎,凭证标本存放在浙江海洋学院海洋药物综合实验室(海科楼108-2室),标本编号:水芫花20100809。
1.2试剂与仪器
试剂:无水乙醇(国药集团化学试剂有限公司,分析纯,批号:20140121)、石油醚(国药集团化学试剂有限公司,分析纯,批号:20140115)、氯仿(国药集团化学试剂有限公司,分析纯,批号:20120810)、乙酸乙酯(国药集团化学试剂有限公司,分析纯,批号:20130428)、丙酮(国药集团化学试剂有限公司,分析纯,批号:T20060815)、抗坏血酸(国药集团化学试剂有限公司,分析纯,批号:20130801)、铁氰化钾(国药集团化学试剂有限公司,分析纯,批号:F20101214)、氯化钠(国药集团化学试剂有限公司,分析纯,批号:F20080310)、Tris·HCL (国药集团化学试剂有限公司, 批号:20131212)、营养琼脂(国药集团化学试剂有限公司,生化试剂,批号:20111228)、蛋白胨(国药集团化学试剂有限公司,生化试剂,批号:F20101012)、牛肉浸膏(国药集团化学试剂有限公司,生化试剂,批号:20131212)、红霉素软膏(安徽新和成皖南药业有限公司,批号:130709)。
仪器:中药粉碎机(DFY-400,温岭市林大机械有限公司)、超声波清洗机(WF-180E,宁波海曙五方超声波设备有限公司)、旋转蒸发仪(N-1100,上海爱朗仪器有限公司)、电子天平(BSA323S,赛多利斯科学仪器(北京)有限公司)、冷冻干燥机(FD-1E,北京德天佑科技发展有限公司)、低速离心机(TD5K,长沙东旺实验仪器有限公司)、紫外分光光度计(UV-1100,上海美谱达仪器有限公司)、超净台(JB-CJ-1FXS,苏州佳宝净化工程设备有限公司)、恒温培养箱(LHS-250HC,上海慧泰仪器制造有限公司)、全温培养摇床(HZQ-B,金坛市华城开元实验仪器厂)、酶标仪(SM800,上海永创医疗器械有限公司)。实验菌种:金黄色葡萄球菌、大肠杆菌、副溶血孤菌,实验菌种均为浙江海洋学院食品与医药学院水产加工工程实验室提供。
1.3实验方法
1.3.1材料预处理
水芫花→粗粉→烘干→粉粹→过筛→保存备用。
1.3.2系统溶剂提取物的制备
取粉碎的水芫花粉末20g至500mL锥形瓶中,依次加入各提取溶剂400mL,在50 ℃,80W功率条件下超声45min,重复提取3次,离心取上清液混合,用旋转蒸发仪减压浓缩,各浓缩液取液经减压浓缩得石油醚浸膏、氯仿浸膏、乙酸乙酯浸膏和水提浸膏,将上述浸膏水浴挥干溶剂,称量重量,计算浸膏得率,放干燥器保存备用[3]。
1.3.3不同溶剂提取物的体外抗氧化活性研究1.3.3.1供试品和阳性对照品溶液的配制
准确称量0.25g各溶剂提取浸膏和Vc,分别用无水乙醇溶解于50mL的容量瓶中,经半量稀释法分别制备成6个浓度梯度的各样品溶液和Vc阳性对照品溶液,浓度梯度分别为:5.000mg·mL-1、2.500mg·mL-1、1.250mg·mL-1、0.625mg·mL-1、0.313mg·mL-1、0.156mg·mL-1。
1.3.3.2对DPPH自由基清除率的测定[4]
用移液枪移取不同浓度的各供试品溶液1mL加入10mL离心管中,再加1mL的320μmol·L-1的DPPH-乙醇溶液,用无水乙醇稀释至4mL充分混匀,常温下避光反应30min后,在517nm处测吸光度A1,以无水乙醇代替供试品溶液测量A0,计算公式如下:

式中:A0-未加入抗氧化物质时测得的溶液平均吸光度值;
A0-加入抗氧化物质后测得的溶液平均吸光度值。
1.3.3.3对羟基自由基(·OH)清除率的测定
取10mL离心管分别加入6mmol·L-1FeSO4溶液、6 mmol·L-1水杨酸溶液和供试品溶液各1mL,混匀,最后加入1mL 6 mmol·L-1H2O2启动反应,常温下避光静置30min后于510nm处测定吸光度A1,以蒸馏水和无水乙醇混合物代替供试品溶液测定A0[5,6]。羟基自由基清除率计算公式同上。
1.3.3.4对超氧阴离子自由基(O2-·)清除率的测定
操作顺序如下:取4.5mL Tris-HCl 缓冲溶液(pH=8.2)→25℃静置30min→加入1mL供试品溶液→加入0.4mL邻苯三酚溶液→混匀→30℃水浴5min→加入1mL 8mol/L Hcl→终止反应→299 nm测定吸光度A1、以0.1mol·L-1HAc代替供试品溶液测定A0[7]。按2.3.2项下公式计算清除率。
1.3.3.5还原能力的测定
用移液枪移取1mL各供试品溶液于10mL离心管中,分别加入2.5mL的磷酸缓冲溶液(pH=6.6)和2.5mL 1%铁氰化钾溶液,混匀,于50℃水浴反应20min,再加入2.5mL的10%三氯乙酸溶液,混匀,低速离心10min,移取上清液、蒸馏水、0.1%FeCl3(按上清液:蒸馏水:0.1%FeCl3=5:5:1)于玻璃试管中常温反应5min,于700nm处测定吸光度,以吸光度大小来衡量各供试品的还原能力[8]。
1.3.4水芫花提取物抑菌活性研究
1.3.4.1菌悬液的制备
用接种环取少量细菌于装有50mL液体牛肉膏蛋白胨培养基中,37 ℃下摇床培养24h,涂布平板,检测备用[9]。
1.3.4.2提取物抑菌活性测定
分别取不同溶剂萃取物,用二甲亚砜溶解并稀释至质量浓度为100 mg·mL-1的样品溶液,在每个直径为9cm培养皿中接种各菌液150μL,将已灭菌的不烫手的营养琼脂倒平板,与菌液混合均匀。待培养基完全凝固后,用0.8cm打孔器在培养皿上等距离打三个孔,除去孔内培养基。用移液枪往各孔内注入120μL的样品溶液,空白对照组各孔内注入等量的二甲亚砜溶液,各组均置37℃,70%湿度条件下培养24 h,十字交叉法测定抑菌圈直径[10,11]。
1.3.4.3光密度法测定不同提取物的最小抑菌浓度(MIC)
根据2.4.2实验结果,选择丙酮提取物、无水乙醇提取物和蒸馏水提取物3种极性较大的提取物,进行抑菌率实验,取一定量的质量浓度为100mg·mL-1的各提取物溶液(用0.22μm滤膜除菌),与高压灭菌的肉汤液体培养基等体积混合,半量稀释法制备浓度梯度如下的各样品:50mg·mL-1、25mg·mL-1、12.5mg·mL-1、6.25 mg·mL-1、3.125mg·mL-1、1.563mg·mL-1取10μL各菌悬液与200μL各样品溶液于96孔板混合,以相同浓度的红霉素软膏溶液为阳性对照,37℃培养24h,以肉汤液体培养基和生理盐水混合液为空白调零,测定样品在630nm处的吸光度值(A样品),同时测定样品空白和对照组的吸光度值。样品空白(A空白)不加菌悬液,其余条件相同;对照组(A对照)用生理盐水代替各提取物,其余条件相同。每个样品平行3次,计算各提取物的抑菌率[12~14]。计算公式如下:

2结果
2.1系统溶剂对水芫花的萃取率
见表1。

表1 系统溶剂对水芫花的提取率(%)
由表1 可以看出不同极性的各溶剂对于水芫花提取率差异较大,丙酮和无水乙醇对水芫花的提取率较高,分别达11.92%和11.26%,蒸馏水次之,其次为氯仿和乙酸乙酯,石油醚提取率最低,提取率仅为2.11%。
2.2不同溶剂提取物的体外抗氧化活性2.2.1各提取物对DPPH自由基的清除作用
见图1。

图1 各提取物对DPPH自由基的清除作用
由图1 可以看出,各溶剂提取物对DPPH 自由基的清除能力强弱不同,在实验浓度范围内,各提取物随着浓度的增加,对DPPH自由基的清除能力也不断增强,表现出较好的量效关系,其中乙醇提取物、丙酮提取物和乙酸乙酯提取物清除DPPH 自由基的能力较强和 VC相近,并且其浓度在达1.250mg·mL-1之前,对于DPPH 自由基的能力随浓度变化较大,在浓度为1.250mg·mL-1~5.000mg·mL-1范围内,对于DPPH 自由基的能力随浓度略有变化但不明显;石醚和氯仿提取物对于DPPH 自由基的能力较前面三者次之,且对于DPPH 自由基的能力随浓度变化略微平缓,水提物清除DPPH 自由基的能力最差,随浓度变化趋势与石醚和氯仿提取物相近。
2.2.2各提取物对羟基自由基(·OH)的清除作用
见图2。

图2 各提取物对羟基自由基的清除作用
羟基自由基(·OH)是已知的最活泼的活性氧自由基,也是毒性最大的自由基,由图2 可以看出,各溶剂提取物对羟基自由基(·OH)均有一定的清除作用,但与阳性对照Vc组相比差距较大,各提取随浓度变化物对羟基自由基(·OH)清除率不断增加,但变化趋势并不是太明显,尤其是蒸馏水提取物对羟基自由基(·OH)清除率随浓度变化最为平缓,各提取物乙醇和丙酮提取物对羟基自由基(·OH)的清除作用最大,在实验浓度范围内分别达73.61%和69.23%,氯仿提取物、石油醚提取物、乙酸乙酯提取物次之,水提取物清除能力最差,最大仅为28.75%。
2.2.3各提取物对超氧阴离子自由基(O2-·)的清除作用
见图3。
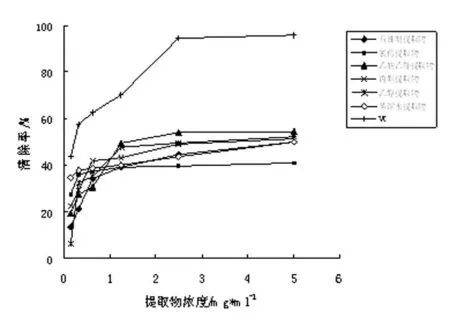
图3各提取物对超氧阴离子自由基的清除作用
由图3 可以看出,各溶剂提取物对超氧阴离子自由基(O2-·)均有一定的清除作用,但与VC相比有一定的差距,各溶剂提取物对超氧阴离子自由基(O2-·)的清除率与浓度存在一定的量效关系,且对超氧阴离子自由基(O2-·)清除率随浓度变化趋势及其相近,在浓度达1.250mg·mL-1前,对超氧阴离子自由基(O2-·)清除率随浓度变化较大,之后变化趋势较为平缓。
2.2.4各提取物的还原能力
见图4。

图4 各提取物的还原能力
由图4 可以看出,各溶剂提取物随浓度的不断增加,还原力也显著增强,表现出较好的量效关系,且各变化曲线较为分散,基本没有出现变化曲线交叉或重叠现象,其中乙醇提取物和丙酮提取物还原能力最强,且随浓度不断增加,OD值变化较大,在浓度超过2.5mg·mL-1时 与VC的还原能力相差不大;乙酸乙酯提取物还原能力较前两者次之,但还原能力随浓度的变化趋势与其相近,石油醚提取物、氯仿提取物、蒸馏水提取物还原能力随浓度的变化趋势交前面三者较为平缓;各溶剂提取物的还原能力大小依次为:乙醇提取物>丙酮提取物>乙酸乙酯提取物>石油醚提取物>氯仿提取物>水提取物。
2.3水芫花提取物抑菌活性
2.3.1提取物抑菌活性

图5 水芫花系统溶剂萃取物对供试菌的抑菌圈直径(n=3)
由图5 可知,各提取物对3种供试菌均有一定的抑制作用,其中乙醇提取物、丙酮提取物对各供试菌的抑菌圈直径最大;水提取物与乙酸乙酯提取物的抑菌圈次之;乙酸乙酯提取物对副溶血孤菌的抑菌圈直径明显强于对大肠杆菌和金黄色葡萄球菌的抑制作用;石油醚提取物和氯仿提取物对各供试菌的抑菌圈直径最小。
2.3.2不同提取物最低抑菌浓度(MIC)测定
见表2。

表2 最低抑菌浓度(MIC)测定结果(n=3,%)
注:- 表示没有抑菌作用。
由表2 可知,各提取物的抑菌活性明显小于阳性对照组,各提取物对三种供试菌的抑制作用,随浓度的降低而降低,呈现良好的量效关系;同时可以看出,丙酮提取物、无水乙醇提取物对于大肠杆菌的最小抑菌浓度在6.250~3.125mg·mL-1,蒸馏水提取物对于大肠杆菌的最小抑菌浓度在6.250~3.125mg·mL-1;丙酮提取物对金黄色葡萄球菌的最小抑菌浓度在6.250~3.125mg·mL-1,无水乙醇提取物对金黄色葡萄球菌的最小抑菌浓度<1.563mg·mL-1,蒸馏水提取物对金黄色葡萄球菌的最小抑菌浓度在3.125~1.563mg·mL-1;同理可以看出,丙酮提取物、无水乙醇提取物、蒸馏水提取物对副溶血孤菌的最小抑菌浓度分别为在3.125~1.563mg·mL-1、<1.563 mg·mL-1,<1.563mg·mL-1。
3讨论
本文应用不同溶剂对水芫花进行系统提取,并对各提取物进行了体外抗氧化和体外抑菌活性研究,由实验结果可知,各溶剂对水芫花的提取率顺序依次为:丙酮提取>乙醇提取>蒸馏水提取>乙酸乙酯提取>氯仿提取>石油醚提取;各提取物的抗氧化能力均小于阳性对照品Vc的抗氧化能力,且综合比较各提取物对DPPH自由基、羟基自由基(·OH)、超氧阴离子自由基(O2-·)及其还原能力,表明其抗氧化活性顺序依次为:乙醇提取物>丙酮提取物>乙酸乙酯提取物>石油醚提取物>氯仿提取物>蒸馏水提取物;在抑菌活性实验中,各提取物的抑菌活性顺序为:丙酮提取物、乙醇提取物>蒸馏水提取物、乙酸乙酯提取物>氯仿提取物、石油醚提取物;丙酮提取物,乙醇提取物抑菌圈最大,其原因可能是其抑菌效果较好且极性较大在培养基中的扩散速度快,而蒸馏水提取物活性次之,其原因可能是尽管极性较大,扩散速度快,但抑菌活性稍弱于前面两者,石油醚提取物和氯仿提取物对各供试菌的抑菌圈直径最小,其原因可能是抑菌活性较低或因极性较小在培养基中扩散程度较低所致;在最低抑菌浓度(MIC)实验中,虽然丙酮提取物、无水乙醇提取物对于大肠杆菌的最小抑菌浓度均在6.250~3.125mg·mL-1,但在6.250mg·mL-1时无水乙醇提取物明显大于丙酮提取物对大肠杆菌的抑菌率,所以无水乙醇提取物最低抑菌浓度应该小于丙酮提取物的最低抑菌浓度。
参考文献:
[1]张玉兰, 王开发. 我国某些红树植物花粉形态研究及其古环境意义[J]. 海洋地质与第四纪地质, 2002, 22(4): 29-35
[2]Samidurai K. Mosquito larvicidal and ovicidal properties of Pemphis acidula Frost. (Lythraceae) against Culex tritaeniorhynchus Giles and Anopheles subpictus Grassi (Diptera: Culicidae)[J]. Asian Pacific Journal of Tropical Biomedicine, 2012, 2(3):1862-1866
[3]Lou S N, Hsu Y S, Ho C T. Flavonoid compositions and antioxidant activity of calamondin extracts prepared using different solvents [J]. Journal of Food and Drug Analysis, 2014
[4]张燕, 王红彦, 刘君星,等.柠檬百里香挥发油体外抗氧化作用研究[J]. 黑龙江医药科学,2014, 37(6):88-89
[5]李姣, 王珂, 王瑞坡, 等. 芦笋多糖提取纯化工艺及其体外抗氧化研究[J]. 食品科学, 2011, 32(8):65-69
[6]武忠伟, 许桂芳, 曹蓬勃, 等. 虫草与富硒虫草多糖的体外抗氧化活性[J]. 食品科学, 2011, 32(9): 76-78
[7]张少君,罗时旋,赵 稷,等. 关黄柏中总黄酮的提取工艺及抗氧化活性研究[J]. 黑龙江医药科学,2015,38(3):11-13
[8]潘伟, 刘瑞娜, 章炉军, 等. 猴头菌提取物抗氧化活性研究[J]. 食用菌学报, 2012, 19(2): 95-99
[9]Krishnaraj C, Jagan E G, Rajasekar S, et al. Synthesis of silver nanoparticles using Acalypha indica leaf extracts and its antibacterial activity against water borne pathogens [J]. Colloids and Surfaces B: Biointerfaces, 2010, 76(1):50-56
[10]刘文朵, 于新, 刘淑宇, 等. 马尾松针系统溶剂提取物的抑菌活性比较研究[J]. 中国食品学报, 2013 (9): 133-138
[11]陈佳佳, 刘凡, 廖森泰, 等. 桑叶提取物抑菌活性及抑菌稳定性研究[J]. 食品工业科技, 2012, 33(9): 88-91
[12]肖会敏, 何悦, 王四旺, 等. 连翘挥发油体外抑菌实验研究[J]. 内蒙古中医药, 2011, 30(15): 99-100
[13]宋茹. 黄鲫 (Setipinnataty) 蛋白抗菌肽的制备及抗菌作用等生物活性研究 [D]. 中国海洋大学, 2011.
[14]Dionysius D A, Milne J M. Antibacterial peptides of bovine lactoferrin: purification and characterization [J]. Journal of Dairy Science, 1997, 80(4): 667-674
[15]王敏,张宇,张宏莲,等.水飞蓟茎叶化学成分研究[J] .黑龙江医药科学,2010,33(1):78-80
Vitro studies on antioxidant and antimicrobial activities of extracts from pemphis acidula
XUSheng-ying,GANJing-lu,ZHANGSang-sang,WENZheng-shun,QUYou-le
(The School of Food Science and Pharmacy, Zhejiang Ocean University, Zhou Shan 316000, China)
Abstract:Objective:To study the preliminary antioxidant and antimicrobial activities of extracts from Pemphis acidula. Methods: Pemphis acidula were successively extracted by using different solvents to provide petroleum ether extract, chloroform extract, ethyl acetate extract, acetone extract, ethanol extract, water extract. Different extracts on DPPH radical, hydroxyl radical, superoxide anion free radical scavenging ability and reducing power were analyzed, and it was compared with VC to evaluate its antioxidant activity and then antibacterial activity was performed by the methods of disk diffusion and spectrophotometric method. Result: The acetone extract was the highest to 11.92% and the petroleum ether extract had the lowest rate of only 2.11%. The order of antioxidant activity of the extracts: ethanol extract >acetone extract >ethyl acetate extract >petroleum ether extract >chloroform extract >water extract. The order of antibacterial activity: acetone extract, ethanol extract >water extract, ethyl acetate extract > chloroform extract, petroleum ether extract. Conclusion: Pemphis acidula extracts have the antioxidant activity and antibacterial activity.
Key words:pemphis acidula extracts; antioxidant activity; antibacterial activity; spectrophotometric method
(收稿日期:2015-10-20)
中图分类号:R285.5
文献标识码:A
文章编号:1008-0104(2016)01-0041-04
作者简介:徐盛颖(1994~)女,浙江余姚人,在校本科生。通讯作者:曲有乐(1960~)男,黑龙江佳木斯人,学士,教授,硕士研究生导师。E-mail:YouLe1960@163.com。
基金项目:浙江省大学生科技创新项目,编号:2014R411015。
