鳄胆素与阿霉素联合应用对肝癌SMMC-7721细胞凋亡的影响
2016-04-12丁玉梅翁梦婷毛云子邓轶韬陈清西
丁玉梅,翁梦婷,毛云子,董 欣,邓轶韬,陈清西
(厦门大学生命科学学院,福建厦门361102)
鳄胆素与阿霉素联合应用对肝癌SMMC-7721细胞凋亡的影响
丁玉梅,翁梦婷,毛云子,董欣,邓轶韬,陈清西*
(厦门大学生命科学学院,福建厦门361102)
摘要:研究了鳄胆素( crocodile choline,Cro)联合阿霉素( doxorubicin,Dox)对人肝癌细胞SMMC-7721凋亡的诱导作用.用鳄胆素( 15 μg/mL)和阿霉素( 0.4 μg/mL)单独或联合作用SMMC-7721细胞后,测定了培养基中乳酸脱氢酶( LDH)的渗漏率,吖啶橙/溴化乙锭( AO/EB)荧光染色观察细胞的凋亡形态,流式细胞仪检测细胞内活性氧( ROS)水平和细胞线粒体膜电位变化,免疫印迹( Western blot)检测凋亡相关蛋白细胞色素C( CytC)及p53的表达量变化.结果(图3)显示鳄胆素和阿霉素单独或者联合作用都能促进细胞中LDH的渗漏,与对照组相比,联合作用组有极显著差异( p<0.01),其作用呈时间依赖性.经药物处理后,AO/EB荧光染色发现细胞核出现明显的凋亡特征.细胞中ROS水平显著升高,同时细胞线粒体膜电位降低.Western blot结果显示单独用药组及联合用药组都能上调促凋亡蛋白p53的表达,促进凋亡蛋白CytC由线粒体释放到胞质中,联合用药组作用效果更为显著.以上结果表明鳄胆素和阿霉素单独或联合作用都对人肝癌SMMC-7721细胞凋亡有诱导作用,且以联合用药组作用效果更加显著.两药联合作用可能通过线粒体介导的内源性途径诱导细胞发生凋亡.本研究有望为肝癌的联合用药治疗提供理论依据.
关键词:鳄胆素;阿霉素;联合用药;肝癌;细胞凋亡;线粒体途径
肝癌是人类常见恶性肿瘤之一,在恶性肿瘤发病中男性居第5位,女性居第7位;致死率居恶性肿瘤第3位,仅次于肺癌和胃癌[1].乙肝是肝癌的主要诱因之一,且每年的肝癌患者数均有增加[2].手术切除仍是提高肝癌患者生存率的主要方法,但多数患者会出现术后复发、转移等,需要使用全身化疗法辅助治疗[3-4].化疗是一种全身性治疗方法,对原发灶、转移灶均有治疗作用.阿霉素是临床肝癌的常用化疗药物,单药有效率能达到16%[5],但同多数化疗药物一样选择性差,对正常细胞有杀伤作用,毒副作用很强,容易产生耐受性,在临床应用中受到了一定的限制.因此,寻求新的更有效的肝癌治疗方法和抗肝癌药物组方是现在医药界面临的重要挑战.本实验室前期研究[6]发现鳄胆素、阿霉素单独使用对人肝癌SMMC-7721细胞增殖有明显的抑制作用,两者联合使用有协同效果.鳄胆素( 15 μg/mL)与阿霉素( 0.4 μg/mL)联合使用不仅能抑制肝癌SMMC-7721细胞的增殖及细胞的集落形成能力,还能使细胞周期发生S期阻滞,诱导细胞凋亡.本研究拟以肝癌SMMC-7721细胞为研究对象,用筛选得到具有协同作用的鳄胆素和阿霉素联合组方作用于SMMC-7721细胞,探讨两者联合作用诱导肝癌细胞凋亡的可能分子机理.
1材料与方法
1. 1材料
鳄胆素为本实验室从暹罗鳄胆汁中经皂化、酸化、萃取等步骤提取分离得到的白色粉末,是多种胆汁酸的混合物,-20℃避光保存,临用前加入二甲亚砜( DMSO)溶解,0.22 μm微孔滤膜过滤除菌.阿霉素购自上海生工生物工程有限公司; RPMI-1640培养基购自Gibco公司;胎牛血清购自Hyclone公司;荧光探针2',7'-二氯荧光素二乙酸酯( DCFH-DA)和荧光染料罗丹明123( Rh123)购自Sigma公司;吖啶橙( AO)和溴化乙锭( EB)购自Amresco公司;人肝癌SMMC-7721细胞由厦门华侨亚热带植物引种园惠赠.
1. 2实验方法
1. 2. 1细胞培养及分组
肝癌SMMC-7721细胞在含10%(体积分数)胎牛血清、1%(体积分数)双抗( 100 U/mL青霉素和100 μg/mL链霉素)的RPMI-1640培养基( pH 7.2)上,37℃,5%(体积分数) CO2中培养.本实验室前期研究已筛选出鳄胆素与阿霉素联合使用具有协同作用的组方,为15 μg/mL鳄胆素+0.4 μg/mL阿霉素[6],因此本实验分为对照组、鳄胆素单用药组( 15 μg/mL)、阿霉素单用药组( 0.4 μg/mL)和联合用药组( 15 μg/mL鳄胆素+0.4 μg/mL阿霉素).
1. 2. 2普通光镜下观察细胞形态
取对数生长期的肝癌SMMC-7721细胞接种于6孔板中培养过夜,加入药物处理48 h后,在倒置显微镜下观察细胞形态.
1. 2. 3乳酸脱氢酶( LDH)活力测定
用药物分别处理SMMC-7721细胞24和48 h后,取培养液上清按照LDH试剂盒(南京建成生物技术有限公司)说明书进行操作并在450 nm处测定吸光度( OD).酶活力单位的定义:每100 mL待测样品中的LDH在37℃与底物2,4-二硝基苯肼作用15 min,生成1 μmol丙酮酸即为一个LDH活力单位.细胞活力以培养基中LDH的酶活大小表示,LDH酶活越高表明细胞受损越严重,细胞活力越差.

1. 2. 4 AO/EB荧光染色
取对数生长期的肝癌SMMC-7721细胞接种于含多聚赖氨酸处理过的盖玻片的6孔板中,细胞贴壁后加入药物处理48 h.取长有细胞的爬片,磷酸盐缓冲液( PBS)清洗3次,固定10 min; PBS再洗3次,滴加等体积预混的AO/EB染液(质量浓度均为10 μg/mL),室温避光孵育10 min,PBS洗3次后,晾干,封片,在荧光显微镜下观察并拍照.
1. 2. 5细胞内活性氧( ROS)水平的测定
将培养至对数生长期的肝癌SMMC-7721细胞接种于直径60 mm的培养皿中,细胞贴壁后加入药物处理48 h.离心( 800 r/min,5 min,下同)收集贴壁和悬浮细胞,PBS洗涤,再次离心,弃上清.加入终浓度为10 μmol/L的DCFH-DA完全培养液重悬细胞,37℃避光孵育30 min,离心,弃上清;再加入1 mL PBS洗涤,离心后吸去上清;加入1 mL PBS重悬细胞,300目筛绢过滤,Fortessa型流式细胞仪检测,Flowjo-V10软件进行数据分析.
1. 2. 6线粒体膜电位的改变
取对数生长期的肝癌SMMC-7721细胞接种于6孔板中,细胞贴壁后加入药物作用48 h.培养结束后PBS洗2次,滴加1 mg/mL Rh123染液,室温避光孵育5~10 min,PBS洗涤,在倒置荧光显微镜下观察并拍照.
1. 2. 7免疫印迹( Western blot)检测
取对数生长期的肝癌SMMC-7721细胞,经药物处理48 h后,收集贴壁和悬浮的所有细胞,加入预冷的细胞裂解液和蛋白酶抑制剂,混匀后于冰上裂解30 min;低温高速离心( 4℃,10 000 r/min,10 min),取上清,用BCA蛋白浓度测定试剂盒(生工生物工程股份有限公司)测定总蛋白浓度.
每管加入适量5×上样缓冲液,沸水中煮沸5 min使蛋白变性,取等量蛋白样品进行电泳.然后转聚偏氟乙烯( PVDF)膜,5%(质量分数)脱脂牛奶封闭1 h; TBST( 10 mmol/L Tris-HCl ( pH 7.2),150 mmol/L NaCl,0.05%(体积分数) Tween 20)缓冲液洗膜3次,每次10 min,一抗孵育过夜;相同方法洗膜后,加入辣根过氧化物酶( HRP)标记的二抗孵育1 h;再洗膜后滴加化学发光底物于PVDF膜上,在暗室中进行胶片曝光、显影和定影.
2结果与分析
2. 1鳄胆素与阿霉素联用对细胞形态的影响
鳄胆素与阿霉素单独或联合作用SMMC-7721细胞48 h后,普通倒置光学显微镜观察结果如图1所示:对照组细胞呈梭形、不规则多边形,细胞生长均匀饱满;鳄胆素单用药组贴壁细胞数量减少,细胞形态变得不规则,半数细胞变成长梭形,部分细胞变圆;阿霉素单用药组贴壁细胞数量大量减少,细胞呈单个生长,说明细胞的增殖受到了比较明显的抑制,且细胞内颗粒、空泡明显增多;联合用药组几乎没有细胞保持正常形态,多数细胞皱缩、变圆、体积缩小,有较多细胞从皿壁脱落,悬浮于培养液中.用药组与对照组相比细胞形态都有明显变化,并且联合用药组更为显著,说明鳄胆素和阿霉素联合具有协同作用.

图1普通光镜下观察鳄胆素与阿霉素单独或联合作用后SMMC-7721细胞的形态学变化Fig.1 Effect of Cro with or without Dox on the morphologic changes of SMMC-7721 cells under ordinary optical microscope
2. 2鳄胆素与阿霉素联用对细胞LDH渗漏的影响
LDH存在于正常细胞的细胞质中,是机体能量代谢中的一种重要的酶.一旦细胞膜受损,LDH被释放到细胞外.通过检测细胞培养基上清中LDH活性,可以判断细胞受损程度.
LDH活性测定结果如图2所示:药物作用24 h后,与对照组相比,阿霉素单用药组的LDH活性无明显改变,鳄胆素单用药组出现了显著差异( p<0.05),而联合用药组出现了极显著性差异( p<0.01),酶活比对照组高132.75%; 48 h后联合用药组与对照组相比差异也极显著( p<0.01),LDH酶活比对照组增加了112.04%.由此可以看出,联合用药组能显著增加由于细胞损伤引起的LDH渗漏.
2. 3 AO/EB染色观察细胞凋亡
GLONASS L1OC信号采用短时相关结合FFT算法实现捕获,捕获的结构图如图5所示。该捕获结构采用N个短时相关支路来实现时域的并行,图中虚线所示。
AO和EB是两种不同的荧光核酸染料: AO能透过细胞膜完整的细胞,嵌入细胞核DNA,使之发出明亮的绿色荧光; EB只能透过细胞膜破损的细胞,与细胞核DNA结合,发出橘红色荧光.
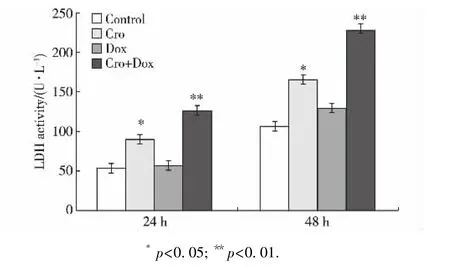
图2鳄胆素与阿霉素单独或联合作用对SMMC-7721细胞中LDH渗漏的影响Fig.2 Effect of Cro with or without Dox on the releasing of LDH in SMMC-7721 cells
鳄胆素与阿霉素单独或联合作用SMMC-7721细胞48 h后,经AO/EB双染色观察,结果(图3)显示:对照组细胞呈均匀的绿色荧光;鳄胆素单用药组细胞核固缩,部分细胞核可见致密浓染的橙黄色荧光;阿霉素单用药组细胞形态略变圆,边缘不清晰,部分细胞核染色发出橙色至橘红色荧光;联合用药组细胞密度急剧减少,发橙色、橘红色荧光,凋亡特征十分明显.以上结果表明,鳄胆素和阿霉素都能诱导细胞凋亡,而两药联合作用效果显著高于单用药.
2. 4细胞内ROS的变化
荧光探针DCFH-DA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成2',7'-二氯荧光素双酚( DCFH) ; DCFH不能透过细胞膜,从而使探针很容易被装载到细胞内.细胞内的ROS可以氧化无荧光的DCFH生成有荧光的二氯荧光素( DCF),检测DCF的荧光强度就可以反映细胞内ROS的水平.
鳄胆素和阿霉素单独或联合作用SMMC-7721细胞24 h后,对细胞进行DCFH-DA荧光染色.流式细胞仪检测结果(图4)表明:阿霉素单用药组中ROS水平升高的细胞比例( P2)增加;两药联合后增加更为显著,与对照组相比,联合用药组P2增加了4.5倍.以上结果表明鳄胆素与阿霉素联合作用诱导肝癌细胞的凋亡可能与细胞内ROS的积累有关.
2. 5线粒体膜电位的改变
Rh123是一种可透过细胞膜的阳离子荧光染料,可以指示线粒体跨膜电位.Rh123在正常细胞中能够依赖线粒体膜电位进入线粒体基质,荧光强度减弱或粒体膜通透性改变,引起线粒体跨膜电位的崩溃,Rh123从线粒体中被重新释放出来,继而发出强黄绿色荧光.因此,可通过检测细胞内荧光信号的强弱来判断细胞线粒体膜电位的变化和凋亡的发生.

图3 AO/EB染色观察鳄胆素与阿霉素单独或联合作用后SMMC-7721细胞的凋亡情况Fig.3 Effect of Cro with or without Dox on the apoptosis changes of SMMC-7721 cells by staining with AO/EB

图4鳄胆素与阿霉素单独或联合作用对SMMC-7721细胞内ROS水平的影响Fig.4 Effects of Cro with or without Dox on the ROS level in SMMC-7721 cells
消失;在细胞发生凋亡时,线粒体膜完整性被破坏,线
肝癌细胞经药物处理24 h后,Rh123染色,在荧光显微镜下观察,结果(图5)发现:对照组细胞线粒体分布均匀,形态一致,发出弱的绿色荧光;鳄胆素单用药组细胞数量减少,少数细胞线粒体发出强的黄绿色荧光,说明细胞可能正在经历线粒体膜电位的改变;阿霉素单用药组的细胞,线粒体形态改变较大,多分布在核周,呈团块状,发出强的黄绿色荧光;联合用药组的细胞线粒体分布与阿霉素单用药组类似,但是数量明显稀少.上述现象说明两药联合作用对细胞线粒体损伤程度最大,对线粒体膜电位的影响远超于单用药,具有协同作用.

图5 Rh123染色观察鳄胆素与阿霉素单独或联合作用对SMMC-7721细胞线粒体跨膜电位的影响Fig.5 Changes of membrane potential of mitochondrion after treated with Cro with or without Dox for 24 h by staining with Rh123
2. 6凋亡相关蛋白p53和细胞色素C( CytC)表达的变化
p53基因是一类重要的肿瘤抑制基因,在细胞凋亡进程中发挥着重要作用.大量研究[7-8]表明p53蛋白既能促进促凋亡因子转录,也能抑制抗凋亡因子转录.还有研究发现p53蛋白表达增加能使细胞内ROS水平升高,从而导致线粒体通路介导的细胞凋亡[9].线粒体中CytC的释放是细胞凋亡过程中的关键步骤.线粒体膜通透性增高能引发CytC的释放,同时Bcl-2蛋白家族对其释放也有调控作用.因此,本研究进而探讨以上诸多因素改变后对SMMC-7721细胞中p53、CytC蛋白表达的影响.
Western blot检测结果如图6所示:对照组细胞质中有少量CytC蛋白;鳄胆素单用药组中,CytC蛋白的释放量有所增加;阿霉素单用药组中,CytC蛋白的释放量大量增加,与对照组相比差异显著;两药联合组中,释放到细胞质中的CytC蛋白量也显著增加,较单用药组更为明显.p53蛋白在对照组中几乎没有表达;鳄胆素单用药组中有少量的p53蛋白;阿霉素单用药组中,p53蛋白表达量增加;两药联合组中,p53蛋白表达量较单用药组有显著增加.上述结果与线粒体膜电位变化的结果一致.

图6鳄胆素与阿霉素单独或联合作用对SMMC-7721细胞中p53、CytC蛋白表达的影响Fig.6 The effect of Cro with or without Doxon the protein levels of p53 and CytC
3讨论
肝癌是一种常见的恶性肿瘤,发病率高,治疗困难.早期肝癌比较有效的治疗方法是手术治疗,但由于肝癌早期症状不明显,当患者发现患病时已到中晚期,错过了最佳治疗时机.化疗在肝癌的治疗中占有非常重要的地位.联合化疗是采用两种或两种以上的化疗药物联合使用,目的在于增强疗效,降低毒副反应及耐药性[10].本实验室前期研究[6]发现,鳄胆素与阿霉素联合作用对肝癌SMMC-7721细胞增殖有较强的抑制作用,同时能使细胞周期发生S期阻滞.在此基础上,本文探讨了鳄胆素与阿霉素联合作用对SMMC-7721细胞凋亡的影响及可能的分子机制.
鳄胆素、阿霉素单独或联合处理后,细胞形态发生明显变化.AO/EB荧光染色观察发现药物处理后部分细胞发橘红色荧光,展现出明显的凋亡特征,且联合用药组效果更显著;细胞LDH的渗漏经联合药物处理大幅增加,表明细胞受到损伤.
线粒体是细胞能量代谢的中心,细胞凋亡会导致其正常功能的丧失.ROS是生物代谢过程中产生的一类性质活泼的物质,能导致蛋白质、DNA等氧化损伤,诱发细胞凋亡.细胞内ROS的累积可导致线粒体膨大,达到一定水平将激活线粒体上非特异性的通透转运孔道( PTP)开放,使线粒体跨膜电位降低,CytC从内膜脱落并释放到细胞质中[11].CytC的释放是线粒体凋亡路径的主要步骤,在dATP/ATP存在的情况下,从线粒体释放的CytC与凋亡蛋白酶活化因子Apaf1形成多聚复合体,激活Caspase级联反应,进入线粒体介导的内源性凋亡途径[12].流式细胞仪检测细胞内ROS水平结果发现,鳄胆素与阿霉素联合作用于SMMC-7721细胞后,能显著升高细胞内的ROS水平;同时采用Rh123染色,发现联合用药能降低线粒体膜电位.由此推测,鳄胆素与阿霉素联合用药能对SMMC-7721细胞产生氧化损伤,使线粒体膜通透性改变,发生线粒体膜电位崩溃,以致凋亡因子CytC释放到胞质中,启动细胞凋亡程序.
研究发现定位于线粒体上的转录因子p53能与Bcl-2家族蛋白Bax直接相互作用,两者结合产生促凋亡的结构构象;另外这种相互作用还能引起Bax的多聚化,导致线粒体通透性改变,使促凋亡因子(如CytC)释放到细胞质中[13].鳄胆素与阿霉素联合用药能显著上调p53蛋白和Bax蛋白[6]的表达,可能加速CytC释放,进而加速细胞凋亡.
综上结果,鳄胆素与阿霉素联合作用诱导肝癌SMMC-7721细胞凋亡,可能是通过线粒体介导的内源性途径发挥作用.在外界条件(如药物)刺激下,细胞内ROS水平升高,线粒体膜电位降低,导致线粒体膜通透性改变,凋亡信号蛋白CytC释放到胞质中,引发细胞凋亡.本论文研究结果有望为临床肝癌药物联合治疗提供理论支持.
参考文献:
[1]FERENCI P,FRIED M,LABRECQUE D,et al.Hepatocellular carcinoma ( HCC) : a global perspective [J].Journal of Clinical Gastroenterology,2010,44 ( 4) : 239-245.
[2]JEMAL A,BRAY F,CENTER M M,et al.Global cancer statistics[J].CA: A Cancer Journal for Clinicians,2011,61 ( 2) : 69-90.
[3]HAO M,LIN H,CHEN Q,et al.Efficacy of transcatheter arterial chemoembolization combined with cytokine-induced killer cell therapy on hepatocellular carcinoma: a compar-ative study[J].Chinese Journal of Cancer,2010,29 ( 2) : 172-177.
[4]LAM V W,SPIRO C,LAURENCE J M,et al.A systematic review of clinical response and survival outcomes of downsizing systemic chemotherapy and rescue liver surgery in patients with initially unresectable colorectal liver metastases[J].Annals of Surgical Oncology,2012,19( 4) : 1292-1301.
[5]SCHWARTZ J D,BEUTLER A S.Therapy for unresectable hepatocellular carcinoma: review of the randomized clinical trials-Ⅱ: systemic and local non-embolizationbased therapies in unresectable and advanced hepatocellular carcinoma[J].Anti-cancer Drugs,2004,15 ( 5) : 439-452.
[6]邓轶韬,丁玉梅,李华亮,等.鳄胆素联合阿霉素对人肝癌细胞SMMC-7721的抑制作用[J].厦门大学学报(自然科学版),2015,54( 6) : 796-801.
[7]SUGAR K L,BUDHRAM-MAHADEO V,PACKHAM G,et al.A minimal Bcl-x promoter is activated by Brn-3a and repressed by p53[J].Nucleic Acids Research,2001,29 ( 22) : 4530-4540.
[8]WILLIS S N,ADAMS J M.Life in the balance: how BH3- only proteins induce apoptosis[J].Current Opinion in Cell Biology,2005,17( 6) : 617-625.
[9]LIU B,CHEN Y,CLAIR D K S.ROS and p53: a versatile partnership[J].Free Radical Biology and Medicine,2008,44( 8) : 1529-1535.
[10]YEO W,MOK T S,ZEE B,et al.A randomized phaseⅢstudy of doxorubicin versus cisplatin/interferon α-2b/doxorubicin/fluorouracil ( PIAF) combination chemotherapy for unresectable hepatocellular carcinoma[J].Journal of the National Cancer Institute,2005,97 ( 20) : 1532-1538.
[11]ATLANTE A,CALISSANO P,BOBBA A,et al.Cytochrome c is released from mitochondria in a reactive oxygen species ( ROS)-dependent fashion and can operate as a ROS scavenger and as a respiratory substrate in cerebellar neurons undergoing excitotoxic death[J].Journal of Biological Chemistry,2000,275( 47) : 37159-37166.
[12]SPIERINGS D,MCSTAY G,SALEH M,et al.Connected to death: the ( unexpurgated) mitochondrial pathway of apoptosis[J].Science,2005,310 ( 5745) : 66-67.
[13]周桔,罗荣保,汤长发,等.Bcl-2蛋白家族和p53基因在细胞凋亡中的调控效应[J].中国组织工程研究与临床康复,2007,11( 10) : 1950-1952.
Effect of Crocodile Choline Combined with Doxorubicin on Apoptosis of Human Hepatocellular Carcinoma Cells SMMC-7721
DING Yumei,WENG Mengting,MAO Yunzi,DONG Xin,DENG Yitao,CHEN Qingxi*
( School of Life Sciences,Xiamen University,Xiamen 361102,China)
Abstract:In this paper,we studied the effect of crocodile choline combined with doxorubicin on apoptosis of human hepatocellular carcinoma cells SMMC-7721.SMMC-7721 cells were treated with crocodile choline( 15 μg/mL) alone or combined with doxorubicin( 0.4 μg/mL),followed by LDH release assay,AO/EB staining,flow cytometry analysis and Western blot to detect relative indicators.The results showed that crocodile choline with or without doxorubicin could promote the releasing of LDH in SMMC-7721 cells,and there were very significant difference ( p<0.01) between combined group and control group.SMMC-7721 cells exhibited obvious characteristics of apoptosis by AO/EB staining.We found that the level of ROS was markedly increased and much higher than control group when different drugs were used to treat the SMMC-7721 cells.Western blot results showed that crocodile choline with doxorubicin up-regulated expression of CytC and p53 protein in SMMC-7721 cells.Taking together,these results showed that crocodile choline alone or combined with doxorubicin could induce SMMC-7721 cells apoptosis,and the combination group showed better talents.This study suggests that mitochondrial-dependent signal transduction pathways are involved in crocodile choline with doxorubicin-induced SMMC-7721 cells apoptosis,supplying theoretical support for the treatment of human hepatocellular carcinoma on drug combination.
Key words:crocodile choline; doxorubicin; drug combination; hepatocellular carcinoma; apoptosis; mitochondrial pathway
*通信作者:chenqx@ xmu.edu.cn
基金项目:厦门市科技计划项目( 3502Z20133009) ;厦门大学基础科学人才培养基金( J1310027)
收稿日期:2015-04-22录用日期: 2015-06-12
doi:10.6043/j.issn.0438-0479.2016.01.013
中图分类号:Q 356.1
文献标志码:A
文章编号:0438-0479( 2016) 01-0072-06
引文格式:丁玉梅,翁梦婷,毛云子,等.鳄胆素与阿霉素联合应用对肝癌SMMC-7721细胞凋亡的影响[J].厦门大学学报(自然科学版),2016,55( 1) : 72-77.
Citation: DING Y M,WENG M T,MAO Y Z,et al.Effect of crocodile choline combined with doxorubicin on apoptosis of human hepatocellular carcinoma cells SMMC-7721[J].Journal of Xiamen University( Natural Science),2016,55( 1) : 72-77.( in Chinese)
