基于原发性大鼠肝癌模型的糖修饰荧光胶束肿瘤成像诊断评价
2016-04-12吴选俊韩守法刘平果
刘 达,张 康,吴选俊,韩守法,刘平果*
( 1.厦门大学医学院,福建厦门361102; 2.厦门大学化学化工学院,福建厦门361005)
基于原发性大鼠肝癌模型的糖修饰荧光胶束肿瘤成像诊断评价
刘达1,张康1,吴选俊2,韩守法2,刘平果1*
( 1.厦门大学医学院,福建厦门361102; 2.厦门大学化学化工学院,福建厦门361005)
摘要:手术成瘤模型因其肿瘤微环境与原发性肝癌相差较大而不能准确评价肝癌靶向性药物,二乙基亚硝胺( diethylnitrosamine,DEN)诱发大鼠肝癌模型因其诱发癌变的病理过程及肿瘤微环境均与原发性肝癌相似而成为理想的肝癌动物模型.本研究在传统的DEN诱导法基础上进行改进,实现了大鼠的100%成癌率和诱导过程中的零死亡率.基于该肝癌模型评价了新型肝癌靶向性糖修饰荧光胶束在肝癌中的实际应用价值,结果证明结合半乳糖胺的罗丹明功能化的糖修饰荧光胶束( RST@ P-Gal)表现出了较好的肿瘤靶向性和较低的背景信号,可以检测出0.5~5 mm的肿瘤病灶,这将对人类肝癌的早期诊断和术中微小病灶的清除带来一定的帮助.
关键词:原发性肝癌;荧光成像;二乙基亚硝胺( DEN) ;荧光胶束
原发性肝癌(简称肝癌)是全球第5大高发癌症,全球每年新发癌症1 300万例,其中肝癌占78万例左右[1].肝癌早期没有特异性临床症状,出现症状时肿瘤一般已经增长至4~8 cm,由于肝癌诊断时肿瘤往往较大,虽然肝癌手术器械不断地革新,切除技术日臻完善,但是肿瘤根治切除率仍较低(约25%),5年生存率徘徊在38%~47%,术后的复发率高达61.5%,这些可能与肝癌早期诊断率低,术前、术中未能发现微小(直径小于5 mm)肝癌病灶有关[2-6].
糖受体参与的细胞信号传导一度成为研究热点,如去唾液酸糖蛋白受体、甘露糖受体、半乳糖受体等[7-17],但是糖受体参与的肿瘤荧光检测领域还存在空白.近期有文章报道了一种酸敏感罗丹明( Rhodamine)功能化的聚(苯乙烯-马来酸)荧光胶束( RST@ P),其根据肝癌细胞表面不同糖蛋白受体含量的不同,分别将葡萄糖、半乳糖、甘露糖3种糖蛋白连接到RST@ P上形成新的胶束(依次简写为RST@ P-Glu、RST@ P-Gal、RST@ P-Man)进行肿瘤荧光检测成像,在皮下肿瘤模型和肝脏原位种植肿瘤模型中表现出了较高的肿瘤靶向性和较低的背景信号[3].
但是,肿瘤的发生发展与其所处的内环境密不可分,由肿瘤细胞、间质细胞、微血管、组织液及少量浸润细胞等共同组成,有别于正常细胞与其周围组织所形成的微环境,它们与肿瘤相互作用,对细胞的癌变、癌细胞的转移和对抗癌药物的抵抗和靶向性的干扰等都有重要的作用[18-21].皮下肿瘤模型和肝脏原位种植肿瘤模型不能很好地模拟出自然状态下肿瘤细胞所处的微环境,对评价该糖修饰荧光胶束的靶向性等方面存在一些不足.而二乙基亚硝胺( diethylnitrosamine,DEN)诱导的大鼠肝癌模型因其诱发癌变的整个过程与人类肝癌发生过程十分相似,都经历了经典的“肝癌三部曲”(肝炎,肝硬化,肝癌)[22].因此,我们尝试构建DEN诱发的Fisher大鼠原发性肝癌模型以评价该糖修饰荧光胶束真正临床应用价值.同时,我们在传统DEN诱导大鼠肝癌法的基础上对用药浓度和周期进行了改良,实现了大鼠的100%成癌率和诱导过程中的零死亡率.
1实验部分
1. 1试剂耗材
DEN、台盼蓝、RPMI 1640培养基( Sigma公司),胎牛血清( FBS) ( Gibco公司),青霉素、链霉素(厦门大学附属中山医院),100 mm细胞培养皿( Corning公司),枪尖( Axygen公司),1 mL注射器(福建莆田市医药有限公司),LO2、HepG2细胞( ATCC公司),实验所用水均为超纯水.
1. 2仪器
FX PRO型小动物光学活体成像系统( Carestream Health公司),AV 400 MHz型核磁共振仪( Bruker公司),SP5型激光共聚焦显微镜(德国Leica显微系统有限公司),HV-110型全自动高压蒸汽灭菌器(日本HIYARAMA公司),18.2 MΩ·cm超纯水仪(美国PALL公司),XB-K-2型血球计数板(浙江玉环县求精医用仪器厂),KD-8025型计数器(义务逵达电子仪器厂).
1. 3动物
Fisher 344大鼠(清洁级) :雄性,5周龄(北京维通利华实验动物技术有限公司) ; BalB/c小鼠(清洁级) :雄性,5周龄(上海斯莱克实验动物有限公司).
1. 4实验方法
细胞激光共聚焦成像:荧光共聚焦成像用SP5型激光共聚焦显微镜来完成.1)分别称取RST@ P、RST @ P-Glu、RST@ P-Gal、RST@ P-Man各1 mg溶于1 mL超纯水中,超声波清洗器混匀5 min; 2)染色:向LO2、HepG2两种细胞(各4盘)中每盘加入一种荧光胶束100 μL至终质量浓度10 μg/mL,于37℃培养30 min; 3)固定:吸尽培养基,用磷酸盐缓冲液( PBS)润洗一遍后,分别加入2 mL多聚甲醛常温固定细胞5 min; 4)封片:吸尽多聚甲醛,用PBS润洗3遍后封片; 4)观察: 490 nm激发光激发,然后收集510 nm的发射光成像.
改进型原发性大鼠肝癌模型的建立:选取雄性Fisher 344大鼠50只,体质量150~160 g,稳定喂养3 d后,随机分为实验组45只(采用间断给药法,在第1,3,5月用0.1 mg/mL的DEN溶液喂养,第2,4月用超纯水喂养)和对照组5只(整个实验过程中均饮用超纯水),在第5个月末用磁共振成像( MRI)检测大鼠肝癌形成情况.
肝癌靶向性糖修饰荧光胶束成像:用FX PRO型小动物光学活体成像系统完成.1)将8只MRI验证过的肝癌鼠随机分为RST@ P、RST@ P-Glu、RST@ PGal、RST@ P-Man 4组,每组2只,分别经尾静脉注射糖修饰荧光胶束40 mg/kg,每只500 μL; 2)器官分离:注射15 h后分别分离出各组实验鼠的代表器官,即脑、心脏、脾脏、肾脏、肺和肝; 3)荧光成像: 490 nm激发光激发,然后收集510 nm的发射光成像.
苏木精-伊红( HE)染色.1)取材并制作石蜡切片:切取0.5 cm×0.5 cm×0.5 cm大小的肝脏组织块投入10%(体积分数,下同)甲醛固定2周,脱水、浸蜡包埋、切片; 2)脱蜡:切片在二甲苯中脱蜡10 min; 3)乙醇梯度复水:依次经过100%,100%,95%,85%,70%,50%的乙醇溶液和去离子水,各浸泡3 min; 4)苏木精染色: 0.5%(质量分数)苏木精中染色10 min,用水冲洗掉玻片上多余染液,1%盐酸乙醇溶液( 70%乙醇配制)分色片刻,显微镜观察细胞核染色情况; 5)伊红复染:流水冲洗20 min;经0.5%(质量分数)伊红染液染色3 min; 6)乙醇梯度脱水:依次经过70%,85%,95%,100%,100%的乙醇溶液,各浸泡3 min; 7)透明:经过两次二甲苯溶液,各浸泡5 min; 8)封片:加1~2滴中性树胶,迅速加盖玻片封固.
细胞水平安全性评估:正常培养的LO2和HepG2细胞各16盘,经台盼蓝拒染法细胞计数后将1 mg/mL 的RST@ P荧光胶束加入4盘LO2和HepG2细胞中,至终质量浓度分别为0,50,200,400 μg/mL,37℃培养24 h后同法计数.RST@ P-Glu、RST@ P-Gal、RST@ P-Man评价方法同RST@ P.
动物水平安全性评估:取5周龄健康雄性BalB/c小鼠48只,随机分为6组,每组8只;分别经尾静脉注射25,50,100,200,400 mg/kg的RST@ P-Gal,每只500 μL,对照组用PBS代替;每5 d监测体质量一次,连续观察一个月.
2结果与讨论
2. 1糖修饰荧光胶束的摄取
目前用来成像的糖修饰荧光胶束一种是作用于细胞表面,另一种是特异性进入细胞内发挥作用.而本文所述糖修饰荧光胶束是根据肿瘤细胞表面糖受体的种类和含量不同而被特异性介导入肿瘤细胞内,且荧光在溶酶体酸性( pH 4.0~6.5)环境下被490 nm激发光激发,然后收集510 nm的发射光而实现成像[3,23].肿瘤细胞表面比正常细胞的去唾液酸糖蛋白受体的表达水平高[24-26],半乳糖受体在不同种肿瘤细胞表面含量有较大差异,但它在肝细胞表面表达丰富[27-28],甘露糖受体在高凋亡和坏死细胞中含量较高[29],而肝硬化、肝脏癌变过程中细胞凋亡数量较正常细胞要多,因此去唾液酸糖蛋白受体、半乳糖受体、甘露糖受体都成为生物体内检测肿瘤情况的潜在受体.通过激光共聚焦显微镜对LO2、HepG2两种细胞荧光成像结果(图1)可知,糖修饰荧光胶束是在细胞内部发挥作用,但含量无明显区别,正如荧光分布在皮下肿瘤模型与在肝脏原位种植肿瘤模型中不一致一样,这都可能与肿瘤微环境有关.
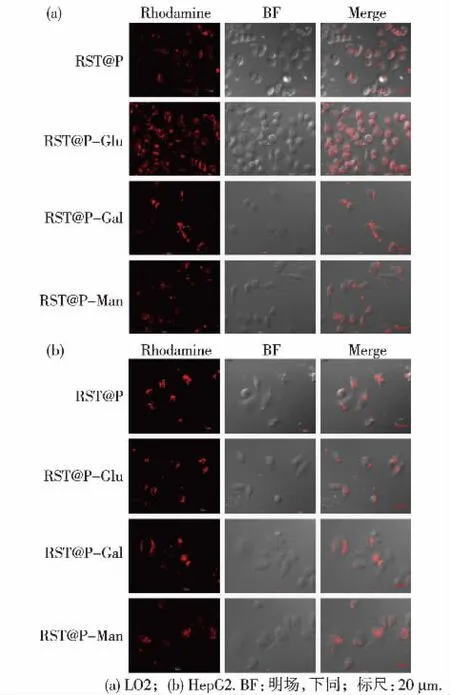
图1糖修饰荧光胶束发挥作用位置的鉴定Fig.1 Identification of fluorescence micelles' work place
2. 2改进型原发性肝癌模型的构建及鉴定
实验中所涉及操作均遵循《实验动物管理条例》[30].我们在传统的DEN诱导法的基础上进行改进,用药质量浓度由1 mg/mL降低至0.1 mg/mL,同时增加了用药间歇期,实现了大鼠的100%成癌率和诱导过程中的零死亡率.实验中对实验组和对照组大鼠进行体质量监测(图2( a) ),实验结束对所有实验组大鼠进行统一MRI检测成瘤情况(图2 ( b) ).

图2体质量监测( a)及MRI鉴定成瘤情况( b)Fig.2 Chronological changes in the body weight( a) and MRI to detect the tumor( b)
2. 3原发性肝癌的糖修饰荧光胶束成像
对原发性肝癌大鼠注射不同糖修饰荧光胶束(与图2( b)中所注1~4对应) 15 h后,荧光成像结果(图3)显示:荧光胶束主要聚集在肝脏肿瘤部位,在正常肝脏组织有少量聚集,而在脑、心脏、肾脏等肝外器官很少聚集.可以看出RST@ P-Gal表现出了更好的肿瘤靶向性和更低的背景信号,可以检测出0.5~5 mm的肿瘤病灶.
2. 4 HE染色鉴定肝癌情况
取图3( a)中虚线位置组织制作HE染色切片,评价DEN诱发肝癌是否具有正常肝癌组织病理学特征.如图4所示,纤维结缔组织大量增生,正常肝小叶结构被破坏,假小叶结构形成,同时可见不同程度炎细胞浸润和脂肪样变等肝癌典型病理变化,与原发性肝癌组织病理特点吻合.
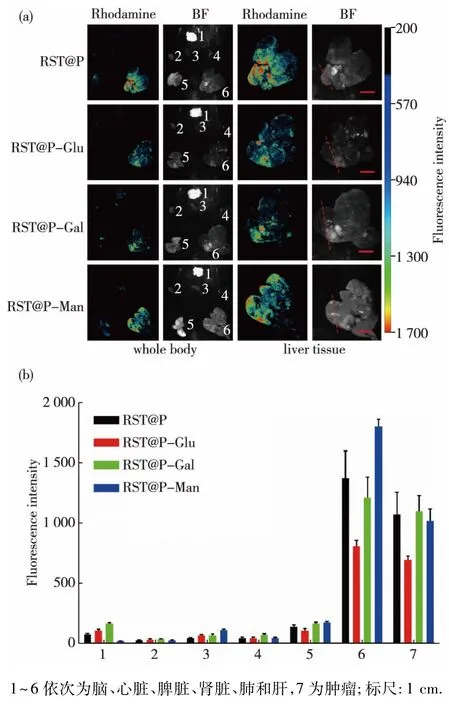
图3糖修饰荧光胶束在不同器官中的分布Fig.3 Distribution of the fluorescence materials in different organs
2. 5安全性评估
为了评价该糖修饰荧光胶束是否会对机体产生影响,故在细胞水平和动物水平进行相关毒性评价.
在细胞水平,经用药质量浓度为0,50,200,400 μg/mL的4组实验验证,各糖修饰荧光胶束均未对细胞产生明显的毒性(图5( a)和( b) ).在动物水平,用药质量浓度为400 mg/kg组,在最初注射时个别小鼠会出现精神萎靡不振的症状,十几分钟后恢复正常,可能与用药体积和注射速度有关;实验结束时实验组与对照组动物状态无差异,无死亡情况,体质量相当.证明药物可随新陈代谢排出体外,对机体不会造成明显影响(图5( c) ).
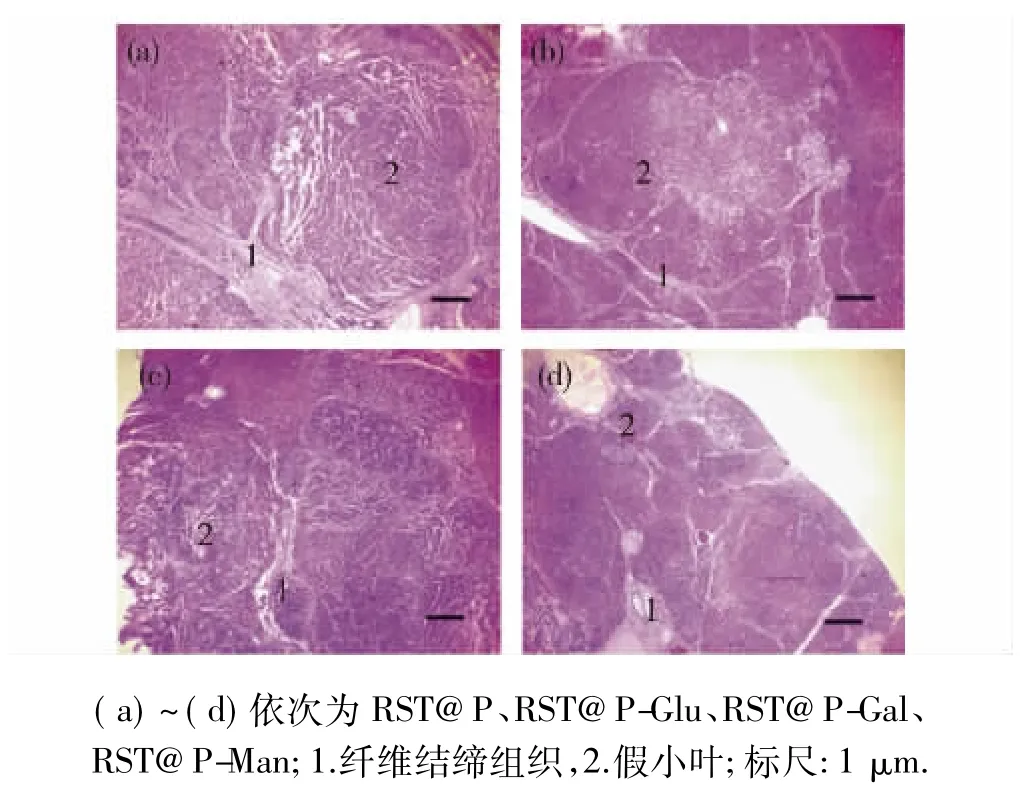
图4肝癌组织切片HE染色Fig.4 Hematoxylin-Eosin staining of the sections of liver cancer tissues
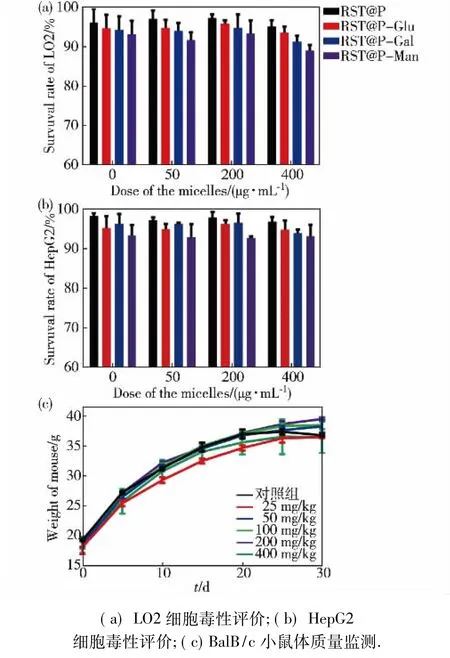
图5细胞和动物水平安全性评估Fig.5 Safety assessment of the fluorescence micelles in cells and animals
3结论
改进后DEN诱发型原发性大鼠肝癌模型实现了实验鼠的100%成癌率和诱导过程中的零死亡率,相对传统DEN诱癌方法更安全、高效.这可能与实验诱癌过程中将传统用药质量浓度从1 mg/mL降低为0.1 mg/mL并设立了诱癌间歇期有关:低浓度DEN对动物刺激性更低,而间歇期给了大鼠肝脏一定时间的休息和代偿增生;但正是间歇期肝细胞对损伤修复的加强,使基因突变平稳积累、加剧,伴随肝硬化和肝脏炎症反应不断进展,促进了DEN诱癌过程中肝细胞的癌变,最终有效降低了动物的死亡率并提高了成癌率.经MRI和HE染色证明DEN诱发癌与自然肝癌组织的形成和病理特征较为接近,肿瘤微环境也比较相似,所以该肝癌模型比皮下成瘤模型、肝脏原位接种肿瘤模型对肝癌靶向性糖修饰荧光胶束的评价更有临床参考价值.成像结果证明4种糖修饰荧光胶束主要聚集在肝脏组织,其中RST@ P-Gal荧光成像拥有肿瘤靶向性强、背景信号低等优点,这对肝癌的早期诊断和术中微小病灶的清除将带来一定的帮助.
参考文献:
[1]BRUIX J,BOIX L,SALA M,et al.Focus on hepatocellular carcinoma[J].Cancer Cell,2004,5( 3) : 215-219.
[2]ESPINA C,PORTA M,SCHÜZ J,et al.Environmental and occupational interventions for primary prevention of cancer: a cross-sectorial policy framework[J].Environ Health Perspect,2013,121( 4) : 420-426.
[3]WU X J,TIAN Y P,YU M Z,et al.A targetable acid-responsive micellar system forsignal activation based high performance surgical resolution of tumors[J].Biomaterials Science,2014,7( 7) : 972-979.
[4]VAHRMEIJER A L,HUTTEMAN M,VORST J R V D,et al.Image-guided cancer surgery using near-infrared fluorescence [J].Nat Rev Clin Oncol,2013,10( 9) : 507-518.
[5]COLOMBO M.Hepatocellular carcinoma[J].J Hepatol,1992,15( 1/2) : 225-236.
[6]TREVISANI F,CANTARINI M C,WANDS J R,et al.Recent advances in the natural history of hepatocellular carcinoma [J].Carcinogenesis,2008,29( 7) : 1299-1305.
[7]SONOKE S,UEDA T,FUJIWARA K,et al.Galactosemodified cationic liposomes as a liver-targeting delivery system for small interfering RNA[J].Biol Pharm Bull,2011,34( 8) : 1338-1342.
[8]MA P,LIU S,HUANG Y,et al.Lactose mediated liver-targeting effect observed by ex vivo imaging technology[J].Biomaterials,2010,31( 9) : 2646-2654.
[9]LEE M H,HAN J H,KWON P S,et al.Hepatocyte-targeting single galactose-appended naphthalimide: a tool for intracellular thiol imaging in vivo[J].J Am Chem Soc,2011,134 ( 2) : 1316-1322.
[10]GUO B,CHENG Y,LI N,et al.In vitro and in vivo studies of galactose-modified liver-targeting liposomes[J].J Drug Target,2013,21( 3) : 257-264.
[11]KIKKERI R,LEPENIES B,ADIBEKIAN A,et al.In vitro imaging and in vivo liver targeting with carbohydrate capped quantum dots[J].J Am Chem Soc,2009,131( 6) : 2110-2112.
[12]CUI L,COHEN J A,BROADERS K E,et al.Mannosylated dextran nanoparticles: a pH-sensitive system engineered for immunomodulation through mannose targeting[J].Bioconjugate Chem,2011,22( 5) : 949-957.
[13]MOVAHEDI K,SCHOONOOGHE S,LAOUI D,et al.Nanobody-based targeting of the macrophage mannose receptor for effective in vivo imaging of tumor-associated macrophages[J].Cancer Res,2012,72( 16) : 4165-4177.
[14]ARTNER L M,MERKEL L,BOHLKE N,et al.Siteselective modification of proteins for the synthesis of structurally defined multivalent scaffolds[J].Chem Commun,2012,48( 4) : 522-524.
[15]ORSINI F,VILLA P,PARRELLA S,et al.Targeting mannose-binding lectin confers long-lasting protection with a surprisingly wide therapeutic window in cerebral ischemia [J].Circulation,2012,126( 12) : 1484-1494.
[16]EL-DAKDOUKI M H,ZHU D C,EL-BOUBBOU K,et al.Development of multifunctional hyaluronan-coated nanoparticles for imaging and drug delivery to cancer cells[J].Biomacromolecules,2012,13( 4) : 1144-1151.
[17]KAWASAKI N,VELA J L,NYCHOLAT C M,et al.Targeted delivery of lipid antigen to macrophages via the CD169/sialoadhesin endocytic pathway induces robust invariant natural killer T cell activation[J].Proc Natl Acad Sci USA,2013,110( 19) : 7826-7831.
[18]HEDE K.Environmental protection: studies highlight importance of tumor microenvironment[J].J Natl Cancer Inst,2004,96( 15) : 1120-1121.
[19]BROWN J M.Tumor microenvironment and the response to anticancertherapy[J].Cancer Biol Ther,2002,1 ( 5) : 453-458.
[20]JOYCE J A.Therapeutic targeting of the tumor microenvironment[J].Cancer Cell,2005,7( 6) : 513-520.
[21]GALMARINI C M,GALMARINI F C.Multidrug resistance in cancer therapy: role of the microenvironment[J].CurrOpin Investig Drugs,2003,4( 12) : 1416-1421.
[22]张志,王阁,陈川,等.改进性DEN诱发大鼠肝癌模型的建立与病理形态学研究[J].第三军医大学学报,2007,29( 12) : 1164-1167.
[23]LOTAN R,RAZ A.Lectins in cancer cells[J].Ann N Y Acad Sci,1988,551: 385-398.
[24]SZABLEWSKI L.Expression of glucose transporters in cancers[J].Biochimica et Biophysica Acta,2013,1835 ( 2) : 164-169.
[25]WHEELER T J,HINKLE P C.The glucose transporter of mammalian cells[J].Annu Rev Physiol,1985,47( 1) : 503-517.
[26]MEDINA R A,OWEN G I.Glucose transporters: expression,regulation and cancer[J].Biol Res,2002,35 ( 1) : 9-26.
[27]HAMA Y,URANO Y,KOYAMA Y,et al.Targeted optical imaging of cancer cells using lectin-binding BODIPY conjugated avidin[J].Biochem Biophys Res Commun,2006,348 ( 3) : 807-813.
[28]RAZ A,LOTAN R.Lectin-like activities associated with human and murine neoplastic cells[J].Cancer Res,1981,41( 2) : 3642-3647.
[29]NAUTA A J,RAASCHOU-JENSEN N,ROOS A,et al.Mannose-binding lectin engagement with late apoptotic and necrotic cells[J].Eur J Immunol,2003,33( 10) : 2853-2863.
[30]国家科学技术委员会.实验动物管理条例[EB/OL].[2015-03-30].http:∥www.gov.cn/gongbao/content/2011/ content_1860757.htm.
Imaging of Primary Hepatocellular Carcinoma with Glycosylated Micelles in a Rat Model
LIU Da1,ZHANG Kang1,WU Xuanjun2,HAN Shoufa2*,LIU Pingguo1*
( 1.Medical College,Xiamen University,Xiamen 361102,China; 2.College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,China)
Abstract:The tumor microenvironment and pathological conditions of animal xenograft tumor models employed for surgerical evaluation are significantly different from those of the primary hepatocellular carcinoma models.As such,diethylnitrosamine ( DEN)-induced primary hepatocellular carcinoma models are superior to evaluate the efficacy of tumor targeting drugs compared to xenograft tumor models.Herein,we report the development of an improved method for DEN-induced tumor in mice with 100% cancer rate and zero mortality.We have evaluated the fluorogenic micelles consisting of cores of rhodamine-sultam ( RST) and a corona of poly[styrene-alter-( maleic acid)]glycosylated with glucosamine,galactosamine or mannosamine in the primary tumor model.The results have revealed that the galactosylated micelles ( RST@ PGal) can detect the tumor foci with diameters of 0.5-5 mm.The high tumor to background fluorescence ratio and high tumor-targeting displayed by RST@ P-Gal have validated its utility for diagnosis of early hepatocellular carcinoma in an intraoperative setting.
Key words:primary hepatocellular carcinoma; fluorescence imaging; diethylnitrosamine( DEN) ; glyco-micelles
*通信作者:pgliu@ xmu.edu.cn
基金项目:国家重点基础研究发展计划( 973计划) ( 2013CB93390) ;国家自然科学基金( 21272196,21072162)
收稿日期:2015-03-30录用日期: 2015-05-11
doi:10.6043/j.issn.0438-0479.2016.01.005
中图分类号:Q 599
文献标志码:A
文章编号:0438-0479( 2016) 01-0016-06
引文格式:刘达,张康,吴选俊,等.基于原发性大鼠肝癌模型的糖修饰荧光胶束肿瘤成像诊断评价[J].厦门大学学报(自然科学版),2016,55( 1) : 16-21.
Citation: LIU D,ZHANG K,WU X J,et al.Imaging of primary hepatocellular carcinoma with glycosylated micelles in a rat model[J].Journal of Xiamen University( Natural Science),2016,55( 1) : 16-21.( in Chinese)
