β-葡聚糖对巨噬细胞摄取氧化低密度脂蛋白的影响*
2016-04-01李秀英
李秀英,叶 云
(西南医科大学附属医院药学部,四川泸州646000)
β-葡聚糖对巨噬细胞摄取氧化低密度脂蛋白的影响*
李秀英,叶 云
(西南医科大学附属医院药学部,四川泸州646000)
目的:探讨β-葡聚糖对巨噬细胞源性泡沫细胞形成的影响及相关机制。方法:以RAW264.7巨噬细胞为细胞模型,MTT法检测β-葡聚糖对巨噬细胞细胞活性的影响;油红O染色观察β-葡聚糖对巨噬细胞摄取氧化低密度脂蛋白(oxygenized low density lipoprotein,oxLDL)的影响;Western blot检测β-葡聚糖对巨噬细胞SR-A、CD36、c-fos、c-Jun蛋白表达的影响。采用SPSS 10.0统计软件分析数据,并采用双尾t检验进行统计学意义评估。结果:2.5~10 μg/mL β-葡聚糖对巨噬细胞细胞活性无影响;5 μg/mL β-葡聚糖显著抑制巨噬细胞对ox LDL的摄取,从而减少巨噬细胞源性泡沫细胞的形成;与对照组比较,2.5~10 μg/mL的β-葡聚糖剂量依耐性降低巨噬细胞SR-A蛋白及细胞核蛋白c-Jun的表达(P<0.05),但对CD36蛋白及细胞核蛋白c-fos表达无影响(P>0.05);与5 μg/mL β-葡聚糖处理组比较,c-Jun抑制剂SP600125进一步增强β-葡聚糖抑制细胞SR-A蛋白表达的作用(P<0.05)。结论:β-葡聚糖可抑制巨噬细胞源性泡沫细胞的形成,且与抑制c-Jun/SR-A通路相关。
动脉粥样硬化;细胞模型;β-葡聚糖;巨噬细胞;泡沫细胞
动脉粥样硬化是以动脉壁脂质聚集或炎症发生为特征的慢性疾病,是不稳定性心绞痛、心肌梗塞的主要原因[1]。巨噬细胞源性泡沫细胞在动脉粥样硬化的发生发展中起着重要的作用。对氧化低密度脂蛋白(oxygenized low density lipoprotein,oxLDL)无限制的摄取是巨噬细胞成为泡沫细胞的重要原因[2]。清道夫受体SR-A及CD36是巨噬细胞摄取oxLDL的主要受体[3]。大量的研究显示,减少SR-A、CD36的表达可以抑制泡沫细胞的形成并最终延缓动脉粥样硬化的发生发展[4]。
β-葡聚糖主要来源于新鲜的食品如燕麦、啤酒、酵母、食用菌等。研究显示,β-葡聚糖具有降低血脂、抗过氧化、预防动脉粥样硬化的作用[5],但具体机制不详细。此外,有研究表明,c-Jun、c-fos与泡沫细胞的形成相关[2]。本研究拟从SR-A、CD36、c-Jun、c-fos蛋白表达变化的角度探讨β-葡聚糖对巨噬细胞源性泡沫细胞的影响,为β-葡聚糖抗动脉粥样硬化作用机制的研究和临床应用提供实验依据。
1 材料与方法
1.1 细胞培养
RAW264.7巨噬细胞(来自小鼠)由重庆医科大学生命科学院提供;用1640培养基加10%胎牛血清置于含5%CO2,37℃的培养箱进行培养,胰酶消化传代。培养液中加入β-葡聚糖(0,2.5,5,10 μg/mL)干预24 h,加入20 μL MTT孵育4 h后,加入DMSO 120 μL震荡10 min,在波长570 nm处检测吸光度A570。
1.2 油红O染色
将RAW 264.7细胞接种于6孔板内,随机分为对照组、oxLDL处理组 (80 μg/mL oxLDL孵育细胞24 h)、β-葡聚糖处理组 (5 μg/mL β-葡聚糖及80 μg/mL oxLDL共同孵育细胞24 h)。细胞孵育结束后,吸弃上清液,10%多聚甲醛固定30 min,PBS轻轻洗1次后,油红O染色10 min,再用60%异丙醇洗细胞1次(孵育时间10 s),吸弃异丙醇,PBS轻轻洗1次后显微镜下照相。
1.3 实验试剂
油红O、甘油明胶、β-葡聚糖购自sigma公司;SR-A、CD36、c-Jun、c-fos、β-actin抗体购自美国Abcam公司;1640培养基、消化胰酶、胎牛血清购自Gibco公司;oxLDL购自广州奕源生物公司。
1.4 Western blot检测相关蛋白的表达
收集细胞,加入细胞裂解液裂解细胞并提取蛋白,采用BCA蛋白定量试剂盒检测蛋白浓度。25 μg蛋白样品与上样缓冲液混合后煮沸 10 min,SDS-PAGE电泳100V恒压2 h,湿转500 mA恒流1.5 h,5%脱脂奶粉封膜1 h,PBST漂洗3次后分别加入一抗和β-actin 4℃孵育过夜,TBST漂洗3次,37℃二抗(1∶1 000稀释)反应1 h后进行ECL显色。以β-actin作为内参,计算目的蛋白的表达。
1.5 统计学处理
2 结果
2.1 β-葡聚糖对RAW264.7巨噬细胞细胞活性的影响
不同浓度的β-葡聚糖(0、2.5、5、10 μg/mL)孵育巨噬细胞24 h后,采用MTT法检测细胞活性,检测所得A570值分别为3.65±0.05、3.68±0.06、3.68 ±0.061、3.69±0.069,β-葡聚糖处理组与对照组(0 μg/mL β-葡聚糖)比较,差异均无统计学意义(P>0.05)。结果如图1所示,2.5~10 μg/mL的β-葡聚糖对RAW264.7细胞的细胞活性无影响,因此,在后续实验中选取的β-葡聚糖浓度为2.5~10 μg/mL。
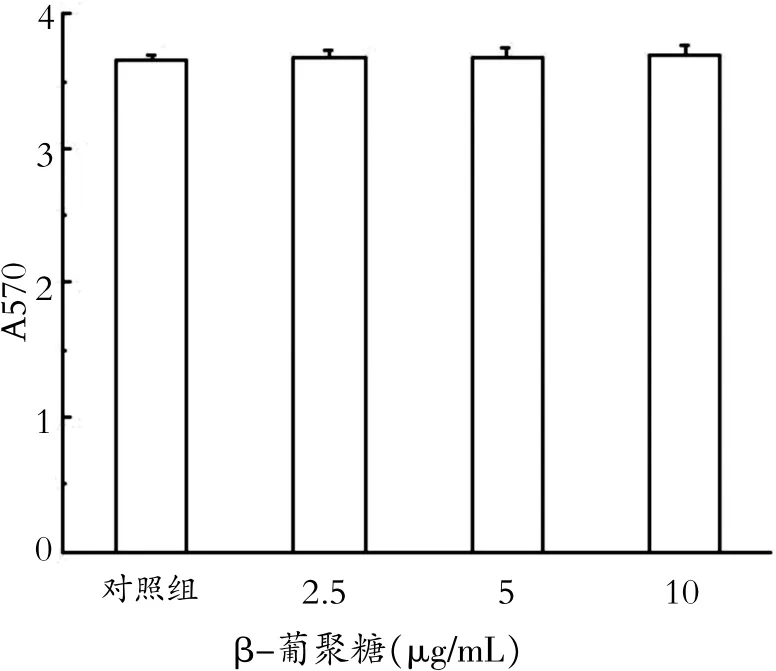
图1 β-葡聚糖对巨噬细胞细胞活性的影响
2.2 β-葡聚糖对巨噬细胞源性的泡沫细胞形成的影响
由图2可知,对照组细胞内聚集的脂质较少,oxLDL处理组细胞内脂质明显增多,油红O染色后阳性细胞数为对照组的(5±0.07)倍,与oxLDL组比较,β-葡聚糖(5 μg/mL)处理细胞后,细胞内脂质聚集减少,油红O染色后阳性细胞减少(90±1.8)%。图2的结果表明β-葡聚糖可以抑制巨噬细胞对oxLDL摄取,从而减少泡沫细胞的形成。
2.3 β-葡聚糖对巨噬细胞细胞膜蛋白SR-A、CD36蛋白表达的影响
如图3所示,β-葡聚糖剂量依耐性的减少巨噬细胞SR-A蛋白的表达,不同浓度(2.5、5、10 μg/mL)的β-葡聚糖处理巨噬细胞后,SR-A蛋白表达量分别为对照组的0.6±0.02、0.56±0.04、0.3±0.031倍,与对照组比较,差异有统计学意义(P<0.05)。但β-葡聚糖对CD36蛋白的表达无影响,(2.5、5、10 μg/mL)β-葡聚糖处理巨噬细胞后,CD36蛋白表达量分别为对照组的0.99±0.04、0.986±0.08、0.98± 0.07倍,β-葡聚糖处理组与对照组比较,差异无统计学意义(P>0.05),表明β-葡聚糖可能通过抑制SR-A蛋白表达,从而抑制巨噬细胞对oxLDL的摄取。

图2 β-葡聚糖对巨噬细胞源性的泡沫细胞形成的影响(油红O染色×400)

图3 β-葡聚糖对巨噬细胞CD36、SR-A蛋白表达的影响
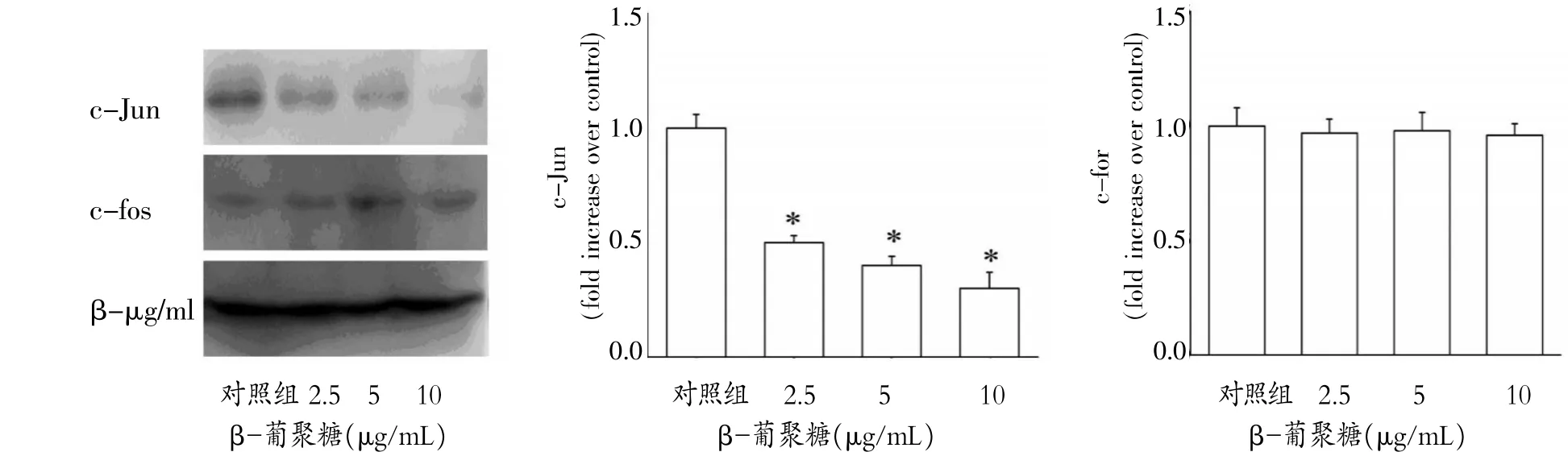
图4 β-葡聚糖对巨噬细胞细胞核c-fos、c-Jun蛋白量的影响
2.4 β-葡聚糖对巨噬细胞细胞核c-Jun、c-fos蛋白表达的影响
如图4所示,β-葡聚糖剂量依耐性的减少细胞核c-Jun蛋白量,(2.5、5、10 μg/mL)β-葡聚糖处理巨噬细胞后,细胞核c-Jun蛋白量降低为对照组的0.5±0.03、0.4±0.04、0.3±0.07倍,与对照组比较,差异有统计学意义(P<0.05),但对细胞核c-fos蛋白量无影响,(2.5、5、10 μg/mL)β-葡聚糖处理巨噬细胞后,细胞核c-fos蛋白量降低为对照组的0.97± 0.06、0.98±0.08、0.96±0.05倍,与对照组比较,差异无统计学意义(P>0.05)。
2.5 c-Jun N端激酶抑制剂SP600125对β-葡聚糖减少巨噬细胞SR-A蛋白表达的影响
如图5所示,c-Jun N端激酶抑制剂SP600125(10 μM)进一步增加β-葡聚糖(5 μg/mL)减少巨噬细胞SR-A蛋白表达的作用。β-葡聚糖(5 μg/mL)处理细胞后,SR-A蛋白量降低为对照组的0.56±0.04倍,两组比较,差异有统计学意义 (P<0.05);SP600125与β-葡聚糖共同孵育巨噬细胞后,SR-A蛋白量降低为对照组的0.24±0.05倍,与β-葡聚糖处理组比较,差异有统计学意义(P<0.05),结合图4及图5的实验结果,提示β-葡聚糖可能通过抑制c-Jun/SR-A通路减少巨噬细胞对oxLDL的摄取。
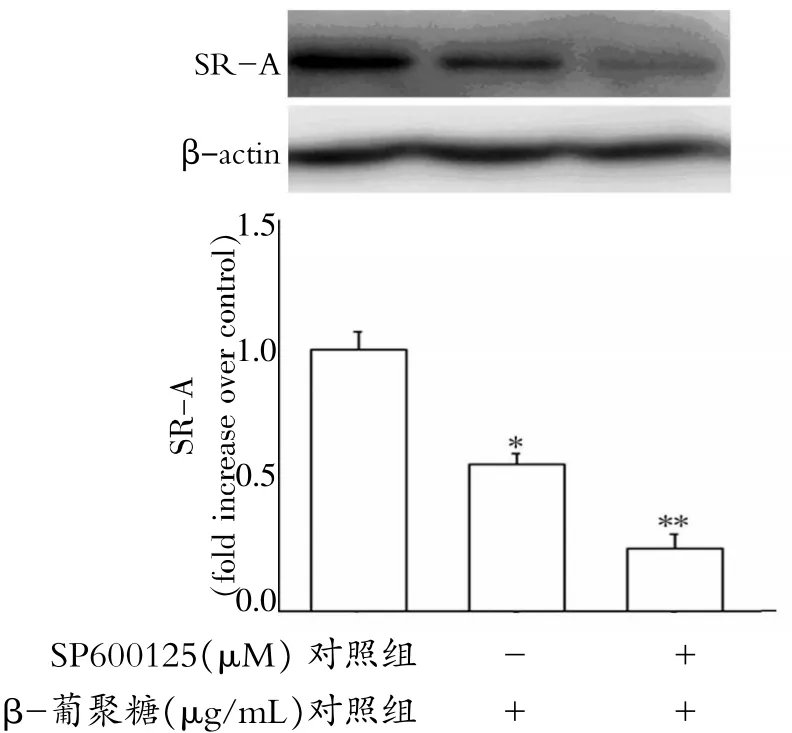
图5 SP600125对β-葡聚糖减少巨噬细胞SR-A蛋白表达的影响
3 讨论
已有研究表明β-葡聚糖有降血脂、预防动脉粥样硬化的作用[5]。但β-葡聚糖是否减少巨噬细胞内脂质的聚集及相关机制尚鲜见报道。本研究显示,β-葡聚糖通过减少巨噬细胞清道夫受体SR-A的表达,减少了巨噬细胞摄取oxLDL,进而抑制巨噬细胞源性泡沫细胞的形成。
清道夫受体介导的巨噬细胞内脂质聚集在泡沫细胞形成过程中起着重要的作用[2]。本研究结果首次证明β-葡聚糖通过减少巨噬细胞对oxLDL的摄取,从而抑制巨噬细胞源性泡沫细胞的形成。此外,β-葡聚糖显著降低巨噬细胞SR-A蛋白的表达,但是对CD36蛋白的表达无影响。清道夫受体CD36和SR-A是巨噬细胞摄取oxLDL的主要受体[3]。研究表明,与对照组比较,SR-A转基因后促进小鼠动脉粥样硬化的发生发展以及泡沫细胞在血管壁的聚集[6]。此外,巨噬细胞SR-A蛋白的表达受抗氧化物及细胞因子的调控,表明SR-A与动脉粥样硬化的发生相关[7-9]。本研究表明,β-葡聚糖通过抑制巨噬细胞SR-A蛋白的表达抑制巨噬细胞对oxLDL的摄取与β-葡聚糖减少巨噬细胞c-Jun蛋白表达有关。结果显示,c-Jun N-端激酶抑制剂SP600125增加了β-葡聚糖对SR-A蛋白表达的抑制作用。由此表明,β-葡聚糖抑制泡沫细胞形成需要抑制c-Jun通路。
总之,本研究结果表明,β-葡聚糖通过降低巨噬细胞细胞核c-Jun蛋白的表达,减少清道夫受体SR-A蛋白的表达,从而减少巨噬细胞对oxLDL的摄取,最终抑制泡沫细胞的形成。该研究结果为β-葡聚糖抗动脉粥样硬化作用的机制研究和临床应用提供了新的实验依据。
1.Sung HJ,Kim J,Kim Y,et al.N-acetyl cysteine suppresses the foam cell formation that is induced by oxidized low density lipoprotein via regulation of gene expression [J].Mol Biol Rep,2012,39(3):3001-7.
2.Tsai JY,Su KH,Shyue SK,et al.EGb761 ameliorates the formation of foam cells by regulating the expression of SR-A and ABCA1:role of haem oxygenase-1[J].Cardiovasc Res,2010,88(3):415-23.
3.Lin CY,Lee TS,Chen CC,et al.Endothelin-1 exacerbates lipid accumulation by increasing the protein degradation of the ATP-binding cassette transporter G1 in macrophages[J].J Cell Physiol,2011,226(8):2198-205.
4.Li XY,Kong LX,Li J,et al.Kaempferol suppresses lipid accumulation in macrophages through the downregulation of cluster of differentiation 36 and the upregulation of scavenger receptor class B type I and ATP-binding cassette transporters A1 and G1[J].Int J Mol Med,2013,31(2):331-8.
5.申瑞玲,朱莹莹,李林,等.燕麦β-葡聚糖调节肠道菌群与降脂减肥作用的研究进展[J].食品工业科技,2014, 35(8):364-366.
6.Van Eck M,De Winther MP,Herijgers N,et al.Effect of human scavenger receptor class A overexpression in bone marrow-derived cells on cholesterol levels and atherosclerosis in ApoE-deficient mice[J].Arterioscler Thromb Vasc Biol,2000,20(12):2600-6.
7.Takeda N,Manabe I,Shindo T,et al.Synthetic retinoid Am80 reduces scavenger receptor expression and atherosclerosis in mice by inhibiting IL-6[J].Arterioscler Thromb Vasc Biol,2006,26(5):1177-83.
8.Napolitano M,De Pascale C,Wheeler-Jones C,et al.Effects of lycopene on the induction of foam cell formation by modified LDL[J].Am J Physiol Endocrinol Metab, 2007,293(6):E1820-7.
9.Józefowski S,Arredouani M,Sulahian T,et al.Disparate regulation and function of the class A scavenger receptors SR-AI/II and MARCO[J].J Immunol,2005,175(12):8032-41.
(2016-01-20收稿)
Effects of茁-glucan on the uptake of oxLDL in macrophages
Li Xiuying,Ye yun
Department of Pharmacy,the Affiliated Hospital of Southwest Medical University,Luzhou 646000,Sichuan Province,China
Objective:To explore the effects and the mechanisms of β-glucan on the formation of macrophage-derived foam cells.Methods:The effects of β-glucan on cell viability was examined by MTT.Oil-red O staining was used to observe the effects of β-glucan on the uptake of oxLDL,and the effects of β-glucan on SRA、CD36、c-fos、c-Jun protein expression in macrophages were investigated using Western blot.Data were analyzed using SPSS 10.0 statistical software and two-tailed t test was used for statistical significance assessment.Results:β-glucan ranged from 2.5~10 μg/mL did not affect cell viability,and at 5 μg/mL inhibited the formation of macrophage-derived foam cells via attenuating oxLDL uptake by macrophages.Compared with control group,β-glucan (2.5~10 μg/mL)treatment dose-dependently decreased the expression of SR-A and nuclear c-Jun without affecting that of CD36 and nuclear c-fos in macrophages.Compared with β-glucan at 5 μg/mL group,SP600125(c-Jun inhibitor)significantly augmented the inhibitory effects of β-glucan on SR-A expression(P<0.05).Conclusion:β-glucan could inhibit the formation of macrophage-derived foam cells,which are possibly related to the inactivation of c-Jun/SR-A pathway.
Athrosclerosis;Cell model;β-glucan;Macrophage;Foam cells
R645
A
10.3969/j.issn.1000-2669.2016.02.002
*国家青年自然科学基金(81500357)
李秀英(1987-),女,博士。
叶 云(1963-),男,教授。E-mail:yeyun8622@163.com
