依达拉奉预处理对大鼠脑干缺血再灌注损伤后MDA、SOD的影响
2016-04-01李娇红程锦楠李小刚
李娇红,程锦楠,李小刚
(西南医科大学附属医院:1神经内科;2皮肤科,四川泸州 646000)
依达拉奉预处理对大鼠脑干缺血再灌注损伤后MDA、SOD的影响
李娇红1,程锦楠2,李小刚1
(西南医科大学附属医院:1神经内科;2皮肤科,四川泸州 646000)
目的:用依达拉奉(EDA)对大鼠预处理,观察其对大鼠脑干缺血再灌注损伤后丙二醛(MDA)、超氧化物歧化酶(SOD)表达水平的影响,探讨研究EDA对脑干缺血再灌注损伤的保护作用,为临床应用提供实验依据。方法:将25只SD大鼠随机分为3组,即对照组5只、缺血再灌注组和依达拉奉预处理组各10只。根据缺血时间的不同,把缺血再灌注组和依达拉奉预处理组分为缺血1 h再灌注7 h和缺血3 h再灌注5 h两个亚组,每亚组5只大鼠。其中对照组:暴露基底动脉(BA)第一无分支区和第二无分支区,观察8 h;缺血再灌注组:用微型动脉夹夹闭基底动脉第一无分支区和第二无分支区,分别使之缺血1 h和3 h,再分别灌注7 h和5 h;依达拉奉预处理组:各亚组实验前10 min于大鼠尾静脉注射依达拉奉6 mg/kg,其它同缺血再灌注组。HE染色观察各组脑干组织的病理改变。测定各组大鼠脑干中MDA及SOD表达水平。结果:在缺血1 h时,与假手术组和预处理组比较,缺血再灌注组MDA含量明显升高,SOD含量明显降低,差异均具有统计学意义(P<0.05)。在缺血3h时,与假手术组比较,预处理组和缺血再灌注组MDA含量明显升高,SOD含量明显降低,差异均有统计学意义(P<0.05);与预处理组比较,缺血再灌注组MDA含量明显升高,SOD含量明显降低,差异均有统计学意义(P<0.05)。结论:依达拉奉预处理通过减少MDA含量、增加SOD活性,清除自由基、对抗脂质过氧化等机制,对大鼠脑干缺血再灌注具有一定的保护作用。
依达拉奉;预处理;脑干缺血再灌注损伤;MDA;SOD
世界卫生组织(WHO)报告显示,脑血管疾病已成为全球成年人第一位致死性疾病和第二位致残性疾病。因此对脑卒中的预防显得尤为重要。脑干缺血再灌注损伤是指脑干组织缺血缺氧一段时间后,当血管再通或血流重新恢复时,脑干组织的损伤程度反而较缺血时进一步加重,其症状进一步恶化的表现。缺血再灌注损伤是近年来医学研究中的热门领域,已被临床观察和动物实验所证实。药物预处理是缺血预处理的发展趋势,其既不损伤器官又能产生预处理效果,所以药物预处理是神经保护的新前途,为缺血再灌注脑损伤的预防提供了一新思路,具有很大的潜在临床应用价值。相关临床试验和实验研究均表明:依达拉奉(EDA)作为自由基清除剂,对组织缺血再灌注损伤具有强有效的保护作用。其可清除颅内羟基基团,减轻细胞毒性,且可降低急性脑梗死后脑组织炎性标记物的表达,减少继发性脑缺血后损伤[1]。虽然关于EDA治疗脑干梗死的临床疗效观察已证实其对脑干梗死有保护作用,但关于其在脑干缺血再灌注损伤过程中的保护作用机制的基础性研究,国内的相关报道仍罕见。因此本文通过比较大鼠脑干缺血再灌注组织中丙二醛(MDA)、超氧化物岐化酶(SOD)的含量与EDA预处理后脑干组织中指标表达的变化,进一步研讨和明确依达拉奉预处理对脑干缺血再灌注损伤的影响。
1 材料及方法
1.1 实验大鼠
准备成年雄性SD大鼠25只,平均体重约300 g。于西南医科大学动物实验中心采购。动物饲养5~7 d使大鼠适应实验室环境。
1.2 主要试剂和仪器
硫酸阿托品;2%戊巴比妥钠;尼克刹米注射液;梯度乙醇;明矾苏木精;1%伊红水溶液;MDA、SOD试剂盒(南京建成生物医学工程研究所提供);依达拉奉注射液(南京先声东元制药有限公司)。实验用手术器械;手术显微镜;微型动脉夹;自制气管插管用聚乙烯管;低温离心机(德国D-63405 Hanau);玻璃匀浆器;电子天平ES-J(沈阳龙腾电子称量仪器有限公司);隔水式电热恒温水箱(上海跃进医疗器械);照相显微镜等。
1.3 实验方法
1.3.1 实验分组
25只雄性大鼠随机分组,其中假手术组5只,缺血再灌注组和依达拉奉预处理组各10只,各亚组5只。缺血再灌注组根据缺血时间不同分为缺血1 h灌注7 h(I1R7)和缺血3 h灌注5 h(I3R5)两个亚组。依达拉奉预处理组分组同缺血再灌注组,在每亚组实验前10 min在大鼠尾静脉处推入依达拉奉6 mg/ kg预处理。假手术组:只分离暴露出基底动脉,不予其它处理,可在实验中用白炽灯距大鼠30 cm处照射,使其保持体温。每组实验观察至8 h,终止模型后测定各实验组脑干组织中MDA、SOD含量。
1.3.2 大鼠脑干缺血再灌注模型建立
大鼠行2%戊巴比妥钠麻醉后取仰卧位,于手术台上固定头部及四肢。皮下注射硫酸阿托品使气管分泌物减少。去毛、消毒后暴露气管,气管切开后气管插管,剪除枕骨基底所附着的肌肉及剪断两侧枕骨骸处,剪开枕骨基底面,除骨组织,形成骨窗。剪除硬脑膜,去除蛛网膜,小心暴露基底动脉(BA),可清晰显示基底动脉分支(脑桥支、小脑下前动脉、小脑上动脉及椎动脉),其无分支区分别位于起始处和前、中段移行处即小脑下前动脉前方。缺血再灌注组在BA两个无分支处分别用微型动脉夹夹闭,维持1 h、3 h,期间予生理盐水冲泡的纱布覆盖伤口,之后分别对应7 h、5 h后移除动脉夹,使BA再通形成再灌注。依达拉奉预处理组在夹闭动脉前10 min于大鼠尾静脉注射依达拉奉6 mg/kg,其余同缺血再灌注组。
1.3.3 术后HE染色、光镜观察及MDA、SOD的测定
各实验组终止观察后快速断头取脑,去除大脑、小脑,将所得的脑干组织块漂洗、吸干、切片、保存备用。切片脱蜡、染色、分色、冲洗、复染、脱水、封片等制备HE染色切片行常规病理观察。检测前取出脑干组织块,制成10%的组织匀浆,取上清液储存备用。采用TBA比色法进行测定MDA含量,黄嘌呤氧化酶法检测SOD活性;严格按照MDA、SOD试剂盒使用说明来操作,然后计算结果,本实验由西南医科大学附属医院实验中心协作完成。
1.4 结果判定
动物模型制作过程中,通过观察大鼠生命体征及神经症状(呼吸节律、瞳孔大小、对光反射灵敏度、眼球震颤及肢体活动等),判断模型是否制备成功(34只大鼠参与造模,成功率73.5%)。
1.5 统计学方法
2 结果
2.1 HE染色、光镜观察(×200)
假手术组:神经细胞、血管等组织结构未见明显水肿、出血及坏死。缺血再灌注组:I1R7组可见细胞水肿为主;I3R5组细胞水肿明显,可见血管充血。依达拉奉预处理组:I1R7、I3R5可见细胞水肿,预处理后病理改变较相应缺血再灌注组减轻(图1~6)。

图1 正常神经细胞(HE×200)

图2 正常神经细胞(HE×200)
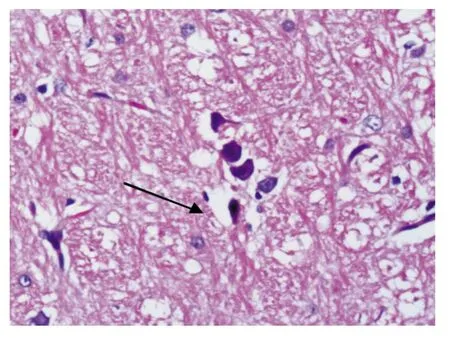
图3 缺血再灌注组水肿(I1R7:HE×200)
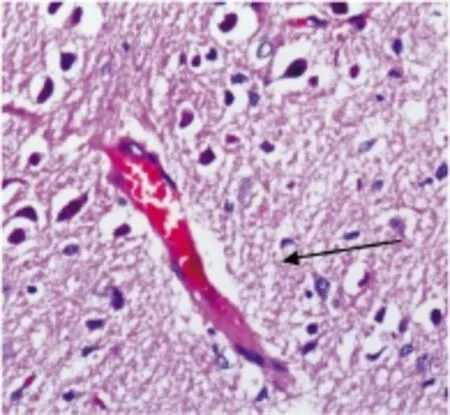
图4 缺血再灌注组充血(I3R5:HE×200)

图5 预处理组水肿(I1R7:HE×200)
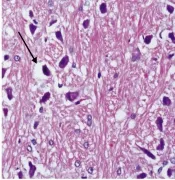
图6 预处理组水肿(I3R5:HE×200)
2.2 大鼠脑干组织MDA含量变化
表1 脑干组织MDA含量测定(nmol/mL)()

表1 脑干组织MDA含量测定(nmol/mL)()
注:a与再灌注组比较,P<0.05;b与假手术组比较,P<0.05
分组假手术组再灌注组预处理组F P 1 h 6.19±0.70a11.44±1.26 7.25±1.09a36.830 0.001 3 h 6.44±0.70a14.18±0.75 7.84±0.92ab133.818 0.000
从表1可见:在缺血1 h时,缺血再灌注组MDA含量高于假手术组和预处理组,差异有统计学意义(P<0.05)。在缺血3h时,与假手术组比较,预处理组和缺血再灌注组MDA含量明显升高,且缺血再灌注组高于预处理组,差异均有统计学意义(P<0.05)。
2.3 大鼠脑干组织SOD含量变化
表2 脑干组织SOD活性的测定(U/mL)()

表2 脑干组织SOD活性的测定(U/mL)()
注:a与再灌注组比较,P<0.05;b与假手术组比较,P<0.05
分组假手术组再灌注组预处理组F P 1 h 101.83±6.30a89.13±7.03 97.66±4.13a5.917 0.016 3 h 100.39±5.93a85.65±4.91 93.03±4.48ab10.266 0.003
由表2可见:在缺血1 h时,缺血再灌注组SOD含量低于假手术组和预处理组,差异有统计学意义(P<0.05)。在缺血3 h时,与假手术组比较,预处理组和缺血再灌注组SOD含量明显降低,且缺血再灌注组低于预处理组,差异均有统计学意义 (P<0.05)。
3 讨论
脑干缺血再灌注的动物模型制作较困难,其原因包括多方面:脑干血供复杂、侧枝循环建立丰富、明确单一缺血区困难、与人体脑干结构相似的动物模型少、脑干损伤死亡率高。故本实验大鼠每亚组采用5只。本实验结合Hukuba N等[2]、Alkan T等[3]、Fang Cao等[4]的相关方法完成动物模型的建立,用夹闭法阻断基底动脉第一、第二无分支区,相比其它方法其优点是使脑干具体缺血部位稳定,延髓的血供得到保障,降低了实验动物的死亡率。研究表明,脑梗死的最佳治疗时间窗为急性脑梗死发病后3~6 h以内[5]。而脑梗死治疗时间窗经相关研究报道:发病后24 h内是超早期治疗的最佳时期[6]。经研究实验动物脑缺血后再灌注时间窗较人类短,约为人类的1/3~1/2,大约为3 h[7]。因此本实验缺血时间定在3 h以内,以保证依达拉奉预处理在再灌注损伤的最佳时间段即时间窗范围左右。
依达拉奉作为特异性自由基清除剂,可有效清除氧自由基、脑中高度细胞毒性的羟基基团、黄嘌呤氧化酶和次黄嘌呤氧化酶等。它是一种捕获羟自由基(-OH)的活性抗氧剂,可降低羟自由基浓度。依达拉奉具脂溶性特点,比较顺利的通过血脑屏障,进入脑脊液。血浆和脑脊液中药物浓度比率可达到68%,且静脉给药后可迅速到达脑内或脊髓中。且其具有改善神经细胞,抑制脑水肿形成,而不影响血小板的功能[8]。据相关文献报道:予以依达拉奉10 mg/kg经尾静脉注射效果优于6 mg/kg静注[9],故本实验采用实验前10 min,予以依达拉奉10 mg/kg剂量预处理。目前依达拉奉已广泛应用于脑缺血再灌注损伤中,大量的基础研究及临床试验已证实其可缓解脑水肿、抑制迟发性神经细胞死亡,机制可能为清除自由基及其引发的脂质过氧化,从而达到改善神经缺损症状及临床表现的作用。总之,依达拉奉通过清除自由基,抑制脂质过氧化,抑制脑细胞、血管内皮细胞、神经细胞的氧化损伤及抑制迟发性神经元死亡等机制,阻止脑水肿和脑损伤的进展。因此,依达拉奉作为预处理药物,是比较适合于临床缺血性脑血管疾病的预防和改善预后的,在确保安全的前提下,对缺血性脑血管疾病的高危人群亦有一定的实用价值。目前,虽然研究已证实,依达拉奉预处理可减少大鼠脑缺血再灌注损伤后脑组织的损伤,对脑组织有保护作用,且依达拉奉预处理可减轻心肌、骨骼肌、肝脏、肠等器官组织的缺血再灌注损伤[10-11],但其对脑干缺血再灌注损伤影响的基础实验性研究仍较缺乏。故本实验主要研究探讨依达拉奉预处理对大鼠脑干缺血再灌注损伤保护机制的影响。
在脑干缺血再灌注损伤机制中,大量自由基的产生是其主要因素之一。脑干组织中局部缺血、缺氧,血管阻塞、破裂,红细胞变性、坏死等都可刺激生成自由基,自由基的产生可诱导三大物质(脂质、蛋白质和核酸)过氧化,细胞膜受损。氧自由基,特别是超氧自由基是组织器官局灶性缺血再灌注后细胞水肿和凋亡的主要病因。而神经细胞更易受到氧自由基的攻击,因其细胞膜富含胆固醇及多价不饱和脂肪酸。氧自由基与生物细胞膜中不饱和脂肪酸发生脂质过氧化反应,其代谢产物即为丙二醛(MDA),因此测定组织中MDA的含量即可间接反映组织中自由基的含量及脂质过氧化的程度。故脑干组织MDA含量越高,氧自由基水平也越高,组织损害越严重。超氧化物歧化酶(SOD)是一种带负电荷的金属蛋白酶,能在生物体内通过歧化的方式清除氧自由基,减少自由基与其他物质的氧化,从而保护生物体免遭自由基的攻击[12],因此检测SOD表达水平的高低可间接反应机体清除氧自由基的能力,脑干组织SOD活力越高,自由基水平越低,而组织损伤越轻,即脑干组织SOD活力高低与组织损伤程度成反比。本实验中,脑干组织MDA含量缺血再灌注组较假手术组显著升高,且随缺血时间延长,MDA含量逐渐增高,即脑干再灌注损伤越严重。依达拉奉预处理组MDA含量也较假手术组高,与缺血再灌注组相比均下降,以缺血1 h再灌注7 h明显,即依达拉奉预处理后,灌注损伤程度减轻。而脑干组织SOD活性,缺血再灌注组较假手术组对应时间点降低;依达拉奉预处理组中依达拉奉预处理后较缺血再灌注组的SOD活性升高明显。从中说明,依达拉奉预处理后,缺血3 h内再灌注损伤都有一定程度的缓解,其中缺血时间越短缓解越明显。
本实验研究发现,大鼠脑干缺血再灌注依达拉奉预处理可增加SOD活性、减少MDA含量,对大鼠脑干缺血再灌注损伤有较好的保护作用,其机制可能与清除自由基,对抗脂质过氧化等有关。
1.Isahaya K,Yamada K,Yamatoku M,et al.Effects of edaravone,a free radical scavenger,on serum levels of inflammatory biomarkers in acute brain infarction [J].J Stroke Cerebrovasc Dis,2012,21(2):102-107.
2.Hukuba N,Koga K,Shudo M,et al.Hearing loss and glutamate efflux in the perilymph following transient hindbrain ischemia in gerbils [J].The Journalof Comparative Neurology,2000,418(2):217-226.
3.Alkan T,Kahveci N,Goren B,et al.Effects of interrupted and uninterrupted occlusion of the basilar artery on cerebral blood flow,and on neurological and histological outcome in rats with subarachnoid hemorrhage[J].Archives of Physiology&Biochemistry,2008,109(109):154-160. 4.Fang Cao,Ryuji Hata,Pengxiang Zhu,et al.Delayed neuronal cell death in brainstem after transient brainstem ischemia in gerbils[J].BMC Neuroscience,2010,11(19): 1-11.
5.Maurer CJ,Egger K,Dempfle AK,et al acing the Time Window in Acute Ischemic Stroke:The Infarct Core[J]. Clin Neuroradiol,2016,2(4):1-6.
6.Shi QJ,Wang H,Liu ZX,et al.HAMI 3379,a CysLT2R antagonist,dose and time dependently attenuates brain injury and inhibits microglial inflammation after focal cerebral ischemia in rats[J].Neuroscience,2015,291:53-59.
7.Fisher M,Takano K,The penumbra,therapeutic time window and acute ischaemic stroke[J].Baillieres Clin Neurol,1995,4(2):279-295.
8.郑敏.依达拉奉与低分子肝素钙治疗急性进展性脑梗死的对比研究 [J].中国现代药物应用,2016,10(3): 143-144.
9.任海燕,王蕾,赵晖,等.依达拉奉对脑缺血再灌注后AQP4表达的影响 [J].新疆医科大学学报,2015,38(8): 963-967.
10.Kazuichiro Hori,Masaya Tsujii,Takahiro Iino,et al. Protective effect of edaravone for tourniquet-induced ischemia-reperfusion injury on skeletal muscle in murine hindlimb [J].BMC Musculoskelet Disord.2013,14(4):651-657.
11.Mitsugi Shimoda,Yoshimi Iwasaki,et al.Edaravone inhibits apoptosis caused by ischemia/reperfusion injury in a porcine hepatectomy model[J].World J Gastroenterol. 2012,18(27):3520-3526.
12.Batinic-Haberle I,Tovmasycm A,Roberts EK,et al. SOD Therapeutics:Latest Insights into Their Structure-Activity Relationships and Impact on the Cellular Redox-Based Signaling Pathways[J].Antioxid Redox Signal.2014, 20(15):2372-2415.
(2016-01-20收稿)
Effect of Edaravone pretreatment on MDA and SOD of brainstem after ischemical reperfusion injury in rats
Li Jiaohong1,Cheng Jinglan2,Li Xiaogang11Department of Neurology;2Department of Dermatology,the Affiliated Hospital of Southwest Medical University,Luzhou 646000,Sichuan Province,China
Objective:To evaluate the protective effect of Edaravone on brainstem after ischemia/reperfusion injury and to provide experimental evidence for clinic,rats were pretreated with Edaravone and its effect on MDA and SOD were studied.Methods:25 SD rats used in experimental animals were divided into 3 groups at random: sham operation group,brainstem ischemia reperfusion group and Edaravone pretreatment group(n=10).According to different ischemia time period,rats in ischemia/reperfusion group and Edaravone pretreatment group were further divided evenly into ischemia 1 h/reperfusion 7 h and ischemia 3 h/reperfusion 5 h subgroups,respectively. The 1st and the 2nd basilar artery without branch areas were exposed,and animals were observed without any treatment for 8 h in normal group,the arteries were clamped with Micro-bulldog clamp to create ischemia for 1 h/ reperfusion 7 h(5 animals)and ischemia for and 3 h/reperfusion 7 h (5 animals)respectively in ischemia reperfusion group,and animals in Edaravone pretreatment group were given Edaravone(6 mg/kg)by tail vein injection 10 min before ischemia/reperfusion as described in ischemia/reperfusion group.The histology of brainstems after HE staining were compared,the brainstem tissues at various stages was observed by light microscope at 200 magnification.The activities of SOD and the contents of MDA at various subgroups were measuredwith spectrophotometry.Results:When the time on ischemia 1 h,compared with the normal group and pretreatment group,the contents of MDA were significantly increased and the contents of SOD were obviously decreased in ischemia reperfusion group,the differences all had statistical significance(P<0.05).When the time on ischemia 3 h,compared with the normal group,the contents of MDA were significantly increased and the contents of SOD were obviously decreased in pretreatment group and ischemia reperfusion group,the differences all had statistical significance(P<0.05);Compared with the pretreatment group,the contents of MDA were significantly increased and the contents of SOD were obviously decreased in ischemia reperfusion group,the differences all had statistical significance(P<0.05).Conclusion:Edaravone played a tremendous and definite role in ischemia reperfusion injury of brainstem in rats.Its mechanism has to do with the reduced levels of MDA,the increased activity of SOD,the removal of oxyradicals,and the inhibited overoxidation of lipid.
Edaravone;Pretreatment;Brainstem ischemical reperfusion;MDA;SOD
R743
A
10.3969/j.issn.1000-2669.2016.02.005
李娇红(1986-),女,硕士,医师。E-mail:61752273@qq.com
