响应面法优化β-甘露聚糖酶发酵培养基的研究
2016-03-30王常高林建国
■杨 苗 蔡 俊 王常高 杜 馨 林建国
(湖北工业大学发酵工程教育部重点实验室工业发酵湖北省协同创新中心,湖北武汉430068)
响应面法优化β-甘露聚糖酶发酵培养基的研究
■杨苗蔡俊王常高杜馨林建国
(湖北工业大学发酵工程教育部重点实验室工业发酵湖北省协同创新中心,湖北武汉430068)
摘要:研究采用响应面法对路氏肠杆菌(EnterobacterludwigiiMY271)液体发酵产β-甘露聚糖酶的培养基进行优化。在前期单因素试验对培养条件及培养基优化的基础上,利用Plackett-Burman试验设计筛选出影响产酶的3个显著性因素:魔芋粉、Na2HPO4和MgSO4。在此基础上,运用最陡爬坡试验找到中心复合试验的中心点,然后研究不显著因素的最低添加量来降低生产成本,最后利用中心复合设计确定显著性因素之间的交互作用及最佳组成。结果表明,魔芋粉14 g/l、蛋白胨18 g/l、Na2HPO40.7 g/l、KH2PO40.5 g/l、ZnSO40.15 g/l、MgSO40.01 g/l,β-甘露聚糖酶酶活可达到62.76 U/ml,与模型预测值相近,且与单因素优化后的酶活(30.02 U/ml)相比,提高了109.06%。通过响应面法优化培养基组分,酶活得到了显著提高,为该酶制剂的大规模生产奠定了基础。
关键词:路氏肠杆菌;β-甘露聚糖酶;响应面法;培养基优化
β-甘露聚糖是一种非淀粉多糖,为植物性原料中的主要抗营养因子,其在非反刍动物体内不能被消化,而且由于甘露聚糖的吸水性高、黏性高,当其作为饲料时,将极大地阻碍其他营养成分的吸收[1]。微生物酶制剂作为一种绿色饲料添加剂,因其来源的无害性及其功用的广泛性,使其在饲料工业和养殖行业中得到了普遍重视和广泛应用。β-甘露聚糖酶(β-man⁃nanase, EC 3.2.1.78)是一种胞外诱导酶,能够水解含有β-1,4甘露糖苷键的甘露聚糖、葡甘露聚糖、半乳甘露聚糖、半乳葡甘露聚糖为甘露低聚糖[2]。甘露低聚糖作为肠道有益菌双歧杆菌的增殖因子,能够促进肠道内以双歧杆菌为代表的有益菌群的增殖,同时抑制产气荚膜梭菌的生长[3-4]。饲料中使用β-甘露聚糖酶能降解少量的甘露聚糖,消除抗消化作用和营养因子,提高饲料利用率,加速家畜的生长。同时,β-甘露聚糖酶还广泛应用于烘焙、咖啡萃取、纺织印染、造纸制浆等工业中[5-7]。
发酵条件的优化是提高微生物产酶量、降低发酵生产成本的重要途径。目前,在发酵条件优化过程中,常使用的试验设计包括单因素、正交试验、响应面法等[8-9]。而单因素无法考虑到因素之间的交互作用,正交试验无法得到全面可靠的水平组合;响应面法是采用多元二次回归方程来拟合因素与响应值之间的关系,因而其被广泛地应用于微生物发酵条件的优化和模型建立中[10-11]。关丛笑等(2013)[12]采用响应面法对费氏新萨托菌G5产β-甘露聚糖酶发酵过程进行优化分析,使产酶水平由最初的14.22 U/ml提高到35.55 U/ml。Lin等(2004)[13]通过黑曲霉(Aspergillusni⁃gerNCH189)液态发酵获取β-甘露聚糖酶,产酶水平为27.4 U/ml。Yin等(2013)[14]利用CCD中心复合试验研究了黑曲霉固态发酵产β-甘露聚糖酶的工艺,酶活达到561.3 U/g。
本研究以实验室筛选的路氏肠杆菌(Enterobac⁃terludwigiiMY271)作为出发菌株,在前期单因素试验的基础上,利用响应面法对其液态发酵产β-甘露聚糖酶的培养基成分进行优化,以期提高酶活,为后期实现该酶的大规模生产及其在饲料工业中的应用提供参考。
1材料与方法
1.1材料
1.1.1试验菌株
本实验室自行筛选获得的路氏肠杆菌(Enterobac⁃terludwigiiMY271),该菌株已保藏于中国典型培养物保藏中心,专利保藏号为CCTCC M 2015182。
1.1.2主要试剂和仪器
魔芋粉(武汉强森魔芋有限公司)、甘露糖(武汉市华顺生物技术有限公司)、3,5-二硝基水杨酸(DNS)(国药集团化学试剂有限公司)、酶标仪(Gene Compa⁃ny Limited)、立式压力蒸汽灭菌器(上海博讯实业有限公司医疗设备厂)、单人净化工作台(SW-CJ-1D型,苏州净化设备有限公司)、台式高速冷冻离心机3K15(德国Sigma公司)、ZHWY-2102C恒温培养箱振荡器(上海智城分析仪器制造有限公司)。
1.1.3培养基
种子培养基:蛋白胨10 g/l、牛肉膏3 g/l、NaCl 5 g/l,pH值自然。
发酵培养基:魔芋粉8 g/l、蛋白胨19 g/l、KH2PO42 g/l、Na2HPO42 g/l、NaCl 0.2 g/l、MgSO40.2 g/l、ZnSO40.2 g/l,pH值自然。
斜面保藏培养基:蛋白胨10 g/l、牛肉膏3 g/l、NaCl 5 g/l、琼脂20 g/l,pH值自然。
1.2方法
1.2.1 β-甘露聚糖酶的制备与酶活测定
将9%的种子液接种到发酵培养基中,30℃、160 r/min培养48 h,8 000 r/min、4℃离心15 min,即得粗酶液。
DNS法测定β-甘露聚糖酶酶活:以0.5%(w/v)的魔芋纯化粉为底物(用0.05 mol/l、pH值为6.4的磷酸盐缓冲溶液配制),参照Akino等(1987)[15]的方法,在1.5 ml底物中加入0.5 ml适当稀释的酶液,置55℃水浴反应10 min,加入DNS试剂3 ml,置沸水浴中煮沸5 min显色,然后以流水迅速冷却,用蒸馏水定容至25 ml,以预先灭活的酶液为空白对照,最后用酶标仪在540 nm处测定吸光值。
酶活定义:在上述测定条件下,每分钟产生1 μmol还原糖的酶量定义为1个酶活力单位(U)。
1.2.2 Plackett-Burman设计
PB设计是一种2水平的试验设计方法,是以少量试验次数挑选出对目的产物有显著性影响的因素的试验方法[16]。选用试验次数N=12的试验设计,选取单因素优化试验中对菌株产β-甘露聚糖酶影响较大的培养基的7个组分,每个因素取高低2个水平,低水平为“-”,高水平为“+”,以β-甘露聚糖酶的酶活(U/ml)为响应值Y,共进行12次试验选取可信度大于95%以上的因素作为影响菌株产β-甘露聚糖酶的主要因素。Plackett-Burman试验设计的各因素和水平见表1。

表1 Plackett-Burman试验因素与水平设计
1.2.3最陡爬坡试验
根据PB试验所得到的3个显著性因素,以其正负效应设定各因素的步长及变化方向进行试验,从而逼近最大响应区域,找到最大拐点值,确定下一步中心复合试验的中心点。
1.2.4最低添加量试验
对于PB试验分析得出的不显著因素,为了尽量减少成本、提高效益及简化培养基组分,采用单因素试验确定这些培养基成分最优最小的用量。
1.2.5 Central composite design(CCD)响应面优化试验
根据PB设计及最陡爬坡试验的结果,通过3因素5水平的试验设计来确定路氏肠杆菌的最适培养基成分。CCD试验可利用有限的试验次数,评价各个因素的影响,并分析各个因素之间的相互作用,分析过程中对试验结果采用二阶经验模型对数据进行拟合。CCD试验自变量水平的编码值和实际值见表2。

表2中心复合设计试验因素与水平设计
1.2.6验证试验
根据Design expert 8.0.5对回归方程在试验范围内产酶最佳培养基组分浓度进行试验,将所测定的酶活与响应面预测值进行比较,以验证模型是否可靠,进而确定最终优化培养基组成。
2结果与分析
2.1 PB试验结果与分析
PB试验设计结果见表3。对表3中的试验结果进行方差分析和回归分析,分析结果见表4和表5。

表3 Plackett-Burman试验设计
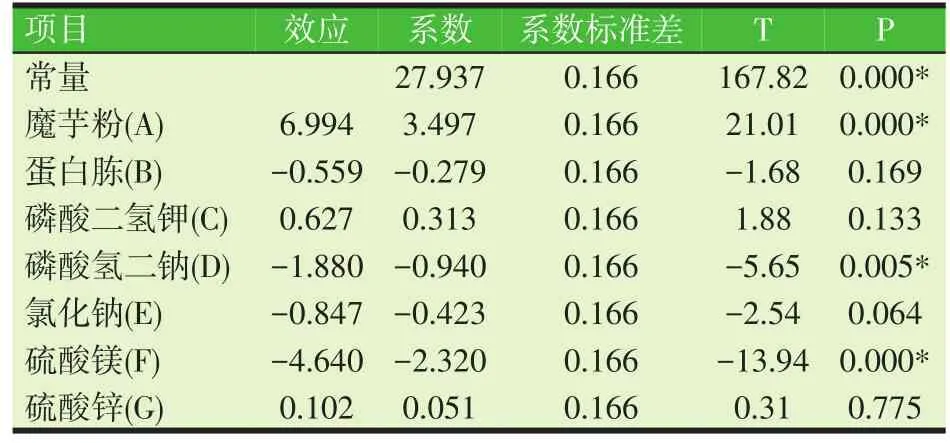
表4 Plackett-Burman试验设计的回归分析

表5 Plackett-Burman试验设计方差分析
由表4可看出,该回归模型的P值(prob>F)< 0.000 1,为高度显著,表明该模型在所得回归区域拟合很好。且魔芋粉、Na2HPO4和MgSO4的P值分别为< 0.000 1、0.005和<0.000 1,均小于0.05,则魔芋粉、Na2HPO4和MgSO4在95%的置信区间内高度显著,而蛋白胨、KH2PO4、NaCl和ZnSO4的P值均大于0.05,则蛋白胨、KH2PO4、NaCl和ZnSO4在95%的置信区间内不显著。由表5可知,其决定系数R2=99.42%,表示模型中99.42%的数据都能用此模型来解释,即表示该回归方程的拟合程度很好。
2.2最陡爬坡试验
根据PB试验的回归分析和方差分析,按照各因素的正负效应来设定最陡爬坡试验(见表6)。魔芋粉为正效应,步长2 g/l,Na2HPO4与MgSO4为负效应,步长分别为0.4、0.05 g/l。
由表6可知,第4组试验时β-甘露聚糖酶酶活最高,即魔芋粉、Na2HPO4和MgSO4的用量分别为14、0.8 g/l和0.05 g/l时,酶活为49.750 U/ml,故选择魔芋粉、Na2HPO4和MgSO4的添加量分别为14、0.8 g/l和0.05 g/l作为中心复合设计的中心点。
2.3最低添加量试验(见图1)
对PB试验得到的4个不显著因素蛋白胨、KH2PO4、NaCl、ZnSO4做最低添加量试验,以期达到培养基成分最优最小的用量。
由图1a可知,随着蛋白胨添加量的增加,β-甘露聚糖酶酶活逐渐增加,当添加量为18.0 g/l时,β-甘露聚糖酶酶活达到最大值52.34 U/ml;由图1b可知,KH2PO4的用量在0.5~2.0 g/l范围内递增时,β-甘露聚糖酶酶活基本没有变化,而加入KH2PO4后的酶活高于没有加入KH2PO4时β-甘露聚糖酶酶活,故选择KH2PO4的添加量为0.5 g/l;由图1c可知,随着NaCl含量的增加,β-甘露聚糖酶酶活基本趋于平衡,为节省成本,故选择NaCl添加量为0 g/l;由图1d可知,随着ZnSO4添加量的增加,β-甘露聚糖酶酶活逐渐增加,当添加量为0.15 g/l时,β-甘露聚糖酶酶活达到最大值55.03 U/ml。故选择蛋白胨、KH2PO4、NaCl、ZnSO4的添加量分别为18、0.5、0、0.15 g/l。

表6最陡爬坡试验设计与结果
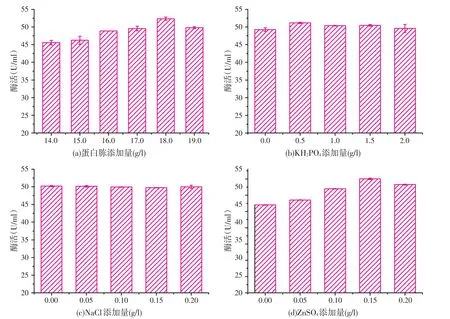
图1最低添加量的试验设计与结果
2.4中心复合试验设计
经PB设计筛选得到3种显著影响β-甘露聚糖酶酶活的培养基成分,即魔芋粉、磷酸氢二钠和硫酸镁,根据最陡爬坡试验得到中心复合试验的中心点,即魔芋粉、Na2HPO4和MgSO4的添加量分别为14、0.8 g/l和0.05 g/l。以此3种显著性因素的浓度(g/l)为自变量,β-甘露聚糖酶的酶活(U/ml)为响应值,进行3因素5水平的中心复合设计试验。其设计及结果见表7。

表7中心复合试验设计
响应面分析中对CCD试验结果进行拟合二次模型的方差分析(见表8)。模型的P值(prob>F)小于0.05,说明模型具有显著性,该二次模型多元相关系数R2=93.06%,即预测仅有6.94%的变异情况不能由该模型解释;失拟项P值为0.122 1,表明失拟项不显著,即模型没有失拟现象。A、C、A2、B2对酶活的影响显著,AB、AC、BC之间的交互影响均显著。

表8中心复合设计回归分析
利用软件对试验数据进行方差分析后得到模型的二次多项回归方程:
Y=60.08+1.14A+0.88B-2.24C+2.85AB-1.76AC+ 2.06BC-3.26A2-1.96B2-0.91C2。
式中:Y——β-甘露聚糖酶的预测值(U/ml);
A、B、C——分别代表魔芋粉、Na2HPO4和MgSO4的质量浓度(g/l)。
根据Design expert 8.0.5软件对回归方程中的交互项AB、AC和BC绘制响应面分析图,观察其对β-甘露聚糖酶的影响。

图2魔芋粉和磷酸氢二钠的交互作用对酶活影响的响应面图
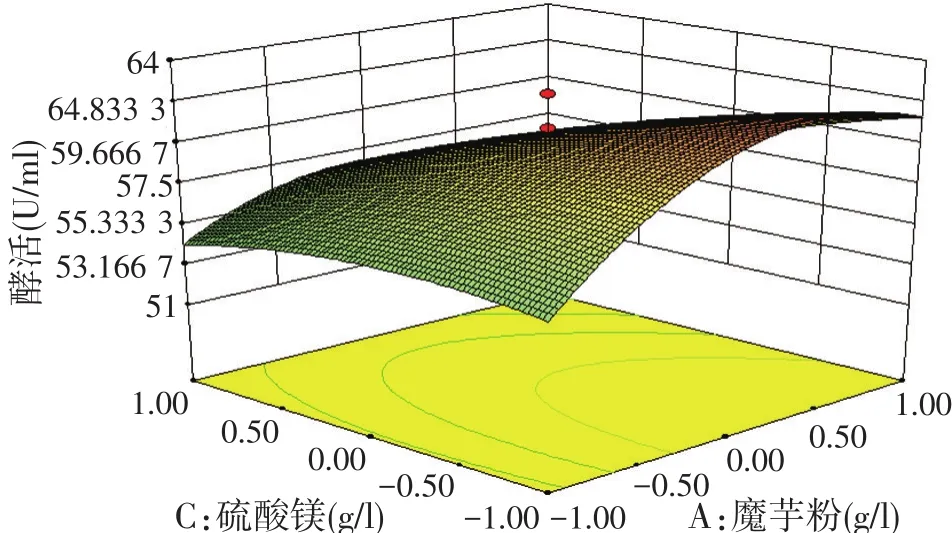
图3魔芋粉和硫酸镁的交互作用对酶活影响的响应面图

图4磷酸氢二钠和硫酸镁的交互作用对酶活影响的响应面图
由图2可知,当魔芋粉添加量不变时,随着Na2HPO4含量的增加,酶活力出现了先增大后减小的趋势。同样,当Na2HPO4含量不变时,随着魔芋粉添加量的增加,酶活力也出现了明显先增大后减小的趋势,且曲面呈钟罩型,说明两者之间交互作用显著。由图3可知,当MgSO4添加量不变时,魔芋粉含量对酶活存在二次效应,其曲面呈现抛物面。由图4可知,在试验水平内,Na2HPO4和MgSO4存在一定的交互作用,即确定一个因素添加量不变时,另一因素呈现先增大后减小的趋势。
2.5验证试验
通过Design expert 8.0.5软件对回归方程求解,预测菌株产β-甘露聚糖酶的最佳培养基组成为:魔芋粉14 g/l、Na2HPO40.7 g/l、MgSO40.01 g/l,其他培养基成分为:蛋白胨18 g/l、KH2PO40.5 g/l、ZnSO40.15 g/l,在此条件下作3次验证性试验,测得β-甘露聚糖酶酶活平均值为62.76 U/ml。实测值与回归方程预测值62.69 U/ml相对误差很小,由此可见,用该回归模型优化EnterobacterludwigiiMY271产β-甘露聚糖酶进行的分析和预测是可行的,且具有实用价值。此外,与单因素优化后的最大酶活力(30.02 U/ml)相比,提高了109.06%。
3 结论
本研究以实验室自行筛选并保存的Enterobacter ludwigii MY271,利用响应面法对其液体发酵产酶培养基成分进行优化,得到的最佳培养基组分为:魔芋粉14 g/l、蛋白胨18 g/l、Na2HPO40.7 g/l、KH2PO40.5 g/l、ZnSO40.15 g/l、MgSO40.01 g/l。在此条件下进行3次验证试验,试验结果与预测值基本吻合,说明运用响应面法优化路氏肠杆菌产β-甘露聚糖酶是合理可靠的,且酶活与单因素优化后的最大酶活力(30.02 U/ml)相比,提高了109.06%,是野生菌株最初酶活(2.87 U/ml)的21.87倍。本试验通过响应面法优化培养基组分显著提高了产酶水平,为工业上实现β-甘露聚糖酶的大规模生产提供了有价值的参考;同时,其降解得到的甘露低聚糖能够减少致病菌的产生,且没有药物残留,没有抗药性,是良好的饲用抗生素替代品。
参考文献
[1]王苑,梁陈冲,于会民,等.甘露聚糖酶、α-半乳糖苷酶和木聚糖酶及地衣芽孢杆菌不同配伍组合对肉仔鸡生长性能及营养物质表观消化率的影响[J].饲料工业, 2015(2): 18-21.
[2] Pan X, Zhou J, Tian A, et al. High level expression of a truncated β-mannanase from alkali philic Bacillus sp. N16-5 in Kluyvero⁃mycescicerisporus[J]. Biotechnology Letters, 2011, 33: 565-570.
[3] Chen J, Liu D, Shi B. Optimization of hydrolysis conditions for the production of glucomanno-oligosaccharides from konjac using β- mannanase by response surface methodology[J]. Carbohydrate Polymers, 2013, 93(1): 81-88.
[4] Chen H L, Fan Y H, Chen M E, et al. Unhydrolyzed and hydro⁃lyzed konjac glucomannans modulated cecal and fecal microflora in Balb/c mice[J]. Nutrition, 2005, 21(10): 1059-1064.
[5] Chauhan P S, Puri N, Sharma P, et al. Mannanases: microbial sources, production, properties and potential biotechnological ap⁃plications[J]. Applied Microbiology and Biotechnology, 2012, 93 (5): 1817-1830.
[6] Kansoh A L, Nagieb Z A. Xylanase and mannanase enzymes from Streptomyces galbus NR and their use in biobleaching of softwood kraft pulp[J]. Antonie Van Leeuwenhoek, 2004, 85(2): 103-114.
[7] Yang H, Shi P, Lu H, et al. A thermophilic β-mannanase from NeosartoryafischeriP1 with broad pH stability and significant hy⁃drolysis ability of various mannan polymers[J]. Food Chemistry, 2015, 173: 283-289.
[8]曲丽娜,王瑞明,肖静.β-甘露聚糖酶高产菌株发酵条件优化[J].食品与发酵工业, 2012, 38(12): 64-69.
[9]韩健,刘朝辉,齐崴.β-甘露聚糖酶发酵液絮凝条件的统计学筛选与响应面优化[J].生物加工过程, 2007, 5(2): 29-35.
[10] Cui F J, Li Y, Xu Z H, et al. Optimization of the medium compo⁃sition for production of mycelial biomass and exo-polymer by Grifola frondosa GF9801 using response surface methodology[J]. Bioresource Technology, 2006, 97(10): 1209-1216.
[11] Lin S, Dou W, Xu H, et al. Optimization of medium composition for the production of alkaline β-mannanase by alkali philic Ba⁃cillussp. N16-5 using response surface methodology[J]. Applied Microbiology and Biotechnology, 2007, 75(5): 1015-1022.
[12]关丛笑,邵明洋,胡宗福.响应面法优化费氏新萨托菌G5产β-甘露聚糖酶[J].化学工业与工程, 2013, 30(3): 7-12.
[13] Lin Tc, Chen C. Enhanced mannanase production by submerged culture of Aspergillus niger NCH- 189 using defatted copra based media[J]. Process Biochemistry, 2004, 39(9): 1103-1109.
[14] Yin J S, Liang Q L, Li D M, et al. Optimization of production conditions for β-mannanase using apple pomace as raw material in solid-state fermentation[J]. Annals of Microbiology, 2013, 63 (1): 101-108.
[15] Akino T, Nakamura N, Horikoshi K. Production of β-mannosi⁃dase and β-mannanase by an alkalophilic Bacillus sp.[J]. Ap⁃plied Microbiology and Biotechnology, 1987, 26(4): 323-327.
[16] Plackett R L, Burman J P. The design of optimum multifactorial experiments[J]. Biometrika, 1946: 305-325.
(编辑:刘占,laramie_liu@139.com)
Optimization of fermentation medium for β-mannanase production using response surface methodology
Yang Miao, Cai Jun, Wang Changgao, Du Xin, Lin Jian’guo
Abstract:In this study, response surface methodology (RSM) was employed to optimize a liquid fer⁃mentation medium for β-mannanase production of Enterobacter ludwigii MY271. Based on single fac⁃tor experiments used to optimize cultural conditions and the medium, three significant influence fac⁃tors were screened by the method of Plackett-Burman design as: konjak powder, Na2HPO4, MgSO4.Un⁃der the conditions, the steepest ascent design was applied to obtain the center point of central compos⁃ite design. For reducing the source cost, the minimum addition amount experiment was used to find out the minimum addition amount of non-significant factors. And the optimal concentration and corre⁃lations among three factors were identified by central composite design. The result indicated that the optimal fermentation components for β-mannanase production were as follows: konjak powder 14 g/l, peptone 18 g/l, Na2HPO40.7 g/l, KH2PO40.5 g/l, ZnSO40.15 g/l and MgSO40.01 g/l. The enzyme activi⁃ty in vertification test reached 62.76 U/ml, consistent with the model predicted value, which is 109.06% higher than that of single factor experiments results. By optimizing the fermentation medium using RSM, the enzyme activity was improved significantly, which lays the foundation for large-scale production of the enzymic preparations.
Key words:Enterobacterludwigii;β-mannanase;RSM;medium optimization
收稿日期:2015-12-07
通讯作者:蔡俊,教授。
作者简介:杨苗,硕士,研究方向为发酵过程优化与放大。
中图分类号:Q55
文献标识码:A
文章编号:1001-991X(2016)04-0048-06
doi:10.13302/j.cnki.fi.2016.04.012
