蛋白磷酸酶2A的Cβ亚基在胚胎成纤维细胞凋亡过程中的作用
2016-03-30王庆华王生存吴刘成彭晓清邵义祥
王庆华,王生存,李 斌,刘 春,吴刘成,王 旭,彭晓清 ,邵义祥*
(1.南通大学实验动物中心,江苏南通 226001; 2.南通大学附属医院儿科,江苏南通 226001)
蛋白磷酸酶2A的Cβ亚基在胚胎成纤维细胞凋亡过程中的作用
王庆华1,王生存1,李斌2,刘春1,吴刘成1,王旭1,彭晓清1,邵义祥1*
(1.南通大学实验动物中心,江苏南通 226001; 2.南通大学附属医院儿科,江苏南通 226001)
摘要:为探究蛋白磷酸酶2A的Cβ亚基在胚胎成纤维细胞(MEFs)凋亡过程中的作用,用Cβ+/-的杂合子雄鼠与雌鼠1∶2配对,取胚胎期12.5 d(E12.5)的胚胎制备MEFs,用PCR、RT-PCR和Western blot方法进行基因型鉴定。同时对P3代MEFs利用流式分选技术检测其细胞凋亡和细胞周期的变化,并采用Western blot检测抗凋亡蛋白Bcl-2的表达。结果采用胰酶消化方法成功获得了MEFs,DNA、RNA和蛋白水平鉴定显示获得了3对3的野生型和Cβ基因敲除MEFs。流式分选发现Cβ基因敲除MEFs和野生型之间细胞分裂期前期(M1期)细胞分别为53.95%±2.81和46.94%±4.17,细胞分裂期后期(M2期)细胞分别为21.14%±2.53和29.83%±3.25。但Bcl-2的蛋白表达量和mRNA表达量没有显著差异。 结果表明,虽然蛋白磷酸酶2A的Cβ亚基的缺失并不会导致小鼠胚胎死亡,但Cβ亚基的缺失会轻微影响胚胎成纤维细胞(MEFs)的细胞周期。
关键词:胚胎成纤维细胞;细胞凋亡;细胞周期
细胞凋亡又称程序性细胞死亡,是由细胞所处局部环境的生理性或病理性刺激引起的一种受基因调控的有序的细胞非炎症性死亡,是基因调控下的一种主动性死亡过程,在调节细胞分裂及组织器官发育上起着重要的作用。Bcl-2家族是调控细胞凋亡关键的因子,其抑制凋亡是通过抑制细胞膜上脂质过氧化物的形成[1],控制内质网上钙离子的释放[2],降低线粒体膜通透性并增加其摄取钙离子[3],抑制细胞色素C释放或直接抑制促凋亡因子[4]发挥作用的。
PP2A 是30多个丝/苏氨酸蛋白磷酸酶之一,其结构亚基A和催化亚基C各具有α和β异构体,具有4种不同的调节亚基家族,可以组成100多种不同的全酶,能使众多底物去磷酸化,从而影响细胞的增殖、分化和凋亡[5],其中Cα的表达量为Cβ的10倍。PP2A蛋白表达量高,在有的细胞中能达到总蛋白的1%[6]。Cα基因(ppp2ca)敲除后小鼠胚胎无法正常发育,在胚胎期6.5 d(E6.5)死亡,而Cβ基因(ppp2cb)敲除后小鼠胚胎能正常发育并存活,无明显可见表型[7]。PP2A的催化活性受到许多因素调节,如调节亚基、翻译后修饰、抑制性蛋白质、第二信使和酶抑制剂等。神经酰胺介导的细胞凋亡机制涉及1个线粒体PP2A对Bcl-2抗凋亡蛋白的去磷酸化和灭活作用,这个线粒体PP2A三聚体含有PR61α亚基,能直接作用于线粒体膜Bcl-2,使其去磷酸化,而神经酰胺也能上调PR61α的表达并促进其向线粒体膜易位。因此PR61-PP2A在凋亡过程中起促进作用[7-8]。本研究通过流式细胞分选技术以及蛋白免疫印迹方法检测了PP2A Cβ亚基敲除鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)的细胞周期分布、凋亡及抗凋亡因子Bcl-2的表达,探讨了Cβ亚基在细胞凋亡的作用。
1材料与方法
1.1材料
1.1.1主要试剂实时定量荧光PCR反应试剂盒为南京诺维赞公司产品;Trizol为TaKaRa公司产品;PI(Propidium iodide)染色液为Sigma公司产品;抗Cyclin D1抗体(#2922)、抗Bcl-2(#3498)抗体为Cell Signaling Technology公司产品;PP2A-C抗体(#80665)为Santa Cruz 公司产品;引物由南京金斯瑞生物科技有限公司合成。
1.1.2实验动物PP2A Cβ亚基敲除鼠(敲除鼠)和同窝野生型对照鼠(野生型鼠)均来自于南京大学模式动物研究所。
1.2方法
1.2.1胚胎成纤维细胞制备将PP2ACβ+/-雄性小鼠与雌性小鼠以1∶2比例配对,配2笼,每天8点之前检查小鼠阴道栓,见栓当天胚龄记为E0.5。取E12.5胚胎,将尾巴和四肢留作基因型鉴定用,去除头及内脏,其余剪碎后用2.5 g/L的胰酶在37 ℃水浴中震荡消化20 min,3 000 r/min离心3 min,去上清后用含100 mL/L FBS的DMEM重悬,均匀接种到6 cm培养皿中,次日换液。根据基因型鉴定结果留3个野生型鼠MEFs和3个Cβ基因敲除鼠MEFs作为试验用,标记为P1代,此后每传代1次,细胞代数加1,本试验使用P3代细胞作为试验对象。
1.2.2流式细胞术检测细胞周期和凋亡取P3代胚胎成纤维细胞,胰酶消化后收集,计数,以1×106个细胞/100 μL的量加入FACS管。加1 mL PBS清洗细胞,500 r/min离心5 min,去上清。重复洗1次后用100 μL流式细胞染色缓冲液(含10 g/L BSA的PBS缓冲液)重悬细胞,加入10 μL PI染色液,混匀,冰上或者室温避光孵育10 min~15 min。上机检测。
1.2.3基因型鉴定及基因表达检测用PCR和RT-PCR进行基因型鉴定。常规酚氯仿法抽提胚胎DNA,使用25 μL体系用引物Cb-Cred-F3/R3(表1)进行PCR扩增,59 ℃退火,35个循环;产物用20 g/L的琼脂糖凝胶电泳鉴定。用Trizol抽取胚胎RNA,去除基因组DNA后反转录为cDNA,以cDNA为模板用引物Ex345F/Ex3R2(表1)进行PCR扩增,58 ℃退火,20个循环;产物用20 g/L琼脂糖凝胶电泳进行鉴定。荧光定量PCR检测时以cDNA为模板,用SYBR Premix EXTaq体系进行扩增:95℃ 5 s,60℃ 30 s,40个循环。引物为QBcl2-F/R,QCnnd1-F/R(表1)。收集细胞后用RIPA于4 ℃裂解30 min,12 000 r/min 4 ℃离心15 min,取上清,BCA法测定浓度后加入上样缓冲液煮沸变性5 min,80 g/L的分离胶进行SDS-PAGE,100 V电泳90 min,湿法转膜80 min后,50 g/L脱脂奶粉封闭1 h,一抗4 ℃过夜。TBST洗涤5 min,共3次,二抗室温孵育1 h后洗膜并ECL显影。
1.2.4统计分析应用Spss13.0统计软件,计量数据用均数±标准差表示,采用t检验,P<0.05为差异有统计学意义。
2结果
2.1胚胎成纤维细胞(MEFs)制备和基因型鉴定
取E12.5的胚胎制作成MEFs,取胚胎尾巴及四肢提取DNA和RNA。以DNA为模版,用引物Cb-cred-F3/R3进行PCR扩增,产物用20 g/L琼脂糖凝胶电泳检测,Cβ基因敲除鼠MEFs(ppp2cafl/flcb-/-)检测到339 bp的条带,而野生型鼠(ppp2cafl/flcb+/+)检测到856 bp的条带(图1A)。将RNA反转录为cDNA,作为模板用引物Ex345F/Ex3R2进行RT-PCR扩增,产物用20 g/L的琼脂糖凝胶进行电泳检测,Cβ基因敲除鼠检测到136 bp条带,而野生型鼠检测到310 bp的产物(图1B)。在此基础上,Western blot检测胚胎成纤维细胞中PP2A蛋白的表达,纯合子中PP2A蛋白表达量略有降低(图1C、图1D)。
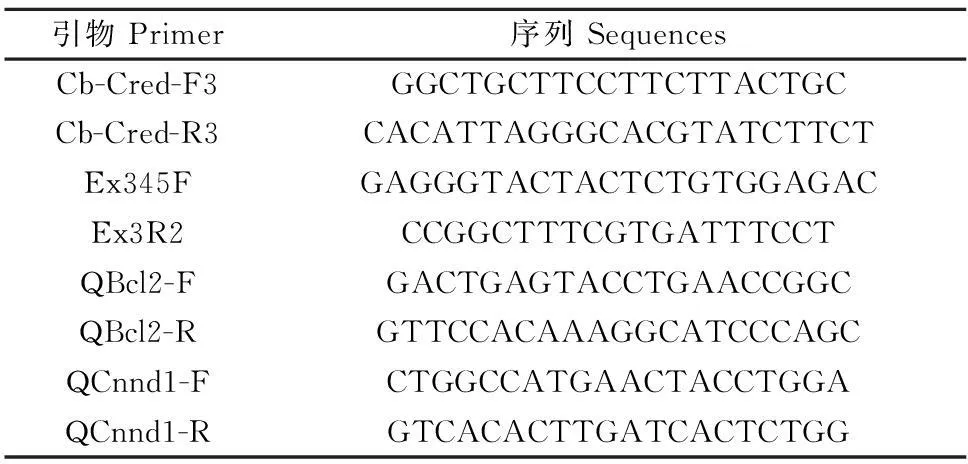
表1 引物序列
2.2流式细胞分选技术检测细胞凋亡和细胞周期
用PI染色后流式细胞分选技术检测P3代MEFs细胞凋亡,其中PP2A Cβ敲除MEFs(ppp2cafl/flcb-/-)中凋亡细胞的比例为16.9%±1.36,而野生型MEFs(ppp2cafl/flcb+/+)中凋亡细胞的比例为14.4%±1.48,Cβ基因敲除的MEFs中比例略高于野生型MEFs(图2A)。取P3代MEFs,用PI染色后流式细胞术检测细胞周期分布情况,PP2A Cβ基因敲除MEFs中处于M1期的细胞比例为53.95%±2.81,处于M2期的细胞比例为21.14%±2.53;而野生型MEFs细胞周期中处于M1期的细胞比例为46.94%±4.17,处于M2期的细胞比例为29.83%±3.25(图3)。PP2A Cβ基因敲除的MEFs处于M1期的细胞比例高于野生型细胞,而处于M2期的细胞比例低于野生型细胞。
2.3凋亡相关基因表达的检测
Bcl-2(B-cell lymphoma-2)是Bcl2家族中关键蛋白,具有抑制多种细胞毒引起的细胞凋亡的功能。取P3代MEFs细胞提取RNA,用QPCR分析Bcl-2的表达,发现二者并没有显著性差异(图4)。Western blot结果显示,PP2A Cβ基因敲除MEFs和野生型MEFs之间Bcl-2蛋白表达量并无显著差异(图5)。细胞周期蛋白D1(Cyclin D1)是由Cnnd1编码的一个高度保守的蛋白,贯穿细胞周期的始终,是周期蛋白依赖性激酶关键调节因子,协助调控细胞周期进程。该基因突变后引起细胞向癌症细胞转化[10]。用QPCR分析发现Cnnd1基因的表达在Cβ基因敲除MEFs和野生型MEFs之间差异不显著(图4)。Western blot结果也显示两者之间Cyclin D1的蛋白表达量没有显著性差异(图5)。

A.PCR鉴定MEFs Cβ基因敲除效率;B.RT-PCR鉴定MEFs Cβ基因敲除效率;C.Western blot鉴定MEFs PP2A敲除效率
1. 野生型MEFs(ppp2cafl/flcb+/+); 2. Cβ基因敲除MEFs(ppp2cafl/flcb-/-)
A. PCR amplification on the knockout efficiency of ppp2cb in MEFs with primers Cb-Cred-F3/R3; B. RT-PCR amplification on the knockout efficiency in MEFs with primers Ex345F/Ex3R2; C. Western blot analysis on the protein expression of PP2AC in knockout MEFs and the control; D. Density analysis on the western blot bands.
1 .Wildtype MEFs (ppp2cafl/flcb+/+); 2. Cβ knockout MEFs(ppp2cafl/flcb-/-)
图1MEFs Cβ基因敲除效率鉴定
Fig.1Identification of Cβ gene knockout efficiency in MEFs
3讨论
PP2A是一个广泛性表达的蛋白,主要参与蛋白脱磷酸化过程,从而调控机体的各种生命活动,包括细胞周期和凋亡过程。细胞周期是指连续分裂细胞从一次有丝分裂结束到下一次有丝分裂所经历的所有过程。包括间期和有丝分裂期。间期以DNA合成为标志,由G1期、S期和G2期构成,而M期是细胞分裂的主要阶段,并形成新的细胞。这过程受到内源性“Cyclin-CDKs-CKIs”调控网络的调节,从而完成器官和组织的发育。其中Cyclin为正向调控CDKs的关键因子,研究表明PP2A(Cdc55/B55)能够调控Cyclin D1的转录过程[11]。细胞凋亡是由基因控制的细胞程序性自主死亡,用以调控其内环境稳态。细胞凋亡不同于细胞坏死,其表现为主动过程,包含了一系列基因的激活、表达及调控等,是机体为更好地适应生存环境而主动发挥的一种自体清理机制,整个过程受到多个基因的严格控制,这些基因在种属之间非常保守,如Bcl-2家族、caspase家族、促癌基因C-myc、抑癌基因P53等,其中Bcl-2是Bcl-2家族中的关键成员,能够抑制细胞凋亡过程。有研究表明PP2A能够通过去磷酸化作用调节Bcl-2的蛋白活性和降解[8,12-13]。
本研究结果显示,利用E12.5的小鼠胚胎能够用胰酶消化的方法成功获得胚胎成纤维细胞,通过PCR方法鉴定获取MEFs小鼠的ppp2cb大小。在DNA水平上确认了Cβ基因已经被敲除。同时以cDNA为模板,利用RT-PCR方法鉴定发现Cβ基因在RNA水平上也被敲除掉了。最后利用Western blot技术在蛋白水平上验证了Cβ基因的敲除情况。从图1C中可以看出,纯合子MEFs中PP2A的表达量低于野生型及ppp2cafl/flcb+/+的个体。这是由于Cα和Cβ蛋白仅在N端有3个氨基酸序列的差异,没有特异性的抗体进行识别,而前者表达量是后者的10倍,冗余效应导致蛋白表达量检测不能肯定敲除效率,但整体表达量的下降也表明敲除是有效的。
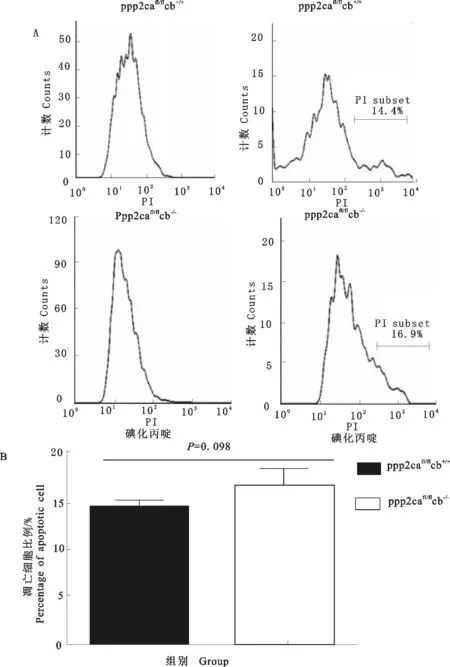
A. 流式细胞分选术检测细胞凋亡的变化;B. MEFs细胞凋亡变化统计表
A. FACs analysis on alteration of MEFs cell apoptosis; B. Statistics on the variation of MEFs cell apoptosis
图2流式细胞术检测MEFs细胞凋亡
Fig.2Apoptosis analysis in MEFs checked by FACs
本研究中PI染色后流式检测结果显示,Cβ基因敲除MEFs中凋亡细胞的比例为16.9%±1.36,高于野生型MEFs中的14.4%±1.48,但差异不显著(图2B)。PP2A的缺失可能降低了Bcl-2的活性从而促进凋亡的发生,但本研究中Bcl-2的mRNA表达水平和蛋白表达水平均未观察到显著的差异,可能是其磷酸化程度的改变决定了Bcl-2的活性;同样,在细胞周期检测中,观测到Cβ基因敲除MEFs中处于M1期的细胞比例为53.95%±2.81,处于M2期的细胞比例为21.14%±2.53;而野生型小鼠MEFs中处于M1期的细胞比例为46.94%±4.17,处于M2期的细胞比例为29.83%±3.25。从而可以推测Cβ基因的缺失轻微影响了细胞的周期分布,细胞周期的关键调控因子Cyclin D1的RNA和蛋白水平均未呈现出显著差异,其总体表达水平并未受到影响,可能是其蛋白翻译后修饰的磷酸化程度的改变。
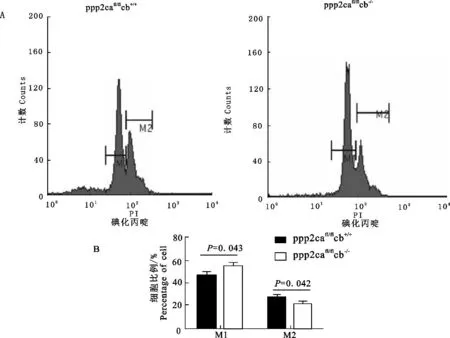
A.流式细胞分选术检测细胞周期的变化;B.MEFs细胞周期变化统计表
A.FACs analysis on alteration of MEFs cell cycle;B.Statistics on the variation of MEFs cell cycle
图3流式细胞术检测MEFs细胞周期分布
Fig.3Cell cycle distribution in MEFs detected by FACs
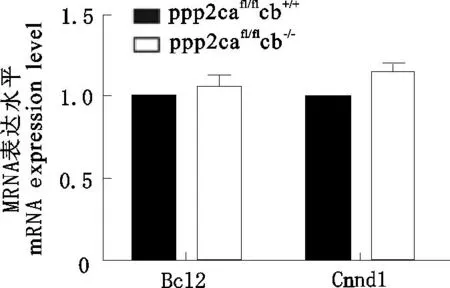
图4 QPCR检测Bcl-2和Cnnd1的表达
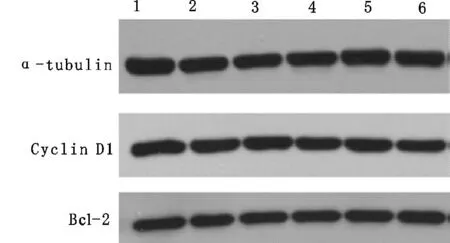
1-3.ppp2cafl/flcb+/+;5-6.ppp2cafl/flcb-/-
综上所述,PP2A的Cβ基因虽然通常被认为并不重要,但本研究的结果显示,Cβ基因的缺失能够轻微影响胚胎成纤维细胞的周期和凋亡过程。对于其具体作用于哪种下游底物以及具体的作用机制尚需要进一步研究。
参考文献:
[1]Czabotar P E,Lessene G,Strasser A,et al.Control of apoptosis by the BCL-2 protein family:implications for physiology and therapy[J].Nat Rev Mol Cell Biol,2014,15(1):49-63.
[2]Tsujimoto Y,Shimizu S.Bcl-2 family:life-or-death switch[J].FEBS Lett,2000,466(1):6-10.
[3]Antonsson B.Bax and other pro-apoptotic Bcl-2 family "killer-proteins" and their victim the mitochondrion[J].Cell Tissue Res,2001,306(3):347-361.
[4]Kvansakul M,Hinds M G.Structural biology of the Bcl-2 family and its mimicry by viral proteins[J].Cell Death Dis,2013,4:e909.
[5]Janssens V,Goris J.Protein phosphatase 2A: a highly regulated family of serine/threonine phosphatases implicated in cell growth and signalling[J].Biochem J,2001,353(Pt3):417-439.
[6]Shi Y G.Serine/threonine phosphatases:Mechanism through structure[J].Cell,2009,139(3):468-484.
[7]Low I C,Loh T,Huang Y,et al.Ser70 phosphorylation of Bcl-2 by selective tyrosine nitration of PP2A-B56delta stabilizes its antiapoptotic activity[J].Blood,2014,124(14):2223-2234.
[8]Janssens V,Longin S,Goris J.PP2A holoenzyme assembly: in cauda venenum (the sting is in the tail)[J].Trends Biochem Sci,2008,33(3):113-121.
[9]Zhang T,Liu W D,Saunee N A,et al.Zinc finger transcription factor INSM1 interrupts cyclin D1 and CDK4 binding and induces cell cycle arrest[J].J Biol Chem,2009,284(9):5574-5581.
[10]Noguchi E. PP2A(Cdc55/B55), a possible therapeutic target in cyclin D1-dependent cancers[J].Cell Cycle,2013,12(10):1484.
[11]Lin S S,Bassik M C,Suh H,et al.PP2A regulates BCL-2 phosphorylation and proteasome-mediated degradation at the endoplasmic reticulum[J].J Biol Chem,2006,281(32):23003-23012.
[12]Antony R,Lukiw W J,Bazan N G.Neuroprotectin D1 induces dephosphorylation of Bcl-xL in a PP2A-dependent manner during oxidative stress and promotes retinal pigment epithelial cell survival[J].J Biol Chem,2010,285(24):18301-18308.
Effects of Catalytic Subunit β of Protein Phosphatase 2A on Apoptosis of Embryonic Fibroblasts
WANG Qing-hua1,WANG Sheng-cun1,LI Bin2,LIU Chun1,WU Liu-cheng1,WANG Xu1,PENG Xiao-qing1, SHAO Yi-xiang1
(1.LaboratoryAnimalCenterofNantongUniversity,Nantong,Jiangsu,226001,China;2.DepartmentofPediatrics,AffiliatedHospitalofNantongUniversity,Nantong,Jiangsu,226001,China)
Abstract:To investigate the effects of catalytic subunit β of protein phosphatase 2A (PP2A) on cell cycle and cell apoptosis in mouse embryo fibroblasts (MEFs), the mouse embryos at E12.5 by mating the heterozygotes of Cβ subunit conventional knockout male and female mice at the ratio of 1∶2 were obtained. MEFs were prepared by trypsin digestion and genotyped by PCR, RT-PCR and Western blot to identify the genetic basis of each embryo. FACs was carried out to determine the cell apoptosis and cell cycle, meanwhile,the anti-apoptosis protein Bcl-2 was checked by Western blot. Genotyping by PCR, RT-PCR and Western blot showed that both knockout and wildtype MEFs were isolated by trypsin digestion at the ratio of 3∶3. The MEFs at M1 stage was 46.94%±4.17 and 53.95%±2.81, respectively and M2 stage was 29.83%±3.25 and 21.14%±2.53. There is no significant difference in cell apoptosis between wildtype and Cβ knockout MEFs and slight significant difference between wildtype and knockout MEFs in cell cycle.
Key words:mouse embryonic fibroblast; cell apoptosis; cell cycle
文章编号:1007-5038(2016)02-0064-06
中图分类号:S852.33
文献标识码:A
作者简介:王庆华(1978-),男,江苏泰州人,硕士研究生,主要从事实验动物学及细胞生物学研究。*通讯作者
基金项目:江苏省高校自然科学研究面上项目(11KJB180010;14KJB180018;15KJB180015)
收稿日期:2015-10-29
