湖南省部分原种猪场主要繁殖障碍性疫病的调查
2016-03-30唐小明王昌建何世成王卫国邱立新鲁杏华
唐小明,王昌建,林 源,何世成,王卫国,邱立新,鲁杏华
(湖南省动物疫病预防控制中心,湖南长沙 410014)
湖南省部分原种猪场主要繁殖障碍性疫病的调查
唐小明,王昌建*,林源,何世成,王卫国,邱立新,鲁杏华
(湖南省动物疫病预防控制中心,湖南长沙 410014)
摘要:为了解湖南省原种猪场主要繁殖障碍性病原感染情况及免疫抗体水平。从2011年开始,对我省部分原种猪场进行采样;每年监测5个原种猪场,连续4年,共采血清样品900份、扁桃体样本888份。样品进行了猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV)、伪狂犬病病毒(PRV)、猪圆环病毒2型(PCV-2)、猪细小病毒(PPV)病原检测。结果显示,CSFV、PRRSV、HP-PRRSV、PRV、PCV-2和PPV在我湖南原种猪场存在不同程度的感染,病原阳性率分别为0.12%、2.78%、0.45%、5.33%、9.02%和13.5%。血清样品进行了CSFV、PRRSV、PRV(gB)、PCV-2抗体检测,合格率分别为84.9%、90.6%、93.3%合100%。各猪场根据自身情况,加大监测力度,适时开展动物疫病净化工作,并采取严格的生物安全措施,从源头控制疫病的发生。
关键词:原种猪场;主要繁殖障碍性疫病;病原;抗体;监测
猪瘟(Classical swine fever,CSF)、猪繁殖呼吸与综合征(Porcine reproductive and respiratory syndrome,PRRS)、高致病性猪繁殖呼吸与综合征(high Porcine reproductive and respiratory syndrome,HP-PRRS)、猪伪狂犬病(Pseudorabies,PR)、猪圆环病毒病(Porcine circovirus diseases,PCVD)及细小病毒病(Porcine parvovirus infection,PPI)是种猪场主要繁殖障碍性疫病,不仅引起种猪繁殖障碍、仔猪呼吸系统疾病,还会引起猪体免疫抑制从而加重其他疫病的继发感染,干扰疫病免疫效果,造成巨大的经济损失,更重要的是这些疫病可通过种猪垂直传播至下一代,造成更大范围的感染[1-4]。不仅对保种、育种、生猪生产安全与供给等环节造成影响,还会给养猪业造成严重的中长期经济影响。种猪对保障我国猪肉生产具有非常重要的
意义,它不仅影响到商品猪的安全生产,而且影响到商品供给和食物链的其他环节。为从根本上降低种猪场自身疫病发生的风险,积极探索从源头控制动物疫病传播的规律,自2011年起对湖南省内部分原种场进行了主要繁殖障碍性疫病的专项调查,并对不同时期采集的样品进行了CSFV、PRRSV、HP-PRRSV、PRV、PCV-2和PPV病原检测及CSFV、PRRSV、PRV(gB)、PCV-2抗体检测。现将有关情况报告如下。
1材料与方法
1.1材料
1.1.1待检样品湖南省共有19个原种猪场,自2011年起我们每年从省内原种场中抽取5个原种猪场进行采样检测,其中保持3个场进行持续采样检测(表1)。每个种猪场无菌采集40份~50份猪血清,并活体采集相对应的扁桃体样本。

表1 2011年-2014年样品采集数量
1.1.2病原学检测试剂 猪瘟病毒通用型实时荧光RT-PCR检测试剂盒(50头份),批号:CSF201408026P;猪圆环病毒2型实时荧光PCR检测试剂盒(50头份),批号:PCV-2 201410211P;猪繁殖与呼吸综合征病毒通用型实时荧光RT-PCR检测试剂盒(50头份)批号:PRRS20141031P;猪繁殖与呼吸综合征病毒(Nsp1594-1680变异株)实时荧光RT-PCR检测试剂盒(50头份),批号:HP-PRRS20141028P;猪细小病毒实时荧光PCR检测试剂盒(50头份),批号:PP20140718P;以上病原学检测试剂盒均购自于北京世纪元亨动物防疫技术有限公司。
1.1.3血清学检测试剂猪瘟病毒抗体ELISA试剂盒,由美国IDEXX公司生产,批号:E331;猪伪狂犬病毒gB抗体ELISA试剂盒,由美国IDEXX公司生产,批号:LK867;猪伪狂犬gE抗体ELISA试剂盒,由美国IDEXX公司生产,批号:BL264;猪繁殖呼吸与综合征病毒抗体ELISA试剂盒,由法国LSI公司生产,批号:5-TTVETPRA-053;猪圆环病毒2型抗体ELISA试剂盒,由西班牙INGENASA公司生产。
1.2方法
1.2.1病原学检测利用采集来的扁桃体样本,捣碎提取病毒核酸,均采用实时荧光定量的方法检测组织样本中CSFV、PCV-2、PRRSV、HP-PRRSV、PPV的病毒核酸,体系配置、反应条件及判定标准参照试剂盒说明书进行;用 PRV gE基因缺失疫苗免疫的猪场,检测PRV gE抗体,若PRV gE抗体呈阳性,则判定为PRV野毒感染,即病原学阳性,试验操作严格按照试剂盒说明书进行。
1.2.2血清学检测 所有采集的血清样本,利用ELISA方法检测血清中CSFV、PRRVS、PRV、PCV抗体,操作规程及判定标准参照各试剂盒说明书进行。由于猪繁殖呼吸与综合征病毒、高致病性猪繁殖呼吸与综合征病毒免疫后产生的是同一个猪繁殖呼吸与综合征病毒免疫抗体,仅检测猪繁殖呼吸与综合征病毒抗体;在本此调查过程中,由于猪细小病毒免疫背景不清楚,未进行猪细小病毒抗体的检测与数据统计分析。
2结果
2.1不同年份病原学总体感染情况
在4年的监测过程中,主要繁殖障碍性疫病病原均存在不同程度的阳性,其中CSFV、PRRSV、HP-PRRSV、PRV、PCV-2、PPV总体阳性率分别为0.12%、2.78%、0.45%、5.33%、9.02%和13.5%。不同年份不同场的病原感染情况存在一定差别(表2和表3)。

表2 不同年份场病原学结果
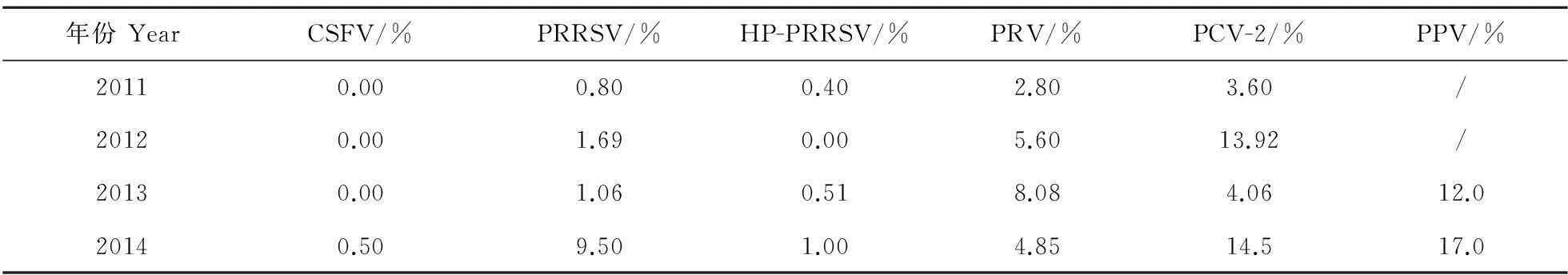
表3 不同年份病原学阳性率结果
2.23个持续监测的原种场病原学检测
对A、B、C 3个原种场,4年均进行采样检测,这3个原种场CSFV连续4年监测结果均为阴性,PRRSV、HP-PRRSV监测的阳性率也较低,PCV-2和PPV的感染率较高;PRV监测过程中发现,其中A在2013、2014年,B场在2014年PRVgE抗体阳性率均出现了急剧上升。分析原因,可能与疫苗类型有关。C场PRV连续4年gE抗体结果均为阴性(表4)。
2.3血清学监测
共对900份样品进行了猪瘟、猪繁殖呼吸与综合征、猪伪狂犬病病毒免疫抗体(gB)监测,抗体合格率分别为84.9%、90.6%、93.3%,具有良好的抗体保护水平;700份样品进行了猪圆环病毒抗体(IGg)监测,抗体合格率为100.0%,见表5。
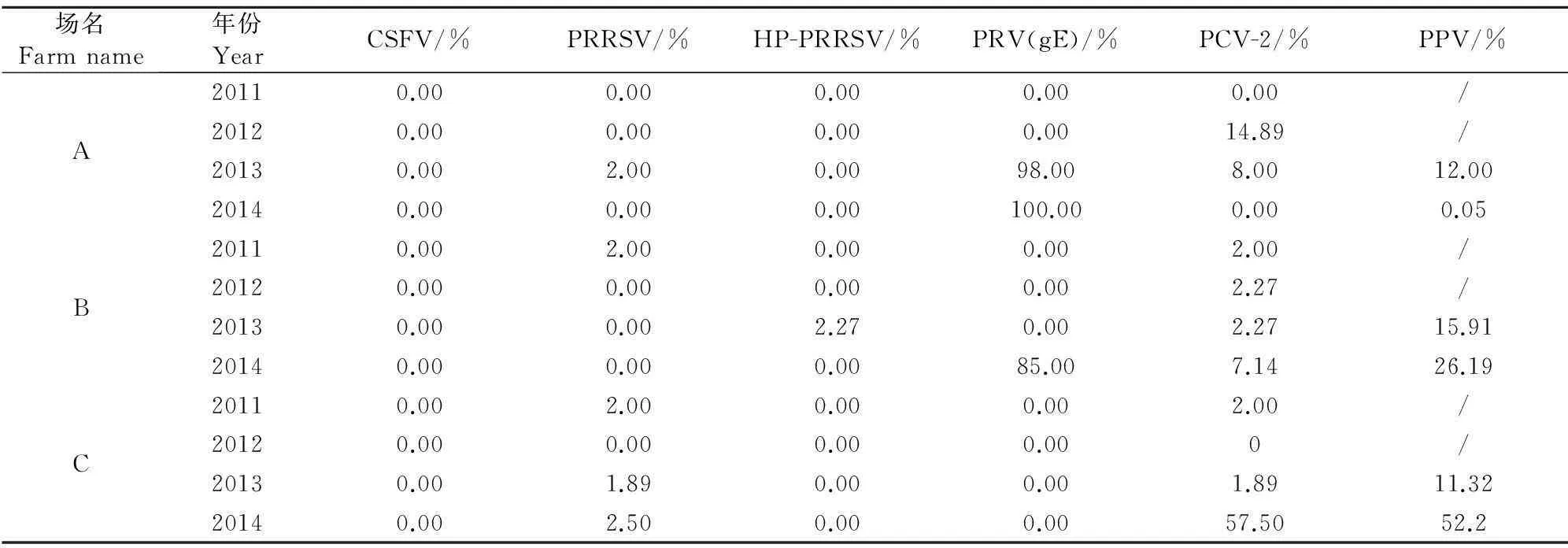
表4 3个原种猪场连续4年的病原监测结果
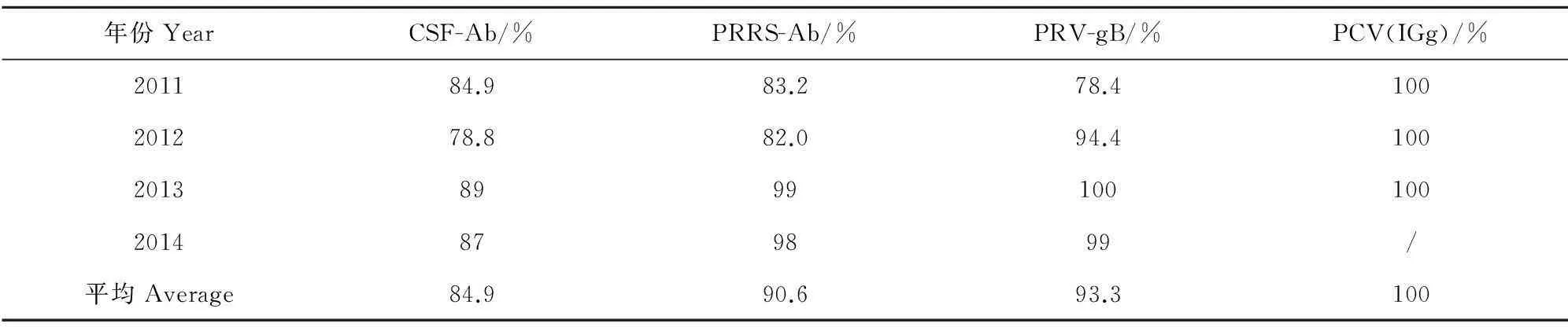
表5 不同年份原种猪场免疫抗体监测结果
3讨论
猪瘟、猪繁殖与呼吸综合征、高致病性猪繁殖与呼吸综合征、猪伪狂犬病、猪圆环病毒病及细小病毒病是危害种猪场主要繁殖障碍性疫病,是危害养猪业发展的重要动物疫病,给养猪业造成严重的经济损失[1,3,5]。有研究表明,母猪持续带毒感染是当前种猪面临的重要问题,带毒母猪将繁殖障碍性疫病病毒经胎盘垂直传播给胚胎,即可引起严重流产和弱死胎,又使带毒母猪卵巢等生殖器官产生器质性病变,导致繁殖障碍[6-8];在新生仔猪方面,经带毒母猪先天感染导致死亡和免疫耐受是目前仔猪死亡主要原因之一[9]。
从本次共调查了湖南省11个原种猪场(其中A、B、C场每年监测只计算为3个场),共采集血清900份、扁桃体样本888份。监测到猪瘟野毒1份,经典蓝耳病病毒54份,高致病性猪繁殖与呼吸综合征病毒13份,伪狂犬gE抗体阳性45份,猪圆环病毒2型80份,猪细小病毒120份,阳性率为别为0.12%、2.78%、0.45%、5.33%、9.02%、13.5%。监测结果显示,这6种主要繁殖障碍性疫病在我省原种猪场种存在不同程度的感染,其中PCV-2及PPV感染较为严重,场阳性率均在70%以上。在高密度的免疫状况下,母猪发病死亡的可能性不大,但可通过种猪垂直传播至下一代,造成更大范围的污染,各猪场应根据生产实际及临床表现,制定相应的病原学监测计划,对于病原学阳性猪进行严格隔离淘汰,优化种猪群,确保种猪群的健康状况,切实提高种猪的生产性能。
主要繁殖障碍性疫病主要的控制措施是合理选择疫苗免疫,进行预防性免疫。本次采集的900份血清样品,进行了猪瘟、猪繁殖与呼吸综合征、伪狂犬,抗体合格率分别为84.9%、90.6%、93.3%,700份血清样品进行了圆环病毒抗体检测,抗体合格率为100%。结果显示,湖南省原种猪场主要繁殖障碍性疫病中,猪瘟、猪繁殖与呼吸综合征、伪狂犬、圆环病毒免疫状况良好,抗体保护水平高,抗体合格率均在84%以上,免疫效果确实。但个别猪场在某个时期内某种疫病免疫抗体水平较低,感染疫病的风险较大。各猪场应加强血清抗体监测,根据检测结果,制定合理的免疫程序,并对所使用疫苗进行评估,选择高质量疫苗;对抗体水平较差的某种疫病,采取措施进行补免。本次调查,由于猪细小病毒免疫背景不清楚,未对其进行抗体检测和结果的统计分析,但猪细小病毒免疫接种仍值得高度重视。
从连续监测的3个原种场来看,猪瘟病毒抗原均为阴性,且免疫抗体合格率很高。猪繁殖与呼吸综合征病原检测结果显示,3个原种猪场均存在蓝耳病经典毒株阳性,个体阳性率在2%左右,2个猪场连续监测,猪繁殖与呼吸综合征变异株均为阴性,仅1个猪场存在变异株感染;1个猪场连续4年伪狂犬gE抗体均为阴性,2个场2012年以前gE抗体阴性,近年来抗体急剧上升,达到了90%左右,这可能与更换疫苗类型有关。具体原因正在进一步调查中。连续监测过程我们发现,这3个猪场的猪瘟、猪繁殖与呼吸综合征、伪狂犬病病原阳性率均较低,为这3种疫病净化工作提供了良好的条件,猪场方面可依据生产实际情况,制定相应的监测计划和净化方案,并采取严格的生物安全措施,逐步使猪群得到净化。为我省的动物疫病净化工作提供依据和技术支持。
4防控建议
(1)各原种猪场根据自身生产实际,加强疫苗免疫,合理选择优质疫苗,根据监测结果,制定合理的免疫程序,避免各种疫苗免疫之间的相互干扰,确保免疫效果确实。对于病原学阳性率较低病种,慎重使用活疫苗进行免疫。
(2)加大监测力度,提高监测水平,尤其是病原学监测水平。 对于病原学阳性猪只,应严格实行淘汰,并扩大监测面及监测频率,不断发现问题,千方百计提高猪群健康水平[10-11]。
(3)采取高水平的生物安全措施,包括严格的消毒与隔离以及病死动物的无害化处理。抓住机遇,加快推进动物疫病净化工作,为湖南全省乃至全国提供优质种猪。
参考文献:
[1]顾小雪,原霖,遇秀玲,等. 猪场如何实施主要垂直传播性疫病的动态监测[J].猪业科学,2012(10):30-31.
[2]刘喜东.猪瘟的流行现状及防控策略[J].当代畜牧:动物保健,2014,6(中):43-44.
[3]栾培贤,肖建华,赵靓,等.猪瘟国内外流行情况概述[J].东北农业大学学报,2013,44(9):155-160.
[4]张显浩,陈瑞爱,李冰,等.2012年-2013年我国集约化猪场猪伪狂犬病病毒感染情况的调查[J].动物医学进展,2015,36(3):133-136.
[5]Artois M, Depner K R, Guberti V, et al. Classical swine fever (hog cholera) in wild boar in Europe[J]. Rev Sci Tech, 2002, 21(2):287-303.
[6]Segales J, Domingo M. Postweaning multisystemic wasting syndrome(PMWS) in pigs[J ]. Vet Q, 2002,24:109-124.
[7]Hennecken M, Stegeman J A, Elbers A R, et al. Transmission of classical swine fever virus by artificial insemination during the1997-1998 epidemic in The Netherlands: a descriptive epidemiological study[J].Vet Q,2000,22(4):228-233.
[8]胡奕,宋杰,赵宝华.猪繁殖与呼吸综合征防控方法研究进展[J].动物医学进展,2009,30(2):69-73.
[9]宁宜宝, 王琴, 丘惠深, 等. 猪瘟病毒持续感染对母猪繁殖性能及仔猪猪瘟疫苗免疫效力影响[J].畜牧兽医学报, 2004, 35(4):449-453.
[10]彭金美,安同庆,赵鸿远,等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J]. 中国预防兽医学报,2013,35(1):1-4.
[11]孟纪萍,王建梅,武晓虎,等猪圆环病毒2型和猪瘟病毒抗体检测与分析[J] .中国动物检疫,2012,29(2):39-41.

动物医学进展,2016,37(2):120-124ProgressinVeterinaryMedicine
Investigation on Primary Reproductive Disturbance Diseases in Partial Pig Breeding Farms of Hunan Province
TANG Xiao-ming,WANG Chang-jian,LIN Yuan,HE Shi-cheng,WANG Wei-guo,QIU Li-xin,LU Xing-hua
(HunanAnimalDiseaseePreventionandControlCenter,Changsha,Hunan,410014,China)
Abstract:In order to understand the infection of the primary eproductive disturbance diseases and the immune effects in pig breeding farms in Hunan province, since 2011, sampling in part of pig breeding farms in Hunan province. Surveille five pig breeding farms each year for the four year in a row, sampling 900 serum samples and 888 tonsil samples. Detect the antigen of CSFV, PRRSV,HP-PRRSV,PRV,PCV-2,PPV. The result showed that positive rate of antigen were 0.12%,2.78%,0.45%,5.33%,9.02%,13.5%.The positive rate of CSF, PRRS,PR,PC, antibody were 84.9%,90.6%,93.3%,100%.The pig breeding farms should depending on its own situation, Increase the intensity of monitoring,developing animal disease cleanup and adopt strict biosecurity measures control the disease at source.
Key words:breeding pig farm;Primary reproductive disturbance disease;antigen;antibody;surveillance
文章编号:1007-5038(2016)02-0116-04
中图分类号:S858.28
文献标识码:B
作者简介:唐小明(1978-),男,湖南邵阳人,硕士,主要从事动物疫病防控研究。 *通讯作者
收稿日期:2015-05-13
