黄羽肉鸡J亚群禽白血病病毒分离鉴定与全基因组序列分析
2016-03-30李昕键严一铭李广伟戴振凯陈伟国谢青梅
李昕键,严一铭,李广伟,刘 洋,戴振凯,陈伟国,陈 峰,谢青梅
( 华南农业大学动物科学学院,广东广州 510642)
黄羽肉鸡J亚群禽白血病病毒分离鉴定与全基因组序列分析
李昕键,严一铭,李广伟,刘洋,戴振凯,陈伟国,陈峰,谢青梅*
( 华南农业大学动物科学学院,广东广州 510642)
摘要:为了解J亚群禽白血病在黄羽肉鸡中的流行状况,采用病料研磨液接种DF-1细胞、ELISA p27抗原检测、PCR扩增等方法,从广东某鸡场送检疑似禽白血病的黄羽肉鸡病料中分离鉴定出1株J亚群禽白血病病毒,命名为GDLZ0715。为进一步了解该病毒分子学特性,对其进行全基因组测序,并与其他ALV-J毒株进行比较。结果表明,GDLZ0715分离株整个基因组中gag、pol、env基因和LTR相对保守,与各参考ALV-J毒株序列同源性分别达 93.5%~95.9%、96.8%~97.3%、89.6%~94.6%和90.8%~95.1%;3′UTR变异较大,与各ALV-J参考毒株序列同源性仅为80.5%~93.4%,其中rTM和E元件大量碱基缺失;进一步分析表明3′UTR中rTM区和E元件大量碱基缺失正成为我国肉鸡ALV-J毒株的变异趋势。
关键词:黄羽肉鸡;J亚群禽白血病病毒;分离鉴定;全基因组序列分析
禽白血病(Avian leukosis, AL)是由禽白血病病毒(Avian leukosis virus, ALV)引起的以造血细胞恶性增生为主的肿瘤性和免疫抑制性疾病[1]。根据病毒囊膜干扰性、宿主范围和病毒交叉中和反应,将自然感染鸡的禽白血病病毒分为A、B、C、D、E和J 6个亚群,其中A、B和J亚群为感染危害鸡群的主要外源性病毒;C、D亚群为外源性病毒,但较少发生感染;E亚群为内源性病毒,致病力低或无致病性[2]。由于采取严格净化措施,1987年后国际大型种鸡公司已基本消除鸡群中A、B亚群禽白血病病毒。1988年,Payne L N等[2]首次在商品肉鸡中分离到J亚群禽白血病病毒,目前ALV-J已散布到世界各国,成为危害养禽业的主要病原之一。在我国,自1999年杜岩等[3]首次从商品肉鸡中分离到ALV-J后,ALV-J呈暴发式流行开来;宿主范围从肉鸡扩大到蛋鸡、我国地方品种鸡、肉杂鸡[4-7]等;致肿瘤类型由成髓细胞瘤演变为血管瘤并出现兼性并发现象;发病日龄大大提前[1]。
序列分析是了解病毒分子特征和变异的基础[5]。目前,黄羽肉鸡ALV-J全基因序列报道较少,为丰富我国黄羽肉鸡ALV-J毒株全基因序列资源库,进一步分析ALV-J毒株在我国黄羽肉鸡中传播和变异趋势提供有用的数据资料,本研究从广东某鸡场送检疑似禽白血病病料中分离鉴定出1株J亚群禽白血病病毒,命名为GDLZ0715,并对其进行全基因测序分析。
1材料与方法
1.1材料
1.1.1病料与细胞病料(肝脏、脾等组织)采自广东某鸡场送检的疑似禽白血病病鸡(3只);DF-1细胞由华南农业大学家禽研究室保存;用于比较和分析参考的肉鸡源ALV-J毒株HPRS-103(ALV-J英国原型毒株)、ADOL-7501(美国分离株)、NX0101、NM2002-1、YZ9002、JS-nt和GDKP1202序列均下载自GenBank;基因库登录号分别为:Z46390、AY027920、AY897227、HM235669、HM235670、HM235667、JX453210。
1.1.2主要试剂LATaq酶、Dpα、pMD19-T载体为宝生物工程(大连)有限公司产品;DNA Gel Extraction Kit 为Omega公司产品;血液/组织/细胞DNA提取试剂盒为北京天根生化科技有限公司产品;Avian Leukosis Virus Antigen Test kit(ALV Ag)为北京爱德士元亨生物科技有限公司产品。
1.2方法
1.2.1病毒分离向无菌采集的病料(肝脏、脾等组织)中加入无菌PBS和双抗,在研钵中充分研磨,反复冻融3次后,离心取上清液,0.22 μm滤器过滤除菌后,置-80 ℃保存备用。待DF-1细胞长成70%~80%单层时,吸弃生长液,将上述制备病料研磨液接种于DF-1细胞,同时接种PBS做阴性对照,37 ℃孵育2 h后,吸弃病料研磨液,加入含10 mL/L胎牛血清的DMEM培养液,37 ℃体积分数为5% CO2培养箱中培养7d,盲传3代,将细胞反复冻融3次,离心,分别收集DF-1细胞上清和细胞沉淀用于ELISA群特异性抗原(p27)检测和前病毒基因组DNA抽提。
1.2.2ELISA检测取1.2.1收获的DF-1细胞上清,用avian leukosis virus antigen test kit进行p27抗原检测,鉴定是否为外源性ALV感染,按试剂盒说明书进行操作。
1.2.3前病毒基因组DNA提取取1.2.1收获的细胞沉淀,用天根血液/组织/细胞DNA提取试剂盒提取前病毒基因组DNA,按试剂盒说明书进行操作。
1.2.4 ALV-J特异性PCR检测以1.2.3抽取前病毒基因组DNA为模板,用参考文献[8]中ALV-J特异性PCR检测引物p/H7及A-E亚群特异性PCR检测引物p/AD1(表1)(引物送上海生工生物工程技术服务有限公司合成),使用浓度为10 μmol/μL。进行PCR检测, 反应体系为50 μL,反应程序为: 94 ℃ 5 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,32个循环;72 ℃ 10 min。10 g/L琼脂糖凝胶电泳检测扩增产物。
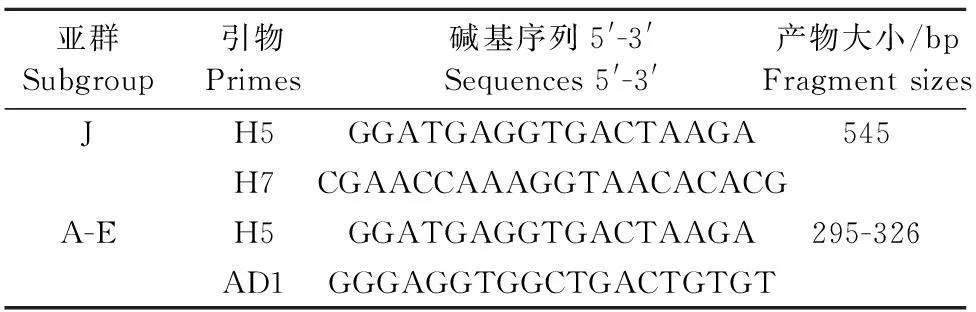
表1 不同禽白血病亚群特异性检测引物
1.2.5前病毒全基因组克隆用参考文献[9]中报道的3对全基因引物(表2)(由上海生工生物工程技术服务有限公司合成)。对GDLZ0715株全基因组核苷酸序列分3个片段进行扩增,各段PCR扩增产物经10 g/L琼脂糖凝胶电泳、回收纯化后,连接至pMD-19T载体中,连接产物转化感受态Dpα,涂菌于LA固体培养板,37℃培养箱过夜,挑取单个菌落37 ℃ LB液体培养基振摇培养,直接以菌液为模板进行PCR鉴定,PCR鉴定为阳性的菌液送华大科技服务有限公司测序。
1.2.6前病毒全基因组序列分析应用序列分析软件DNAStar对测序结果进行剪辑和拼接。并与国内外已报道的ALV-J毒株进行序列比较分析,使用MEGA5.0软件绘制系统进化树图谱,Soft Berry软件分析U3区。
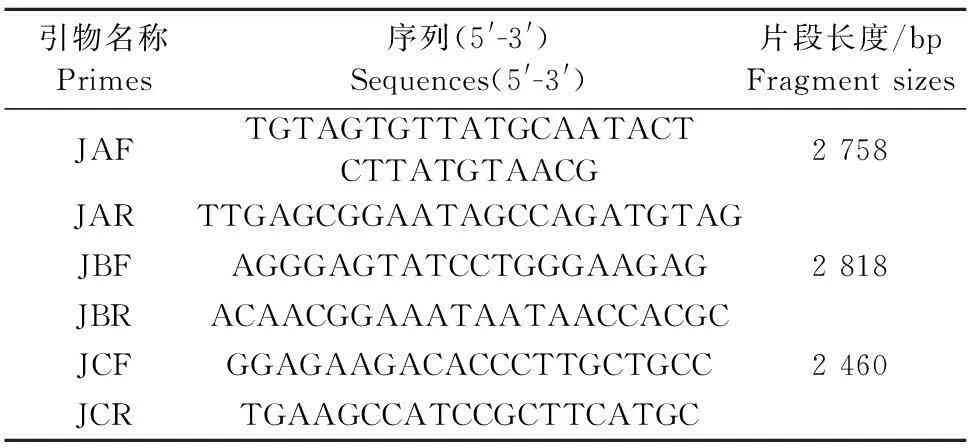
表2 GDLZ0715前病毒全基因组核苷酸序列扩增引物
2结果
2.1病毒分离鉴定
2.1.1ELISA检测结果用Avian leukosis virus antigen Test kit对接种DF-1细胞上清进行p27抗原检测(判断标准:S/P值>0.2为阳性,S/P值≤0.2为阴性)。检测结果为:接种病料研磨液试验组细胞培养上呈阳性(S/P值为2.49);接种PBS阴性对照组细胞上清呈阴性(S/P值为0.011)。结果表明,试验组DF-1细胞中存在外源性ALV增殖,而阴性对照组无外源性ALV增殖。
2.1.2ALV-J特异性PCR检测结果以1.2.3提取前病毒基因组DNA为模板,用ALV-J特异性检测引物p/H7及A-E亚群特异性检测引物p/AD1进行ALV-J特异性PCR检测。结果显示,试验组扩增出约545 bp大小ALV-J特异性条带,但未扩增出A、B亚群任何条带;且阴、阳性对照结果成立(图1)。
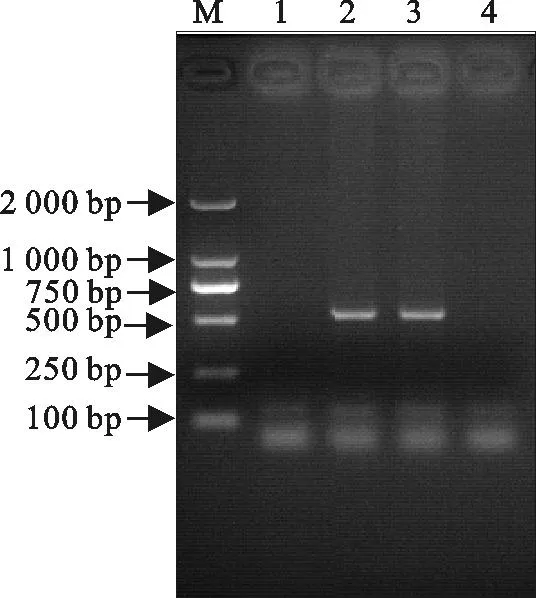
M.DNA标准DL 2 000; 1.阴性对照;2.阳性对照;3.试验组J亚群检测;4.试验组A-E亚群检测
M.DNA Marker DL 2 000;1.Negative control;2.Positive control;3.Detection of subgroup J;4.Detection of subgroup A-E
图1 ALV-J特异性PCR检测
Fig.1PCR detection of ALV-J specificity
2.2GDLZ0715前病毒全基因组序列分析
利用 DNA Star软件的Seq Man程序,完成了对ALV-J GDLZ0715分离株前病毒全基因组序列的剪辑和拼接。该序列全长7 503 bp,不含致瘤基因,具有典型反转录病毒基因组结构特点:5′LTR-gag-pol-env-3′LTR。在3个主要的ORF编码基因中,gag基因相当于碱基位604-2 703,长度为2 100 bp,编码700个氨基酸;pol基因相当于2 723-5 350,长度为2 628 bp,编码876个氨基酸;env基因相当于碱基位5 305-6 993,长度为1 689 bp,编码563个氨基酸。该分离株两端相同的长末端重复序列(LTR)包括U3-R-U5全长为325 bp,相当于碱基位1-325和7 179-7 503;5′端非编码区(5′UTR)长度为379 bp;3′端非编码区(3′UTR)长度为410 bp,与原型毒株HPRS-103差异较大。
2.3GDLZ0715分离株与其他ALV-J株全基因组序列同源性比较分析
利用DNA Star软件将GDLZ0715分离株全基因组序列与 1.1.1中所述ALV-J参考毒株序列进行同源性分析。结果表明,GDLZ0715分离株整个基因组中gag、pol、env基因和LTR相对保守,与各参考序列同源性分别为93.5%~95.9%、96.8%~97.3%、89.6%~94.6%和90.8%~95.1%;3′UTR变异较大,与各参考序列同源性仅为80.5%~93.4%(表3)。gp85基因遗传进化树结果表明,GDLZ0715与原型HPRS-103亲缘关系最近,而与美国分离株ADOL-7501亲缘关系最远(图2)。
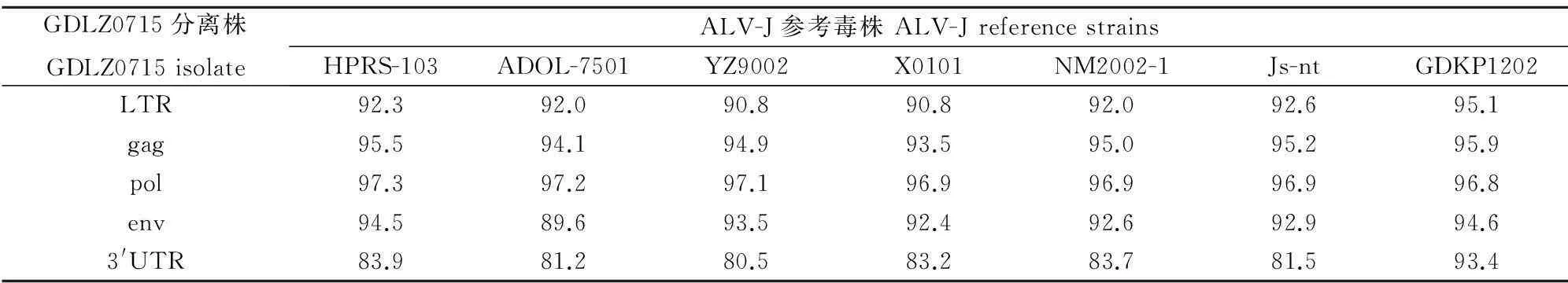
表3 GDLZ0715分离株与国内外ALV-J参考毒株核苷酸同源性比较
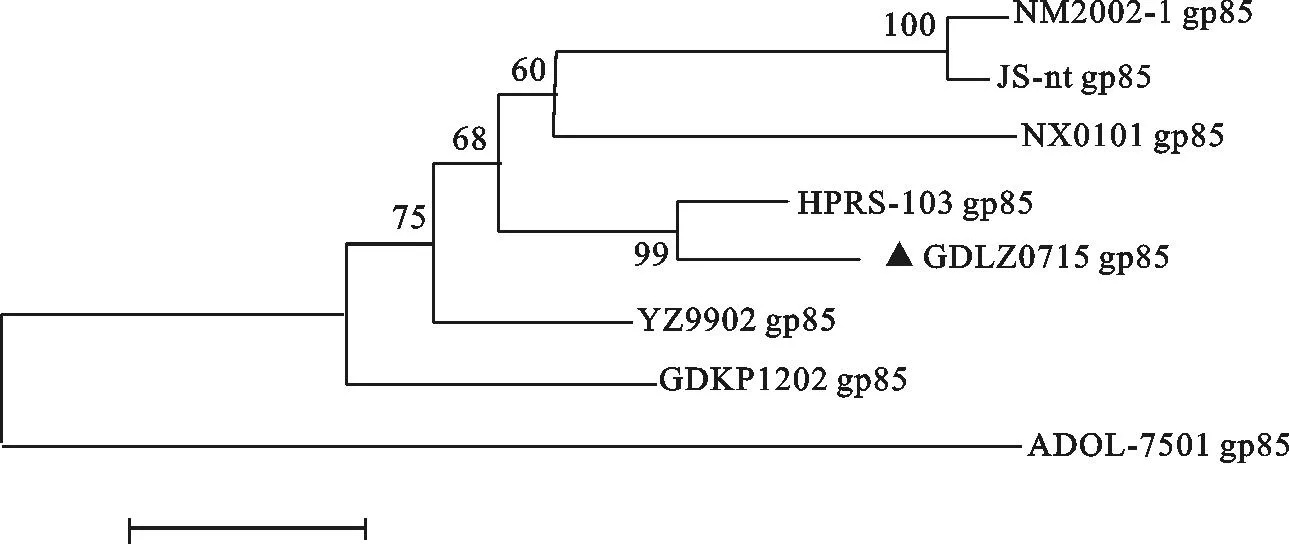
图2 GDLZ0715 ALV-J gp85基因核苷酸遗传进化树
2.4GDLZ0715分离株与其他ALV-J株3′UTR的比较
3′UTR包括env基因下游的rTM(redundant TM)、单拷贝正向重复单位(direct repeat,DR-1)和E元件(exogenous virus specific region,XSR)。GDLZ0715分离株和其他ALV-J分离株同源性仅为80.5%~93.4%;与ALV-J原型毒株HPRS-103相比,3′UTR 差异较大;其中DR-1区相对保守,而rTM区和E元件(XSR)出现大部分缺失。
2.5GDLZ0715分离株与其他ALV-J株LTR的比较
长末端重复序列LTR有2个拷贝(5′LTR和3′LTR),分别位于前病毒基因组两端,由U3、R、U5组成,其中U5和R区在各亚群间高度保守,U3区含有较多转录调控元件,在病毒复制和转录过程中起重要调控作用,也较易发生变异。GDLZ0715分离株LTR与其他ALV-J株同源性达90.8%以上,相对保守。通过Soft Berry 网站NISTE在线分析软件系统分析,结果表明,GDLZ0715分离株U3区包含的转录调控元件C/EBP、E2BP、NFAP-1、CArG Box、Y Box、TATA Box,与ALV-J原型毒株HPRS-103相比,均呈现高保守性(图3),说明这些转录调控元件对ALV-J病毒复制十分重要。GDLZ0715分离株U3区含有2个CArG box和Y box,符合典型复制能力较强外源性ALV特点。

图3 不同ALV-J分离株U3区转录调控元件
3讨论
1988年ALV-J首次在商品肉鸡中被发现,随后在全世界各地区暴发流行,对世界肉鸡产业造成毁灭性打击,尤其是1997年-1998年,因此又被称为“J亚群白血病灾难年”[1]。随着时间推移,ALV-J致病性和宿主范围不断增强扩大,可能是由于RNA病毒本身具有遗传不稳定性和多样性的特点,在净化选择压下,促进病毒进一步突变和重组。
对ALV-J分离毒株GDLZ0715进行全基因序列分析发现GDLZ0715毒株整个基因组gag、pol、env基因和LTR相对保守,仅3′UTR变异较大。反转录病毒发生高错率和高重组率的序列一般位于3′UTR,3′UTR是控制病毒复制和发病机制重要区域,主要影响病毒基因表达[10]。本研究发现,GDLZ0715分离株3′UTR变异较大,与各ALV-J参考毒株序列同源性仅为80.5%~93.4%。GDLZ0715毒株3′UTR 中rTM区缺失达203 bp。笔者对近年来国内分离自肉鸡的ALV-J毒株进一步分析发现,各毒株rTM区随着时间推移均出现不同程度缺失且呈现缺失碱基长度逐渐增大的趋势,1999年的YZ9002分离株未缺失,2002年的NM2002-1分离株缺失26 bp,2003年的JS-nt分离株缺失62 bp,2008年的分离株HAY-013缺失27 bp,2012年的分离株GDKP1202毒株缺失达203 bp,说明rTM区大量碱基缺失不会影响病毒自我复制与传播;DR-1区对病毒复制具体作用尚不清楚,早期研究发现,DR-1具有结构性转运元件,特异性位置缺失会降低ALV-J感染效率[11],而GDLZ0715分离株DR-1区相对保守;E元件(类似于RSV中XSR)是ALV-J和某些肉瘤病毒特有元件,可能影响禽白血病病毒复制和致瘤宿主范围[11],GDLZ0715分离株E元件大量缺失达127 bp,Gao Y等[12]研究发现我国50%肉种鸡和商品肉鸡ALV-J分离株E元件出现大量缺失,一般缺失达125 bp~127 bp仅保留保守的20 bp~22 bp核苷酸序列,说明E元件大量缺失不影响ALV-J病毒复制和致瘤作用,并且相对于完整的E元件序列,这20 bp~22 bp保守核苷酸序列可能对病毒复制更有意义并且是必需的。根据以上分析,笔者推测3′UTR中 rTM和E元件大量碱基缺失正成为我国肉鸡ALV-J毒株变异趋势,本研究ALV-J分离毒株GDLZ0715也符合这一变异趋势,且这些无用碱基缺失更有利于病毒的自我复制和传播能力。gp85基因遗传进化树结果表明,GDLZ0715与ALV-J原型毒株HPRS-103亲缘关系最近,说明GDLZ0715分离株可能来源于白羽肉鸡ALV-J株,而我国长期从国外引进对本地品种进行改良的历史、长期使用进口疫苗、多品种混养养殖环境也为ALV-J从白羽肉鸡到黄羽肉鸡传播提供了可能。
本研究从黄羽肉鸡中分离鉴定出一株J亚群禽白血病病毒,不仅丰富了我国黄羽肉鸡ALV-J毒株全基因序列资源库,也为进一步分析ALV-J毒株在我国黄羽肉鸡中传播和变异趋势提供了有用参考。
参考文献:
[1]Payne L N, Nair V. The long view: 40 years of avian leukosis research[J]. Avian Pathol,2012, 41(1): 11-19.
[2]Payne L N, Brown S R, Bumstead N, et al. A novel subgroup of exogenous avian leukosis virus in chickens[J]. J Gen Virol,1991: 72(Pt 4), 801-807.
[3]杜岩,崔治中,秦爱建,等. 鸡的J亚群白血病病毒的分离及部分序列比较[J]. 病毒学报,2000,16(4):341-346.
[4]Xu B, Dong W, Yu C, et al. Occurrence of avian leukosis virus subgroup J in commercial layer flocks in China[J]. Avian Pathol,2004, 33(1): 13-17.
[5]潘孝成,赵瑞宏,胡晓苗,等. 黄羽鸡J亚群禽白血病病毒的分离及gp85基因分析[J]. 动物医学进展,2014,35(2):51-54.
[6]刘绍琼,王波,张振杰,等. 817肉杂鸡肉瘤组织分离出A、J亚型禽白血病病毒[J]. 畜牧兽医学报,2011,42(3):396-401.
[7]成子强,张利,刘思当,等. 中国麻鸡中发现禽J亚群白血病[J]. 微生物学报, 2005,45(4):584-587.
[8]Smith L M, Brown S R, Howes K, et al. Development and application of polymerase chain reaction (PCR) tests for the detection of subgroup J avian leukosis virus[J]. Virus Res,1998, 54(1): 87-98.
[9]Qu Y, Sun H, Sun M, et al. Sequence analysis for the complete proviral genome of avian leukosis virus subgroup J associated with haemangiomas, leiomyosarcomas and myelomas in layer flocks[J]. Acta Vet Hung,2012, 60(3): 343-354.
[10]Han C, Hao R, Liu L, et al. Molecular characterization of 3′UTRs of J subgroup avian leukosis virus in passerine birds in China[J]. Arch Virol, 2015, 160(3): 845-849.
[11]Chesters P M, Smith L P, Nair V. E (XSR) element contributes to the oncogenicity of Avian leukosis virus (subgroup J)[J]. J Gen Virol,2006,87(Pt 9):2685-2692.
[12]Gao Y, Yun B, Qin L, et al. Molecular epidemiology of avian leukosis virus subgroup J in layer flocks in China[J]. J Clin Microbiol,2012, 50(3): 953-960.
Isolation, Identification and Full-genome Sequence Analysis of Subgroup J Avian Leukosis Virus from Yellow Broilers
LI Xin-jian, YAN Yi-ming, LI Guang-wei, LIU Yang, DAI Zhen-kai,CHEN Wei-guo, CHEN Feng, XIE Qing-mei
(CollegeofAnimalScience,SouthChinaAgriculturalUniversity,Guangzhou,Guangdong, 510642,China)
Abstract:In order to understand the epidemic situation of subgroup J avian leukosis virus in yellow broilers, a strain of the subgroup J avian leukosis virus named GDLZ0715 was isolated and identified from yellow broilers in a farm of Guangdong Province by DF-1 cell culture, ELISA(detection P27 antigen) and PCR. The genome of the virus was sequenced and compared with that of other ALV-J strains. The results showed that the gag, pol, env genes and LTR of the isolate were relatively conservative, the sequence identity was ranged from 93.5%-95.9%,96.8%-97.3%,89.6%-94.6% and 90.8%-95.1% comparing with reference strains, respectively; the 3′UTR identity was only ranged from 80.5%-93.4%; a large number of deletion of the rTM region and E element among 3′UTR of GD0715 isolate was becoming to the tendency of broiler ALV-J isolates which isolated recently in China.
Key words:yellow broiler; Subgroup J avian leukosis virus; isolation; full-genome sequence analysis
文章编号:1007-5038(2016)02-0027-05
中图分类号:S852.659.3;S858.31
文献标识码:A
作者简介:李昕键(1991-),男,湖南常德人,硕士研究生,主要从事动物免疫与生物安全研究。 *通讯作者
基金项目:广东省自然科学基金团队项目(S2013030013313)
收稿日期:2015-08-01
