超高效液相色谱-四极杆串联飞行时间质谱法鉴定育发化妆品中4种植物功效成分
2016-03-24谢文缄熊小婷席绍峰李慧勇谭建华王继才
谢文缄,熊小婷,席绍峰,2,李慧勇,谭建华,2*,王继才,
赵田甜1,郭长虹1
(1.广州质量监督检测研究院 国家化妆品质量监督检验中心(广州),广东 广州 510611;
2.华南农业大学 资源环境学院,广东 广州 510642)
超高效液相色谱-四极杆串联飞行时间质谱法鉴定育发化妆品中4种植物功效成分
谢文缄1,熊小婷1,席绍峰1,2,李慧勇1,谭建华1,2*,王继才1,
赵田甜1,郭长虹1
(1.广州质量监督检测研究院国家化妆品质量监督检验中心(广州),广东广州510611;
2.华南农业大学资源环境学院,广东广州510642)
摘要:建立了固相萃取/超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF-MS)鉴定育发化妆品中4种植物功效成分(槲皮苷、何首乌苷、芦丁和柚皮苷)的分析方法。样品采用甲醇超声提取,上清液经2%/甲酸水溶液稀释后上PAX阴离子固相萃取柱净化。以甲醇和0.002%甲酸水溶液为流动相,梯度洗脱,在CSH C18色谱柱(2.1 mm×50 mm,1.7 μm,Waters)上分离,于UPLC-QTOF-MS负离子模式下进行检测。槲皮苷、何首乌苷和芦丁采用外标法定量测定;5%氨水溶液条件下,柚皮苷因在PAX上的吸附过程中结构转化为柚皮苷查尔酮,只能进行定性鉴定。在优化条件下,槲皮苷、何首乌苷和芦丁在5~200 μg·L-1浓度范围内均呈良好线性,相关系数大于0.999;方法定量下限(LOQ,S/N=10)为0.03~0.1 mg·kg-1;在洗发水基质中的加标回收率为80.9%~104.7%,相对标准偏差(n=6)不大19.6%。该方法准确、适用性强,已成功应用于育发化妆品中槲皮苷、何首乌苷和芦丁的定性定量检测以及柚皮苷的定性鉴定。
关键词:固相萃取(SPE);超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF-MS);育发化妆品;功效成分
随着人们对脱发越来越重视,各类新型育发化妆品产品层出不穷。据查询,目前在我国国家食品药品监督管理局登记育发化妆品特证备案的国产化妆品有几百种,其中大部分产品宣称以中草药植物提取液为主要功效成分。中草药植物的育发机理存在传统中医和西方科学两种研究理念。传统中医研究认为,中草药如红花、川穹等能活血行气,祛风止痛;干姜等辛温通络,有助于药物的透皮吸收;诸药合用,则能改善头部皮肤血液循环,改善毛发营养从而达到育发效果[1];西方科学从细胞生物学角度研究植物提取液的育发机理,研究者[2-3]通过小鼠实验证明了侧柏、首乌等植物提取液具有诱发β-catenin和Sonic hedgehog蛋白,增加毛囊细胞的数量等作用;Park等[4]通过小鼠实验证明了首乌提取液能抑制Ⅱ型5α还原酶产生。然而,由于缺乏相关功效检测方法及鉴定技术,假冒伪劣、虚假宣传等不良现象普遍存在,严重影响了消费者对于中草药植物育发化妆品的信心。因此,为了督促企业加强产品质量控制,提升育发化妆品行业的质量水平,亟需建立相应的检测方法标准对育发化妆品进行植物提取液功效成分的鉴定。
侧柏、何首乌、骨碎补和桑叶是常见的中草药植物,其育发作用已被大量研究所证实[1-10]。本研究依据中华人民共和国药典第一部(2010版)[11],分别选择槲皮苷、何首乌苷、柚皮苷和芦丁作为与侧柏、何首乌、骨碎补和桑叶的药材或提取液相对应的功效成分(见表1)进行定性定量检测方法的研究,并以此鉴定该类植物提取液在育发化妆品中的有效添加情况。目前,关于功效成分槲皮苷、何首乌苷、柚皮苷和芦丁的检测技术报道众多,主要采用高效液相色谱法[12-15]和液相色谱-质谱联用法等[16-20]。考虑到育发化妆品中4种功效成分的含量较低,且其基质复杂,特别是育发洗发液类产品中含有大量的各类表面活性剂等基质,本研究采用固相萃取技术对样品进行有效净化,利用超高效液相色谱-四极杆串联飞行时间质谱(UPLC-Q-TOF)对样品中的4种功效成分进行确证检测,建立了快速、准确鉴定育发化妆品中槲皮苷、何首乌苷、柚皮苷和芦丁的分析方法。
图1 4种植物功效成分的分子结构
1实验部分
1.1仪器、材料与试剂
超高效液相色谱-四极杆串联飞行时间质谱仪(美国Waters公司);高速冷冻离心机(Allegra 64R,Beckman);MS3 basic旋涡混合器(德国IKA公司);BG-02C型超声波发生器(广州邦洁超声设备有限公司);24孔位固相萃取装置(上海安谱有限公司);超纯水系统(Milli-Q,美国Millipore公司);PVDF滤膜(直径25 m,孔径0.2 μm,美国Agilent公司);HLB固相萃取柱(200 mg/6 mL,美国Waters公司);PAX固相萃取柱(500 mg/6 mL,美国Agilent公司)。
甲醇、乙腈(HPLC级,Fisher Scientific公司);甲酸、氨水、磷酸氢二钠(分析纯,上海安谱公司)。
何首乌苷(THS-GLU)、柚皮苷(NG)、芦丁(RT)、槲皮苷(QR)标准品(纯度均大于99.0%,上海诗丹德生物技术有限公司)。
1.2标准溶液的配制
分别称取10.0 mg标准品(精确至0.01 mg)于10 mL容量瓶中,用甲醇溶解并定容,配成1 g/L的单标标准储备液。分别吸收适量标准储备液,用50%甲醇水溶液配成所需浓度的系列混合标准工作溶液,4 ℃避光保存。
1.3样品的制备与提取
准确称取0.5 g 试样(精确至0.001 g)于10 mL具塞比色管中,用甲醇定容至刻度后,于旋涡振荡器上混合使样品分散1 min,超声提取15 min,取样液于离心管中以10 000 r/min离心5 min。上清液用PVDF膜过滤后,准确量取1 mL,加入9 mL 2%甲酸水溶液,混匀,待固相萃取净化。
1.4固相萃取净化
PAX固相萃取柱先用6 mL甲醇、6 mL水活化平衡。将“1.3”制备的样品溶液以不高于1 mL/min的流速通过萃取小柱后,依次用6 mL 5%氨水溶液和10 mL甲醇淋洗,用 2%甲酸甲醇溶液洗脱4次,每次3 mL。洗脱液于40 ℃水浴中氮吹至近干,加1 mL流动相复溶,过滤,待测。
1.5色谱-质谱条件
1.5.1色谱条件色谱柱:CSH C18(2.1 mm×50 mm,1.7 μm,美国Waters公司);柱温:30 ℃;进样体积:5 μL;流速:0.4 mL/min;流动相:A为0.002%甲酸水溶液,B为甲醇;梯度洗脱程序:0~3 min,20%~40%B,3~5 min,40%~20%B。
1.5.2质谱条件离子源:电喷雾离子源(ESI),负离子模式;毛细管电压:2.5 kV;萃取锥孔电压:35 V;脱溶剂气温度:450 ℃;离子源温度:100 ℃;脱溶剂气流速:600 L/h;锥孔气流速:50 L/h;四极杆采集质量数范围:100~1 000 u。数据采集模式:棒状(Centroid);扫描采集时间:0.2 s;TOF运行模式:V模式;以200 pg/μL亮氨酸脑啡肽(m/z=554.261 5)溶液进行实时校准。
2结果与讨论
2.1前处理条件的优化
育发化妆品特别是育发洗发产品中含有大量的表面活性剂(如十二烷基硫酸铵、月桂醇聚醚硫酸酯钠等),这些表面活性剂非常容易电离,能在ESI源上与目标物竞争,从而造成严重的离子抑制。而且,由于表面活性剂的含量很高,易在液相进样系统、色谱管路、色谱柱及离子源上残留,造成质谱的持续污染。因此,此类样品需经过净化才能进入质谱分析。本研究拟采用固相萃取净化的方法对育发化妆品进行处理。
2.1.1固相萃取小柱的选择4种功效成分均具有酚羟基的苯环化学结构,显示出弱酸性和弱反相保留能力(酸度系数pKa和脂水分配系数logP值见表1)。本研究比较了两种不同填料类型的固相萃取小柱(HLB,PAX)的净化效果。实验结果显示,反相保留为主的HLB小柱能同时对4种功效成分、阴离子表面活性剂和油脂进行保留,但无法将各杂质进行分离而去除;PAX柱属于混合型强阴离子交换柱,同时具有强阴离子交换能力和反相保留能力。此4种功效成分的酚羟基在碱性条件下离子化成为较稳定的酚羟基负离子,可与PAX柱上的强阴离子交换树脂进行弱吸附,并可通过甲醇淋洗萃取柱将中性、碱性的具反相保留的杂质(油脂等)去除。同时,样品中常见的阴离子表面活性剂属强阴离子表面活性剂,能在任何条件下与PAX柱发生强吸附。4种功效成分在酸性甲醇条件下被洗脱时,阴离子表面活性剂类杂质因仍在PAX柱上保留而被去除。因此,本研究采用PAX柱对样品提取液进行净化,取得了较好的去除基质效果。
比较了不同规格PAX柱(60 mg/3 mL,150 mg/6 mL和500 mg/6 mL)的净化效果。实验发现,由于离子交换柱的交换容量一般较小(约为0.6~0.9 meq/g),而洗发液中阴离子表面活性剂的含量可能达到5%甚至以上,导致在本方法的稀释倍数下,阴离子表面活性剂在60 mg/3 mL和150 mg/6 mL PAX柱上因吸附过载而被洗脱。因此,本研究采用500 mg/6 mL的PAX柱进行试验。

表1 4种植物功效成分及其化学性质
*based on the calculation with MarvinSketch 5.12.4(ChemAxon Ltd.,https://www.chemaxon.com)
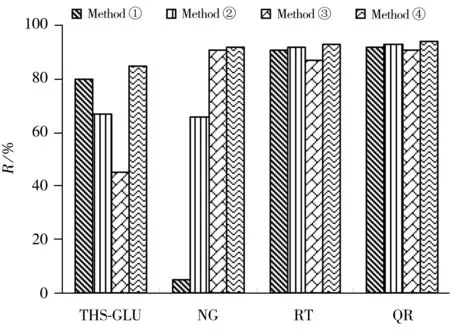
图2 不同上样方式对4种目标物回收率的影响Fig.2 Influence of different sample-loading methods on recoveries of four compoundssample-loading method①:add 20 μL ammonia to 1 mL extraction solution of methanol,vortex and get it loaded; ②:add 1 mL 5%ammonia to 1 mL extraction solution of methanol,vortex and get it loaded;③:add 9 mL 5%ammonia to 1 mL extraction solution of methanol,vortex and get it loaded;④:add 9 mL 2%formic acid to 1 mL extraction solution of methanol,vortex,get it loaded,then add 9 mL 5%ammonia to the column
2.1.2固相萃取上样方式的选择本研究系统比较了样品提取溶液在不同上样方式下,4种功效成分在固相萃取小柱上的保留吸附行为。分别采用以下4种上样方式:①取1 mL甲醇提取液加20 μL氨水,混匀上样;②取1 mL甲醇提取液加1 mL 5%氨水溶液,混匀,上样;③取1 mL甲醇提取液加9 mL 5%氨水溶液,混匀,上样;④取1 mL甲醇提取液加9 mL 2%甲酸水溶液,混匀上样后,萃取小柱上加5 mL 5%氨水锁定。采用4种方式上样后,PAX柱均再用甲醇淋洗,2%甲酸甲醇洗脱。图2的加标实验结果显示,随化学性质的不同,4种功效成分的回收率受上样方式的影响情况不同。芦丁和槲皮苷的pKa均为6.43(见表1),酚羟基酸性较强,在碱性条件下很容易失去1个质子形成稳定的酚羟基负离子,能与PAX填料发生较强的吸附,因此在4种上样方式下均具有较理想的回收率。何首乌苷和柚皮苷的pKa值分别为9.20和9.32,logP值分别为0.83和-0.16,两者的酚羟基酸性较弱。柚皮苷在含甲醇比例较高的上样溶液(上样方式①和②)中无法通过酚羟基负离子与PAX填料发生吸附而保留,在上样过柱液和甲醇淋洗液中部分洗脱。因此,只能在含较低比例甲醇(10%)的上样溶液(上样方式③和④)中先通过反相保留吸附,再通过在氨水条件下离子化而锁定在PAX填料上。何首乌苷的反相保留和离子交换吸附均略强于柚皮苷,在较高甲醇比例的上样溶液(上样方式①)中能大部分锁定在PAX填料上。但随着氨水溶液比例的增加,何首乌苷的回收率下降,在上样方式③中的回收率降至45%,上样过柱液和甲醇淋洗液中也未见何首乌苷被洗脱。尝试增加洗脱溶液中甲酸的比例以及更换反相洗脱能力更强的酸化乙腈、二氯甲烷等溶剂进行洗脱均未成功。这可能是因为在有氨水的水溶液条件下,何首乌苷会与PAX填料发生某种不可逆的吸附,导致少量何首乌苷无法洗脱。这种吸附随着氨水溶液比例的上升而增加。采用上样方式④,由于同样必须采用氨水锁定,何首乌苷虽也有部分损失(回收率约为80%),但基本能够满足鉴定方法要求。因此,本研究采用上样方式④进行实验。
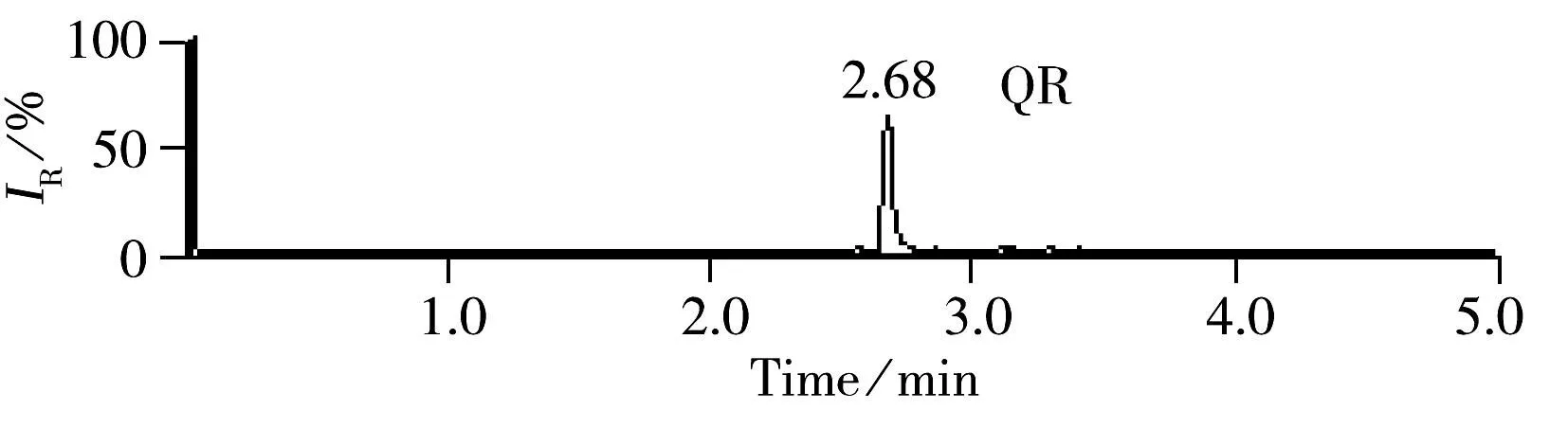
2.1.3柚皮苷在固相萃取小柱上的结构转化实验发现,加标样品过PAX柱净化后,柚皮苷的出峰时间发生偏移(如图3),出峰时间由2.12 min推迟到2.66 min,但其质谱断裂方式基本一致,碎片离子及丰度比未发生较大变化(如图4)。通过串联紫外检测器对柚皮苷的两个色谱峰进行紫外光谱分析,结果发现柚皮苷的紫外最大吸收由283 nm转变为362 nm(如图5)。参照文献研究[21],分析柚皮苷的化学结构,其出峰时间和紫外光谱的变化可能是因为在氨水的作用下,在离子交换柱上的吸附过程中柚皮苷结构转化为柚皮苷查尔酮(如图6)。为了继续查证柚皮苷结构转化现象的原因,本实验直接在柚皮苷标准溶液中加5%氨水溶液,混匀,静置5 min后再进行测定。结果发现,只有少量的柚皮苷存在结构转化现象,而只要通过PAX柱的吸附与解析,绝大部分的柚皮苷将发生结构转化。该现象证实,在弱碱性条件下,柚皮苷在离子交换柱上的吸附能在一定程度上促进其发生结构转化。通过进一步试验比较,柚皮苷构型发生转化后的质谱断裂方式等质谱行为虽然变化较小,但整体的离子丰度比构型转化前有了较大提升,可能是因为柚皮苷查尔酮的分子离子化效率更高。考虑到柚皮苷结构的转化率受各种实验因素影响较大而很难量化,因此本研究只对柚皮苷进行定性鉴定,而不进行定量检测。

图3 4种功效成分过PAX柱前(A)、后(B)的提取离子质谱变化图
2.2色谱-质谱条件的优化
2.2.1流动相的选择4种功效成分在ESI-模式下具有较强的离子响应,因此在ESI-模式下对色谱和质谱参数进行了系统优化。由于4种功效成分的化学结构均具有多个酚羟基,因此,本研究选择甲醇和水为流动相,且在水相中添加少量的甲酸以得到理想的色谱峰形。进一步试验发现,水相流动相中的甲酸会对目标物产生离子抑制。比较了水相中不同浓度的甲酸水溶液(0.002%,0.005%,0.010%,0.020%,0.040%)对目标物的抑制情况。结果发现,随着甲酸浓度的升高,4种功效成分的响应均呈下降趋势。综合考虑流动相的稳定性及方法灵敏度,采用甲醇-0.002%甲酸水溶液为流动相。

图5 柚皮苷在PAX柱上洗脱前(A)、后(B)的紫外吸收光谱变化图

图7 锥孔电压参数的优化Fig.7 Optimization of sample cove voltage
2.2.2质谱参数的选择Q-TOF的质谱参数主要有毛细管电压、锥孔电压、萃取电压、离子源温度和雾化气流量等,其中锥孔电压对于不同目标物的灵敏度影响最大。Q-TOF一般采用全扫模式,因此无法针对每个离子对设置单独的锥孔电压。本研究以各功效成分的准分子离子峰[M-H]-为目标,在优化好其他质谱参数的条件下比较了不同锥孔电压(25,35,45,55 V)条件下各准分子离子峰的响应丰度。结果显示,4种功效成分的灵敏度受锥孔电压变化的影响各不相同(见图7)。综合考虑4种功效成分的灵敏度差异,本研究选用锥孔电压为35 V。
另外,本研究分别以准分子离子峰为母离子,通过优化碰撞电压(Trap CE voltage),利用氩气碰撞产生碎片离子进行二级质谱扫描,得到各化合物一个丰度最高的稳定碎片离子作为定性确证依据。表2列出了各化合物的质谱参数、保留时间、精确分子量以及通过MassLynx软件中Elemental Composition计算分析得到的理论分子量和质量精确度。结果显示,本研究得到的分子质量准确度非常高,能保证定性鉴定的准确性。
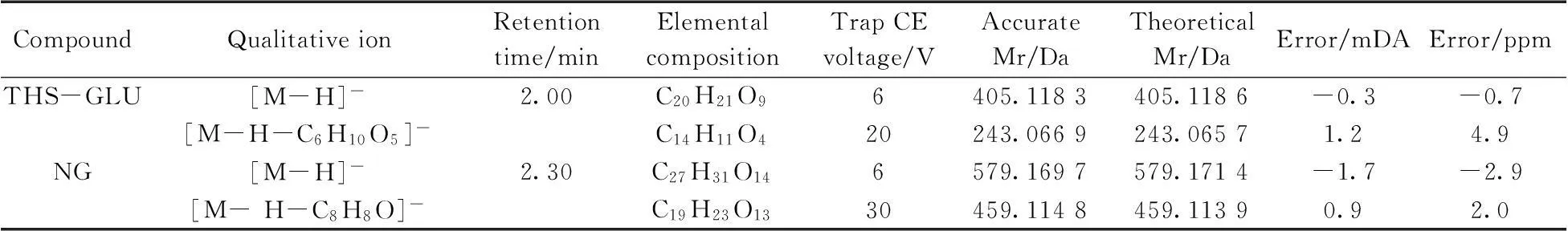
表2 4种功效成分的质谱参数、保留时间、精确分子量、理论分子量和质量精确度
(续表2)

CompoundQualitativeionRetentiontime/minElementalcompositionTrapCEvoltage/VAccurateMr/DaTheoreticalMr/DaError/mDAError/ppmRT[M-H]-2.19C27H29O166609.1437609.1456-1.9-3.1[M-H-C12H21O9]-C15H8O730300.0283300.02701.34.3QR[M-H]-2.35C21H20O116447.0930447.09270.30.7[M-H-C6H12O4]-C15H8O730300.0277300.02700.72.3
2.3线性关系与方法检出限
分别配制质量浓度为5~250 μg·L-1的系列标准溶液,采用本方法对目标化合物进行测定,根据其色谱峰面积积分值(y)和相应质量浓度(x,μg·L-1)的响应关系,得线性回归方程及相关系数(见表3)。结果表明,在5~250 μg·L-1范围内,槲皮苷、何首乌苷和芦丁的线性关系良好,相关系数(r2)均在0.999以上。本文采用基质样品加标,通过计算其标样的响应与背景噪音的比值(S/N=3)确定方法检出限(LOD),以S/N=10确定方法定量下限(LOQ),结果见表3。

表3 目标物的线性方程、线性范围、相关系数、方法检出限(LOD)和定量下限(LOQ)
2.4回收率与精密度
选用阴性洗发乳为加标基质,按本实验条件进行0.1,1.0,2.0 mg/kg 3个加标水平的回收率与精密度实验(表4)。结果显示,THS-GLU,RT和QR在3个加标水平下的平均回收率为80.9%~104.7%,相对标准偏差(RSD)均不大于19.6%,能满足育发化妆品中3种功效成分的鉴定要求。NG在结构转化成柚皮苷查尔酮后,其整体的离子丰度比构型转化前有了较大提升,但转化率不稳定,随着实验条件及浓度不同而变化。在加标0.10 mg·kg-1水平下,平均回收率为121.1%;而在加标1.0 mg·kg-1水平下,平均回收率达到174.7%,回收率偏差太大且不稳定而导致无法进行准确定量。因此,本研究只对柚皮苷进行定性鉴定,而不进行定量检测。
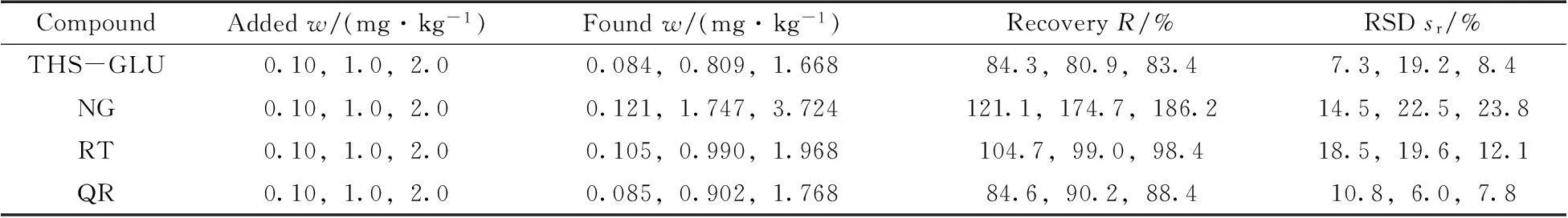
表4 回收率与精密度测定结果(n=6)
2.5实际样品的测定
采用本方法对10份育发化妆品产品进行何首乌苷、柚皮苷、芦丁和槲皮苷成分的鉴定检测。10份样品包括洗发乳、精华液等产品,其中7份产品标称含有何首乌提取物,4份产品标称含有侧柏叶提取物,1份样品标称含有骨碎补提取物,1份样品标称含有桑叶提取物(部分产品同时标称含有多种提取物),实际样品的典型色谱图见图8。实验结果显示,与产品标签宣称进行比较,样品中各功效成分的实际检出率为:何首乌苷,29%;槲皮苷,50%;芦丁和柚皮苷,100%;含量范围为 3结论 本研究采用阴离子交换固相萃取技术结合超高效液相色谱-四极杆串联飞行时间质谱(UPLC-Q-TOF),建立了同时鉴定育发化妆品中槲皮苷、何首乌苷和芦丁3种功效成分的定性定量检测方法以及柚皮苷的定性鉴定方法。通过对固相萃取方法和质谱条件的优化,成功解决了育发洗发液中高含量表面活性剂所造成的基质干扰及污染问题,显著提高了方法的灵敏度和适用性,该方法成功应用于市售中草药育发化妆品的实际检测工作。另外,本研究发现了弱碱性条件下(5%氨水溶液)柚皮苷在离子交换柱上的吸附过程中结构转化为柚皮苷查尔酮的现象,从而为研究该类化合物的结构性质提供了新的理论依据。 参考文献: [1]Liang Y Y,Jiang Q E,Li G.HebeiJ.Tradit.Chin.Med.(梁幼雅,姜倩娥,李耿.河北中医),2012,34(8):1156-1157. [2]Park H J,Zhang N N,Park D K.J.Ethnopharmacol.,2011,135:369-375. [3]Sun Y N,Cui L,Li W,Yan X T,Yang S Y,Kang J I,Kang H K,Kim Y H.Bioorg.Med.Chem.Lett.,2013,23:4801-4805. [4]Park W S,Lee C H,Lee B G,Chang I S.J.Dermatol.Sci.,2003,31:91-98. [5]Shen L,Chen K L.J.South-CentralUniv.Nationalities(沈璐,陈科力.中南民族大学学报),2011,30(1):42-45. [6]Ren F,Wei Y G.J.ZhejiangChin.Med.Univ.(任芳,魏跃钢.浙江中医药大学学报),2012,36(3):350-352. [7]Ma X J,Wang G,Li L Q.YunnanJ.Tradit.Chin.Med.Mater.Med.(马晓佳,王广,李丽琼.云南中医中药杂志),2009,30(6):70-71. [8]Wang J D,Yang E P.YunnanJ.Tradit.Chin.Med.Mater.Med(王剑达,杨恩品.云南中医中药杂志),2009,30(7):69-70. [9]Lin C L,Yin X C,Huang Y Z.ForumTradit.Chin.Med.(林朝亮,殷学超,黄育志.国医论坛),2002,17(6):50-51. [10]Seo S R,Kang G,Ha J W,Kim J C.J.Ind.Eng.Chem.,2013,19:1331-1339. [11]Pharmacopoeia Commission of People's Republic of China.Pharmacopoeia of People's Republic of China(Part 1).Beijing:Chemical Industry Press(国家药典委员会.中华人民共和国药典(一部).北京:化学工业出版社),2010. [12]Sun J L,Huang X L,Wu H Q,Huang F.Chin.Pharm.J.(孙晋苓,黄晓兰,吴惠勤,黄芳.中国药学杂志),2009,44(7):541-544. [13]Zhu P F,Zhao R H,Shi Y X.ChinaJ.Tradit.Chin.Med.Pharm.(朱培芳,赵荣华,施扬宪.中华中医药杂志),2012,27(2):463-465. [14]Zheng Y M,Xu X Y,Fu S Q,Yang Y H.Chin.Pharm.J.(郑一敏,胥秀英,傅善权,杨艳红.中国药学杂志),2005,40(21):1660-1662. [15]Chen J,Gao Y X,Wu W L,Li S Z.Chin.J.Chromatogr.(陈静,高彦祥,吴伟莉,李绍振.色谱),2006,24(2):157-160. [16]Zhou D Y,Xu Q,Xue X Y,Zhang F F,Liang X M.Chin.J.Anal.Chem.(周大勇,徐青,薛兴亚,章飞芳,梁鑫淼.分析化学),2006,34:31-35. [17]Huang Y,Zhang Z R,Zheng L,He F,Shi L Y,Lan Y Y.Chin.J.Pharm.Anal.(黄勇,张治蓉,郑林,何峰,石凌云,兰燕宇.药物分析杂志),2012,32(12):2126-2131. [18]Qiu X H,Zhang J,Huang Z H,Zhu D Y,Xu W.J.Chromatogr.A,2013,1292:121-131. [19]Tong L,Zhou D D,Gao J,Zhu Y H,Sun H,Bi K S.J.Pharm.Biomed.Anal.,2012,58:58-64. [20]Gonzales G B,Raes K,Coelus S,Struijs K,Smagghe G,Van Camp J.J.Chromatogr.A,2014,1323:39-48. [21]Zhao H J,Ren Q X,Fan Y H,Chen W,Jiang F S,Han B.FoodSci.Technol.(赵海娇,任全霞,范玉涵,陈文,江发寿,韩博.食品科技),2011,36(10):201-213. Identification of Four Active Constituents in Hair Growth Cosmetics byUltra Performance Liquid Chromatography Coupled with Quadrupole Time-of-Flight Mass Spectrometry XIE Wen-jian1,XIONG Xiao-ting1,XI Shao-feng1,2,LI Hui-yong1,TAN Jian-hua1,2*,WANG Ji-cai1,ZHAO Tian-tian1,GUO Chang-hong1 (1.Guangzhou Quality Supervision and Testing Institute,National Center for Quality Supervision and Testing of Cosmetics(Guangzhou),Guangzhou510611,China;2.The College of Natural Resources and Environment of South China Agricultural University,Guangzhou510642,China) Abstract:A method for the determination of four active constituents(i.e.2,3,5,4′-tetrahydroxy stilbene-2-Ο-β-D-glucoside(THS-GLU),quercetin-3-rhamnoside(QR),rutin(RT)and naringin(NG))in hair growth cosmetics was developed by strong anion exchange-solid phase extraction(SPE) combined with ultra performance liquid chromatography quadrupole-time-of-flight mass spectrometry(UPLC-QTOF-MS).The sample was ultrasonically extracted with methanol,and purified with SPE(PAX,500 mg/6 mL) cartridge.Chromatographic separation was conducted on a UPLC CSH C18(2.1 mm×50 mm,1.7 μm,Waters) column by gradient elution using methanol and 0.002%formic acid solution as mobile phases.The MS analysis was carried out in electrospray ionization operated in negative mode.THS-GLU,QR and RT were quantified by the external standard method.NG,which arised configuration conversion to naringin chalcone,was just identified by qualitative analysis.Under the optimal conditions,satisfactory linearities(r2>0.999) for three compounds were obtained for all analytes in the concentration range of 5-200 μg/L.Limits of quantitation(S/N=10) were in the range of 0.03-0.1 mg·kg-1.Recoveries at three spiked levels were in the range of 80.9%-104.7%with relative standard deviations(RSD,n=6) not more than 19.6%.This method was accurate and applicable,and was succcessfully applied in the determination of THS-GLU,QR,RT and the identification of NG in hair growth cosmetics. Key words:solid phase extraction(SPE);ultra performance liquid chromatography quadrupole-time-of-flight mass spectrometry(UPLC-QTOF-MS);hair growth cosmetics;active constituents 中图分类号:O657.63;TQ658 文献标识码:A 文章编号:1004-4957(2016)02-0164-08 doi:10.3969/j.issn.1004-4957.2016.02.006 *通讯作者:谭建华,高级工程师,研究方向:色谱、质谱检测技术,Tel:020-83300529,E-mail:tanjianhua0734@aliyun.com 基金项目:广州市质量技术监督局科技项目(2014KJ39);国家质量监督检验检疫总局公益性行业科研专项(2012104013-3) 收稿日期:2015-08-28;修回日期:2015-10-22