HPLC测定维药玫瑰花瓣中金丝桃苷 异槲皮苷和槲皮苷的含量△
2020-12-16吴光翠闫顺华严丽
吴光翠,闫顺华,严丽
新疆维吾尔自治区药品检验研究院,新疆 乌鲁木齐 830054
玫瑰花瓣系维吾尔医习用药材,为蔷薇科植物突厥蔷薇RosedamasceneMill.或玫瑰R.rugusaThunb.的干燥花瓣[1-3],为春、夏季初花期采收,阴干,除去花托、花萼、枯朽花瓣等杂质。玫瑰花含有多种生物活性成分,具有理气解郁、镇静安神、活血散瘀等功效[4-6]。传统中医使用玫瑰花蕾,但维吾尔医则用盛开的花瓣。维吾尔民族药理论阐述玫瑰花为性平,主治胆液质性疾病,如干热性肝炎、神经衰弱、头晕脑胀、心悸失眠、心肌炎、结核引起的消耗性疾病、大便不通等,或黏液质性疾病,如胃纳不佳、消化不良,及各种风湿疼痛、面色苍自等[7-9],因玫瑰花具有较高的药用价值,在维吾尔医学中具有悠久的药用历史,收载于《新疆维吾尔自治区维吾尔药材标准》2010年版(第一册)[7]中,玫瑰花瓣检测项只有性状、检查(杂质),标准较简单。本研究以金丝桃苷、异槲皮苷和槲皮苷3个主要黄酮类成分作为指标成分,建立用高效液相色谱法(HPLC)测定上述3个成分含量的方法,为玫瑰花质量标准的建立提供参考。
1 材料
1.1 药材
10批不同产地玫瑰花瓣样品,经新疆维吾尔自治区食品药品检验所苏来曼·哈力克主任药师鉴定均为蔷薇科植物突厥蔷薇R.damasceneMill.或玫瑰R.rugusaThunb.的干燥花瓣,样品编号、批号和产地见表1。

表1 玫瑰花瓣样品来源
1.2 药品与试剂
对照品金丝桃苷(批号:111521-201204,纯度:93.9%)、槲皮苷(批号:111538-200301,纯度:94.5%)均购自中国食品药品检定研究院,供含量测定用;对照品异槲皮苷(批号:MUST-14070211,纯度:95.2%)购自成都曼思特生物科技有限公司;甲醇为色谱纯(Fisher公司),水为自制超纯水,其他试剂均为分析纯。
1.3 仪器
LC-20AT型高效液相色谱仪、Lab solution色谱工作站(日本Shimadzu公司);1260型高效液相色谱仪(美国Agilent Technologies公司);XS205 DU型电子天平(瑞士Mettle Toledo公司);UPT-Ⅱ-20L型超纯水机(成都优普超纯水科技有限公司)。
2 方法与结果
2.1 色谱条件与系统适用性试验
AgilentEclipse TC-C18色谱柱(250 mm×4.6 mm,5 μm)和Agilent SB-C18色谱柱(150 mm×4.6 mm,5μm)。以乙腈-0.2%磷酸水溶液(15∶85)为流动相,流速1.0 mL·min-1,检测波长360 nm,柱温35 ℃,进样量10 μL。理论板数按槲皮苷计算,不低于4000,分离度均大于1.5。分别取混合对照品溶液和供试品溶液进样,色谱图见图1。色谱图显示样品中各目标峰能够较好的分离。
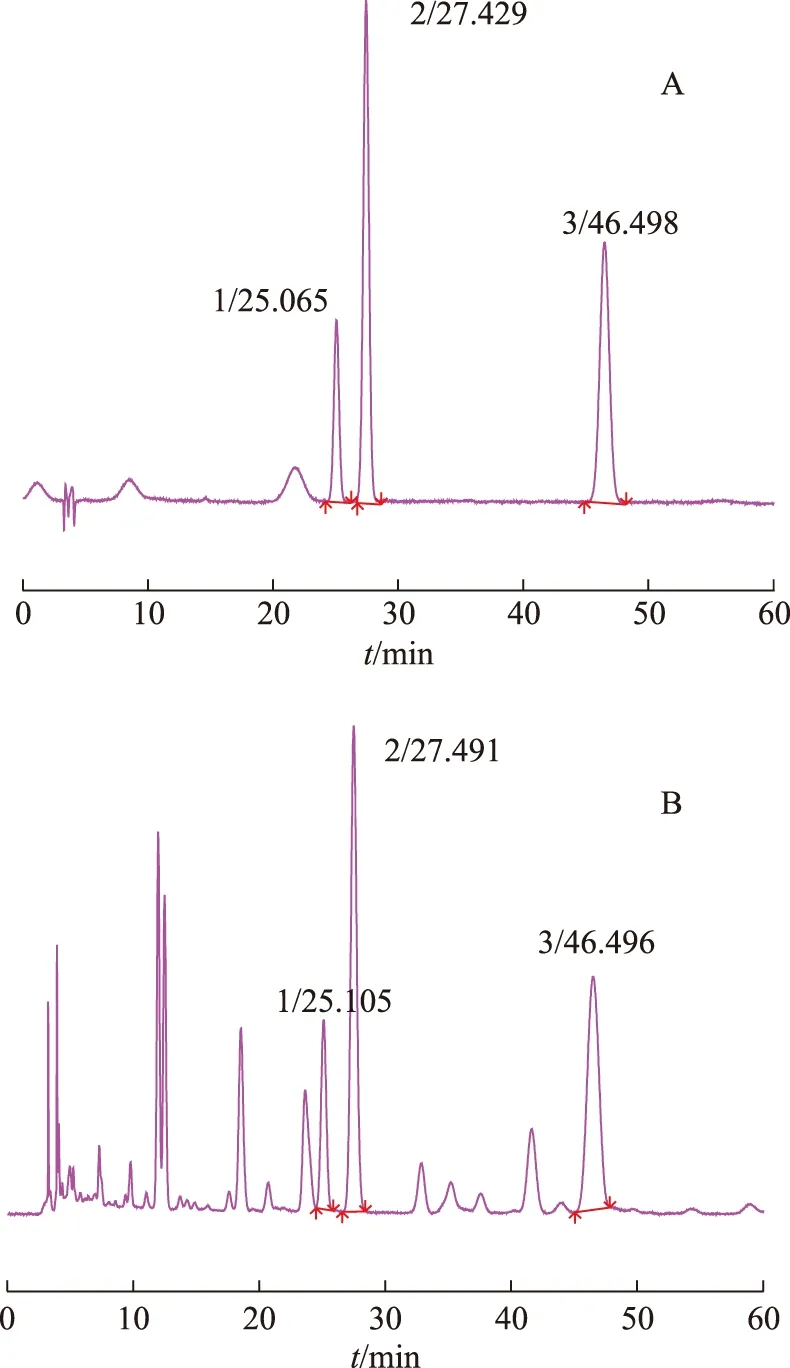
注:A.对照品;B.样品(9号);1.金丝桃苷;2.异槲皮苷;3.槲皮苷。图1 混合对照品和样品(9号)HPLC色谱图
2.2 溶液的配制
2.2.1对照品溶液配制 取金丝桃苷、异槲皮苷及槲皮苷对照品适量,精密称定,置于棕色量瓶中,加甲醇制成含金丝桃苷40 μg·mL-1、异槲皮苷80 μg·mL-1及槲皮苷80 μg·mL-1的混合对照品溶液,即得。
2.2.2供试品溶液配制 精密称取玫瑰花瓣药材粉末(过三号筛)0.5 g,至25 mL棕色量瓶中,加入甲醇适量,超声处理30 min,放至室温,加甲醇至刻度,摇匀,0.45 μm微孔滤膜滤过,即得。
2.3 线性关系考察
精密称取金丝桃苷对照品13.5 mg、异槲皮苷对照品14.5 mg及槲皮苷对照品10.9 mg,分别置50 mL量瓶中,用甲醇溶解并定容至刻度,摇匀,即得金丝桃苷253.5 μg·mL-1、异槲皮苷290.0 μg·mL-1、槲皮苷218.0 μg·mL-1的储备液。
分别精密量取储备液金丝桃苷6.0 mL、异槲皮苷15.0 mL及槲皮苷20.0 mL,分别置50 mL量瓶中,加甲醇至刻度,摇匀,即得金丝桃苷30.4 μg·mL-1、异槲皮苷87.0 μg·mL-1、槲皮苷87.2 μg·mL-1的中间液。
分别精密吸取金丝桃苷、异槲皮苷和槲皮苷对照品的储备液2、6、10、14、18、22、26 μL,分别置于10 mL量瓶中,用甲醇定容至刻度。
分别精密吸取上述3种溶液各10 μL注入液相色谱仪,以对照品质量浓度(C)为横坐标(X),峰面积(A)为纵坐标(Y)进行线性回归,绘制标准曲线,求得各组分回归方程及相关系数(r)。以信噪比(S/N)为3和10时的浓度为检出下限(LOD)和定量下限(LOQ),见表2。结果显示3个成分均有良好的线性关系。

表2 线性关系考察
2.4 精密度试验
精密吸取金丝桃苷、异槲皮苷及槲皮苷对照品的混合溶液(其中金丝桃苷30.42 μg·mL-1,异槲皮苷87.0 μg·mL-1,槲皮苷87.2 μg·mL-1),按照2.1项下色谱条件重复进样6次,每次10L,记录金丝桃苷、异槲皮苷和槲皮苷的峰面积值,测得金丝桃苷、异槲皮苷、槲皮苷峰面积的RSD分别为0.16%、0.14%、0.14%,显示精密度良好。
2.5 稳定性试验
取同一供试品(9号)溶液,室温下放置,按照2.1项下色谱条件每隔4 h进样10L,连续进样6次,记录金丝桃苷、异槲皮苷及槲皮苷的峰面积值,测得金丝桃苷、异槲皮苷、槲皮苷峰面积RSD分别为0.55%、0.47%和0.56%。结果表明,供试品溶液在室温下24 h内稳定。
2.6 重复性试验
取同一样品(9号)约0.5 g,按2.2.2项下方法分别制备供试品溶液6份,按照2.1项下色谱条件进行测定,结果金丝桃苷平均质量分数为0.20%,RSD为1.4%,异槲皮苷平均质量分数为0.56%,RSD为1.3%,槲皮苷平均质量分数为0.70%,RSD为1.0%,黄酮类总平均质量分数为1.45%,RSD为1.0%,测定结果表明重复性良好。
2.7 回收率试验
精密称取已知含量的供试品约0.25 g(9号,金丝桃苷质量分数为0.20%,异槲皮苷质量分数为0.56%,槲皮苷质量分数为0.70%,合并计算3个化合物质量分数为1.45%),共取9份,置于9个25 mL棕色量瓶中,分别加入80%、100%、120%混合对照品的甲醇溶液(金丝桃苷96.34 μg·mL-1;异槲皮苷276.0 μg·mL-1;槲皮苷328.32 μg·mL-1),再加入甲醇适量,超声处理30 min,放置室温,加甲醇至刻度,摇匀,0.45 μm微孔滤膜滤过,即得[10-12]。按照2.1项下色谱条件测定,计算回收率,结果金丝桃苷平均回收率109.4%(n=9),RSD为3.8%,异槲皮苷平均回收率为101.2%(n=9),RSD为2.9%,槲皮苷平均回收率为105.7%(n=9),RSD为3.2%,加样回收率符合要求。
2.8 样品测定
分别精密称取10批不同产地玫瑰花瓣粉末各0.5 g,按2.2.2项下方法分别制备供试品溶液,按照2.1项下色谱条件进行测定,记录HPLC图谱,外标法计算含量,计算时代入水分百分含量,结果见表3。
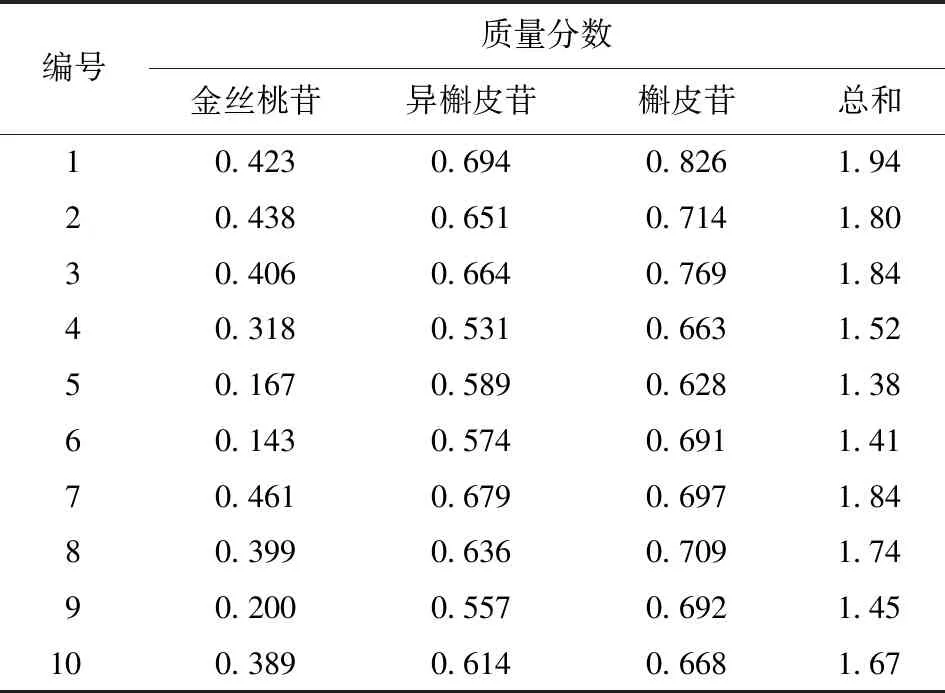
表3 样品测定结果 %
3 讨论
3.1 测定波长的选择
经二极管阵列检测器在线检测,金丝桃苷在206、256、355、486 nm波长处有最大吸收,异槲皮苷在206、256、354、657 nm波长处均有最大吸收,槲皮苷在205、256、349、487 nm波长处均有最大吸收,考虑到能在同一波长下同时测定金丝桃苷、异槲皮苷和槲皮苷3个黄酮类化合物的含量,简化含量测定操作过程,故选择360 nm作为检测波长。
3.2 供试品溶液制备方法的确定
分别对提取溶剂、提取时间进行了考察,以选出最优的供试品溶液制备方法。
取样品(9号)粉末0.5 g,精密称定,置于25 mL棕色量瓶,共4份,分别加入甲醇、80%甲醇水溶液、50%甲醇水溶液及80%乙醇水溶液,分别超声处理30 min,放至室温,加溶剂至刻度,摇匀,0.45 μm微孔滤膜滤过,依法测定金丝桃苷、异槲皮苷和槲皮苷3个黄酮类成分的总含量。测定结果中甲醇提取液的含量最高,为1.45%,故选用甲醇为提取溶剂。另取样品(9号)粉末0.5g,精密称定,置于25 mL棕色量瓶,共4份,加入甲醇适量,分别超声处理10、20、30、40 min,放至室温,加甲醇至刻度,摇匀,0.45 μm 微孔滤膜滤过,依法测定。测定结果超声处理20、30 min,黄酮类组分含量基本稳定,且30 min略高,故超声处理时间定为30 min。
3.3 含量测定结果
测定结果表明,金丝桃苷、异槲皮苷和槲皮苷3个黄酮类成分总质量分数为1.38%~1.94%,平均值为1.66%。10批样品中产地为和田地区的有6批,其总质量分数在1.45%~1.94%,稍高于其他地区;同时10批样品中,金丝桃苷的含量明显小于异槲皮苷和槲皮苷的含量,而异槲皮苷和槲皮苷的含量相当。
本研究建立的HPLC测定玫瑰花瓣中3个黄酮类成分,方法简单易行、重复性好,可为玫瑰花瓣药材的质量控制提供参考[13-15]。
