不同批次SD大鼠血清的代谢组学比较
2016-03-24李震宇秦雪梅
张 松,李震宇,秦雪梅
(1.山西省分析科学研究院 核磁共振检测研究室,山西 太原 030006;2.山西大学
中医药现代研究中心,山西 太原 030006)
不同批次SD大鼠血清的代谢组学比较
张松1,李震宇2*,秦雪梅2*
(1.山西省分析科学研究院核磁共振检测研究室,山西太原030006;2.山西大学
中医药现代研究中心,山西太原030006)
摘要:基于核磁共振氢谱(1H NMR)的代谢组学及多元统计等技术分析不同饲养时期的健康SD大鼠血清,探讨了不同批次的实验动物在机体代谢上的差异性。结果表明不同批次的SD大鼠血清代谢物中,柠檬酸、丙酮酸、琥珀酸、谷氨酰胺、二甲基甘氨酸等成分的含量相对稳定,而丙氨酸、精氨酸、异亮氨酸、乳酸、3-羟基丁酸、胆碱等成分的含量易波动。进一步分析得出,氨基酸代谢、酮体代谢、胆碱代谢等体内代谢途径在不同批次大鼠间存在一定的波动性。该研究为评价健康大鼠之间的批次一致性提供了一种新的思路,也为准确地确定血液生物标志物奠定了基础。
关键词:代谢组学;血清;大鼠;生物样本;1H NMR
生命科学研究中,最常用的实验动物品种有小鼠、大鼠、仓鼠、豚鼠、兔、狗等。由美国Spargue Dawley农场育成的SD大鼠凭借生长发育较快、抗病能力强、繁育性能好等特点而广泛用于安全性试验及营养与生长发育有关的研究[1-2],此外,SD大鼠还是药物药效、毒理研究等最常用的实验动物模型之一。在药物研究中,实验动物的质量及批次之间的稳定、均一性对药物药效、毒理研究结果的重现性有重要影响。目前,SD大鼠的繁殖饲养基地一年四季均可提供实验大鼠,不同批次繁殖的大鼠间是否存在一定差异?生化指标、病理切片等可以灵敏地反映动物在疾病状态下的差异,但对于健康动物则难以评价批次之间的一致性,而代谢组学则可从机体代谢的角度灵敏地检测和反映这一问题。
代谢组学是一门通过考察生物体系受刺激或扰动后其内源性代谢产物的变化来研究生物体系的学科,一般借助高通量、高灵敏度与高精确度的现代分析技术分析细胞、组织以及体液等生物样本中内源性代谢物的整体变化。与基因组学和蛋白组学相比,代谢组学位于系统生物学的最下游,能更准确地反映生物体系的状态,是生物体系整体功能或状态最终结果的表现[3-5]。核磁共振(NMR)、液相色谱-质谱联用(LC-MS)和气相色谱-质谱联用(GC-MS)等分析技术常与数学模型和化学统计数据分析等方法相结合来分析研究复杂生物系统的代谢物。其中,NMR的代谢组学技术因具有重复性好、备样简单、无损伤性的优点而得到广泛应用[6-10]。代谢组学研究中常用的大鼠生物样本有血液、尿液以及肝脏、肾脏等组织提取液,其中由于血液、尿液可以连续多次获取,并且包含丰富的代谢物信息,在代谢组学研究中最为常用[11]。
本实验拟采用核磁共振技术检测同一繁殖基地不同批次的健康SD大鼠血清,利用多元统计分析和单变量分析等手段分析其血液代谢成分,探讨不同批次动物之间在机体代谢上的差异性。
1实验部分
1.1仪器与试剂
Bruker 600-MHz Avance Ⅲ NMR Spectrometer(600.13 MHz质子频率,德国布鲁克公司600兆核磁仪),TGL-16高速台式冷冻离心机(湖南湘仪离心机仪器有限公司),核磁试剂重水(Norell,Landisville,美国),三甲基硅烷丙酸钠盐(TSP,Cambridge Isotope Laboratories Inc.,MA,美国),氘代氢氧化钠(Armar,Switzerland),磷酸二氢钠/磷酸氢二钠(分析纯,天津市光复精细化工研究所)。
1.2血清样本处理
SPF级雄性SD成年大鼠,体重(200±20)g,由北京维通利华实验动物技术有限公司提供,许可证号 SCXK(京)2012-0001,订购时间分别为2014年3月,2014年9月,2014年11月,2015年4月,根据订购时间依次分为A、B、C、D 4组,每组6只。适应性饲养1周后收集SD大鼠的血液,3 000 r/min离心15 min,取上清液,转移至EP管中,-80 ℃冰箱保存,备用。
血清样品在冰水中解冻,精密吸取450 μL置于EP管中,加入350 μL D2O,涡旋30 s,于4 ℃、13 000 r/min离心20 min,取上清液600 μL,转移至5 mm的核磁管中,进行核磁分析。
1.31H NMR测试条件
Bruker 600 MHz AVANCE Ⅲ NMR 谱仪采集数据,脉冲序列Carr-Purcell-Meiboom-Gill(CPMG),扫描次数64,谱宽为12 345.7 Hz,脉冲时间14 μs,采样时间2.654 s,弛豫时间1.0 s,采样数据点65 536,FID分辨率0.188 Hz,采样间隔40.5 μs,内标为TSP。A、B、C、D 4组大鼠血清的采谱时间分别为2014年4月16日、2014年12月28日、2015年1月25日、2015年4月24日。
1.41H NMR图谱处理
采用MestReNova(Version 8.0.1,Mestrelab Research,Santiago de Compostella,Spain)核磁图谱处理软件对所有1H NMR图谱进行傅立叶转换以及相位、基线调整,以肌酸(δ3.04)为标准对谱图进行化学位移的校正。以δ0.01分段积分区间对化学位移区间δ0.70~8.60进行分段积分,其中δ4.66~5.94(残余水峰)不进行积分。
1.5统计学分析
积分归一化后的数据导入SIMCA-P 13.0(Umetrics,瑞典)进行主成分分析(PCA),所选的数据预处理方式为Unit Variance。随后采用GraphPad PRISM 5.01 软件对所有指认的成分进行单变量分析,并将数据导入SPSS 16.0中进行单变量方差分析(One-Way ANOVA)。
2结果与讨论
2.11H NMR图谱的指认与分析
通过化学位移、耦合常数及峰形等核磁数据分析,结合标准品、数据库HMDB(http://www.hmdb.ca/)、BMRB(http://bmrb.wisc.edu/)和文献[12-13]数据对照对所得图谱(图1)进行指认,从血清中共指认了30种化合物,包括氨基酸、有机酸、糖类等。
2.2多元统计分析
主成分分析是一种对多元数据降维的数据处理方法,通过将原来众多具有一定相关性的指标,重新组合成一组新的互相无关的综合指标代替原指标,来考察多个变量间的相关性。如图2所示,对不同批次的SD大鼠血清进行主成分分析,由前两个主成分构建的得分图可以直观地看出,所有样本点均在95%置信区间内,说明本次实验所得数据均无特异点。4个批次的SD大鼠血清代谢物位于图中4个不同位置,可以明显分开,说明不同批次的SD大鼠血清代谢物组成明显不同。PLS-DA分析(Partial Least Squares-Discriminant Analysis,偏最小二乘法判别分析)的模型验证图如图3所示,从模型验证图可看出,绿色和蓝色的回归线与左侧纵轴相交,且左侧的R2、Q2实验值低于右侧的原始值,说明模型是可靠有效的,即模型验证成立,说明4个组的分离具有统计学意义。
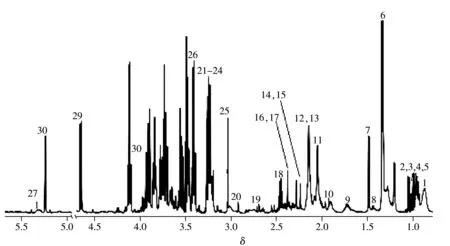
图1 大鼠血清样本的1H NMR图谱
2.3单变量分析

图2 不同批次SD大鼠血清的PCA分析Fig.2 PCA score plots of serum samples from different batches of SD ratsA,B,C and D represent different batches of healthy SD rats,respectively(A、B、C、D分别代表不同批次健康SD大鼠)

图3 不同批次SD大鼠血清的PLS-DA模型验证图Fig.3 PLS-DA model validation of serum samples from different batches of SD rats
为确定4批SD大鼠在血清内源性代谢物上的差异,进一步对SD大鼠血清中指认出的代谢物进行单变量分析,结果如图4所示。由图4可以看出,不同批次的SD大鼠血清中代谢产物的含量有一定差异。A组中的丙酮酸含量较其他组更高,而3-羟基丁酸、琥珀酸、肌酸、乙酰乙酸等有机酸及胆碱、PC、GPC的含量较低。B组中亮氨酸、牛磺酸和GPC的含量较多,丙酮酸及脂类成分的含量较少。C组的氨基酸含量整体较其他组高,如异亮氨酸、丙氨酸、缬氨酸、精氨酸,此外胆碱、PC及脂类的含量也比其他组高;而乙酸、柠檬酸和糖类的含量较低。与其他三组相比,D组中3-羟基丁酸、乙酸、琥珀酸等有机酸类成分的含量较高,而异亮氨酸、缬氨酸、亮氨酸、丙氨酸、赖氨酸等氨基酸含量普遍较低。
对上述差异代谢物进行ANOVA方差分析,可知柠檬酸、丙酮酸、琥珀酸、谷氨酰胺、二甲基甘氨酸等成分的含量相对稳定,而丙氨酸、精氨酸、异亮氨酸、乳酸、3-羟基丁酸、胆碱等成分的含量更容易波动,在不同的组间存在显著性差异。




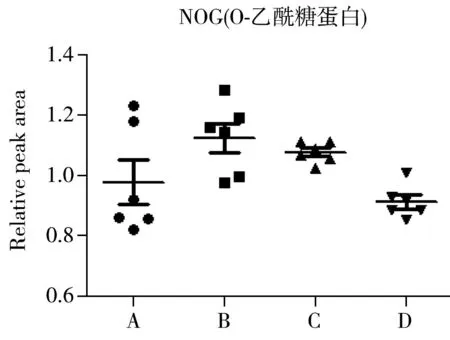

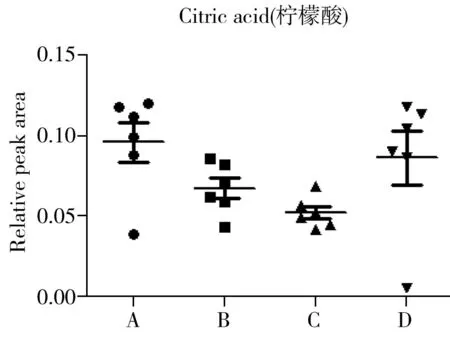
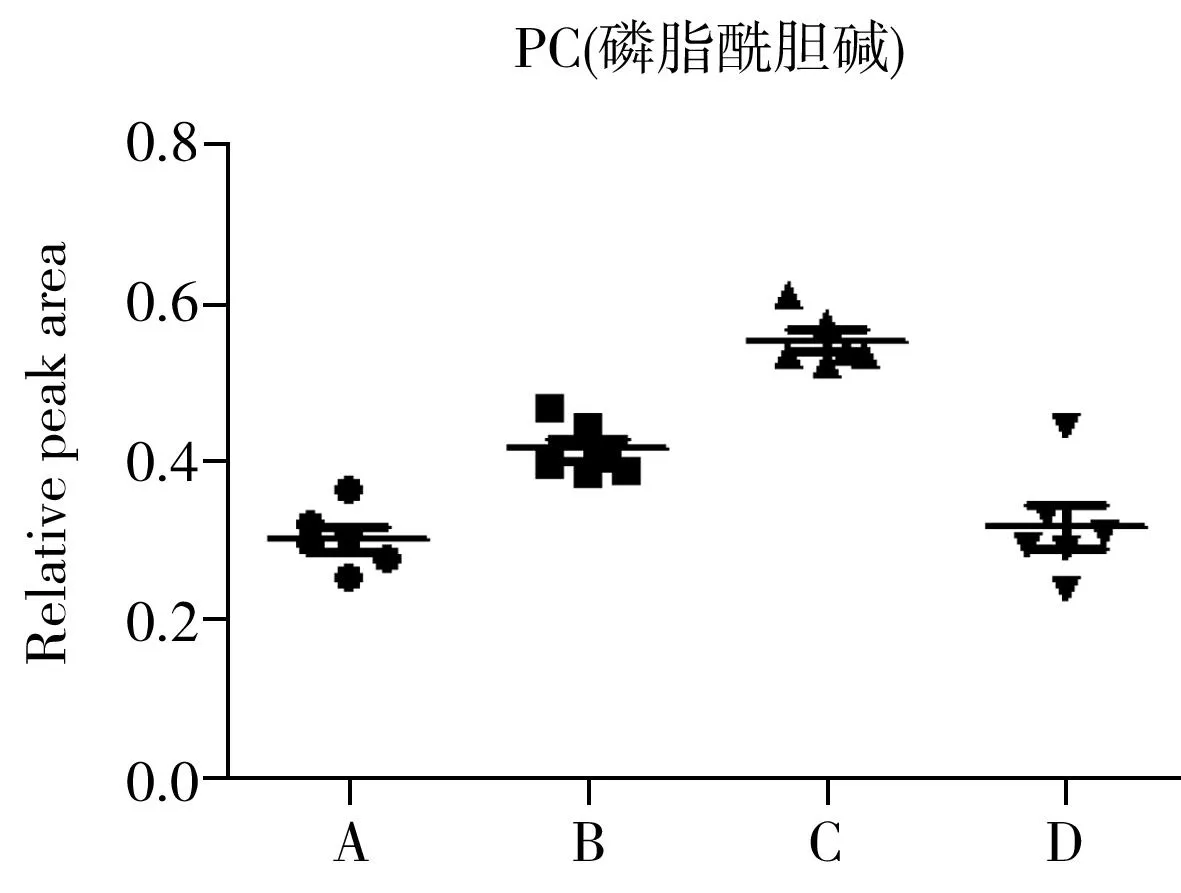

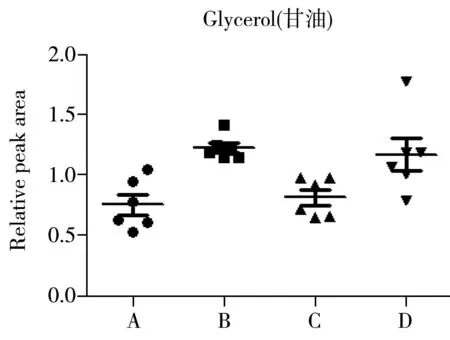
2.4代谢途径分析
丙氨酸、精氨酸、异亮氨酸、乳酸、3-羟基丁酸、胆碱等成分在各组间的含量差异较大。丙氨酸和精氨酸是生糖氨基酸,异亮氨酸是兼容生糖生酮氨基酸,主要参与生酮途径。这些氨基酸在不同组别的SD大鼠血清中有一定的波动,表明不同批次SD大鼠的氨基酸代谢途径有一定的差异性。乳酸是参与糖酵解过程无氧呼吸的主要代谢物,3-羟基丁酸参与机体的酮体代谢,胆碱、磷脂酰胆碱(PC)与体内磷脂的生物合成有关[14],说明不同批次SD大鼠的这些代谢途径容易波动。柠檬酸、琥珀酸、谷氨酰胺、二甲基甘氨酸等成分在各组的含量相对稳定。柠檬酸和琥珀酸是三羧酸循环中重要的中间代谢产物,说明三羧酸循环这一代谢途径相对稳定。二甲基甘氨酸是甘氨酸的衍生物,在线粒体中提供甲基参与叶酸代谢[15],与体内蛋白质合成和机体的应激能力也有一定关系[16],其在不同组别SD大鼠中的含量相近,说明参与的代谢途径相对稳定。
3结论
本研究采用核磁代谢组学技术对不同批次的健康SD大鼠血清进行分析,结果表明不同批次的健康大鼠在机体代谢上存在一定差异,这种差异与丙氨酸、精氨酸、异亮氨酸、乳酸、3-羟基丁酸、胆碱等成分的波动有关,这些波动成分涉及的代谢途径包括氨基酸代谢、酮体代谢、胆碱代谢等。
大鼠是生命科学研究中常用的实验动物,批次之间的一致性对实验结果的重现性至关重要。除饲养时期的不同之外,其他因素如大鼠性别、体重、饲养条件等也是动物实验设计的干扰因素。在外界刺激较大时,如给药或手术导致的疾病模型,批次之间的差异因素可能不会对实验结果有太大的影响,但当刺激或对大鼠的干预比较温和时,如食品的代谢组学作用研究,实验动物批次之间的一致性、机体代谢差异性则会对实验结果产生一定影响。
代谢组学可以灵敏地反映机体生理状态的差异,本研究为评价健康大鼠之间的批次一致性提供了一种新思路。此外,在代谢组学研究中,血液中内源性成分常被作为生物标志物,并用于疾病的早期诊断或药物的药效评价,明确血液内源性代谢物在生理状态的波动性及差异性,也可为准确地确定生物标志物奠定基础。
参考文献:
[1]Wei W.ExperimentalMethodologyofPharmacology.4th ed.Beijing:People’s Medical Publishing House(魏伟.药理实验方法学.4版.北京:人民卫生出版社),2010.
[2]Xu S Y.ExperimentalMethodologyofPharmacology.3rd ed.Beijing:People’s Medical Publishing House(徐淑云.药理实验方法学.3版.北京:人民卫生出版社),2001.
[3]Jia W.MedicalMetabonomics.Shanghai:Shanghai Science and Technology Press(贾伟.医学代谢组学.上海:上海科学技术出版社),2011.
[4]Beckonert O,Coen M,Keun H C,Wang Y,Ebbels T M,Holmes E,Lindon J C,Nicholson J K.NatureProtocols,2010,5(6):1019-1032.
[5]Lindon J C,Holmes E,Bollard M E,Stanley E G,Nicholson J K.Biomarkers,2004,9(1):1-31.
[6]Li Z Y,Zhi H J,Xue S Y,Sun H F,Zhang F S,Jia J P,Xing J,Zhang L Z,Qin X M.J.Ethnopharmacol.,2012,140(1):83-90.
[7]Qin X M,Dai Y T,Liu N Q,Li Z,Liu X,Hu J,Choi Y H,Verpoortr R.PlantaMed.,2012,78(9):926-933.
[8]Li A P,Li Z Y,Sun H F,Li K,Qin X M,Du G H.J.ProteomeRes.,2015,14(5):2005-2016.
[9]Jiménez-Girón A,Ibáez C,Cifuentes A,Simó C,Muoz-González I, Martín-lvarez P J,Bartolomé B,Moreno-Arribas M V.J.ProteomeRes.,2015,14(2):897-905.
[10]Mi X,Li Z Y,Qin X M,Zhang L Z.ActaPharm.Sin.(米霞,李震宇,秦雪梅,张丽增.药学学报),2013,48(11):1692-1697.
[11]Liu X J,Zhou Y Z,Li Z F,Cui J,Li Z Y,Gao X X,Sun H F,Zhang L Z,Du G H,Qin X M.J.Pharm.Pharmacol.,2012,64(4):578-588.
[12]Diao C F,Zhao L C,Guan M M,Zheng Y Q,Chen M J,Yang Y J,Lin L,Chen W J,Gao H C.Mol.Biosyst.,2014,10:686-693.
[13]Shi X,Xiao C,Wang Y,Tang H.J.ProteomeRes.,2012,12(2):991-1006.
[14]Zhang L,Zhang Q,You Y,Zhou M X,Wang L H,Chen H B,Yan X Z,Liu W H.ChineseJournalofIntegratedTraditionalandWesternMedicine( 张蕾,张琪,游云,周明学,王丽华,陈合兵,颜贤忠,刘卫红.中国中西医结合杂志),2015,35(7):823-833.
[15]Kou T,Hu Z P,Dong L,He J T,Bai K W,Wang T.FoodSci.(寇涛,胡志萍,董丽,何进田,白凯文,王恬.食品科学),2015,35(5):179-184.
[16]Cools A,Maes D,Buyse J,Kalmar I D,Vandermeiren J A,Janssens G P.Animal,2010,4(12):2004-2011.
Metabolomic Comparison of Serum Samples in Different Groups of SD Rats
ZHANG Song1,LI Zhen-yu2*,QIN Xue-mei2*
(1.Nuclear Magnetic Resonance Detecting Laboratory,Shanxi Academy of Analytical Sciences,Taiyuan030006,China;2.Modern Research Center for Traditional Chinese Medicine,Shanxi University,Taiyuan030006,China)
Abstract:To explore the differences in body metabolism of experimental animals,the serum samples of four batches of healthy SD rats raised in different periods were compared using proton nuclear magnetic resonance(1H NMR) based metabolomic approach combined with multivariate statistical analysis.The results showed that the contents of several serum metabolites in different groups,including citric acid,pyruvic acid,succinic acid,glutamine,dimethylglycine,changed slightly,while the amounts of alanine,arginine,isoleucine,lactic acid,3-hydroxybutyric acid and choline were fluctuant.Further metabolic pathways analysis showed that amino acid metabolism,ketone body metabolism and choline metabolism were fluctuant in different groups of SD rats.This study provided a new method for the evaluation on the consistency among the different groups of healthy SD rats,and laid a basis for further determination on the biomarkers in serum samples.
Key words:metabolomics;serum;rats;biological samples;1H NMR
中图分类号:O482.532;S852.5
文献标识码:A
文章编号:1004-4957(2016)02-0200-06
doi:10.3969/j.issn.1004-4957.2016.02.011
*通讯作者:李震宇,博士,副教授,研究方向:中药质控与代谢组学,Tel:0351-7011202,E-mail:lizhenyu@sxu.edu.cn
收稿日期:2015-08-31;修回日期:2015-09-20
秦雪梅,博士,教授,研究方向:中药质控、评价与代谢组学,Tel:0351-7018379,E-mail:qinxm@sxu.edu.cn
