高效液相色谱-串联质谱法测定纺织品中16种全氟烷酸类化合物
2016-03-24郑建国张子豪刘莹峰李全忠
郑建国,刘 葳,张子豪,刘莹峰,李全忠,
李 丹1,彭 莹1,张增强2,周明辉1
(1.广东出入境检验检疫局,广东 广州 510623;2.五邑大学 纺织服装学院,广东 江门 529020)
高效液相色谱-串联质谱法测定纺织品中16种全氟烷酸类化合物
郑建国1*,刘葳2,张子豪1*,刘莹峰1,李全忠1,
李丹1,彭莹1,张增强2,周明辉1
(1.广东出入境检验检疫局,广东广州510623;2.五邑大学纺织服装学院,广东江门529020)
摘要:采用高效液相色谱-串联质谱(LC-MS/MS)技术建立了纺织品中16种全氟烷酸类化合物的测定方法。样品以甲醇为溶剂,超声提取,C18(100 mm×2.1 mm,2.7 μm)色谱柱分离,流动相为水和甲醇,梯度洗脱,多反应监测(MRM)模式进行分析检测。16种全氟烷酸类化合物在1~1 000 ng/mL浓度范围内与对应峰面积呈线性关系。方法定量下限(S/N=10)为0.21~1.53 μg/m2。加标回收率为84.8%~107.4%,相对标准偏差(RSD)不大于7.2%。该方法快速简便、准确可靠,适用于纺织品中全氟烷酸类化合物的分析检测。
关键词:纺织品;全氟烷酸;高效液相色谱-串联质谱;测定
全氟烷酸是一类人工合成的化合物,由于具有优良的热稳定性、化学稳定性、高表面活性及疏水疏油性能,大量地应用于化工、纺织、皮革和炊具制造等诸多与生活息息相关的领域[1]。随着对其研究的日益深入,人们逐渐认识到全氟烷酸类化合物具有在生物体内富集的作用,危害人们的健康,因而受到了人们越来越多的关注[2]。ECHA发布的欧盟REACH法规中包含了6种全氟高关注度物质[3]。欧盟规定市场上纺织品中全氟辛烷磺酸的限制含量为1 μg/m2。基于欧盟REACH法规中高关注全氟化合物清单,国际环保纺织协会-Oeko-Tex在2014版的Oeko·Tex Standard 100中新加入了全氟十一酸至全氟十四酸等4种高关注全氟烷酸物质[4]。在国内,部分纺织品存在一种或几种全氟烷酸类化合物,这势必对纺织品的出口造成影响。因此建立一个完善准确的全氟烷酸类化合物的分析方法对应对国外纺织技术贸易措施十分必要。
目前国内外已有许多关于全氟化合物污染[5]和检测技术的报道[6]。对于纺织品中全氟烷酸类化合物的检测主要采用液相色谱-质谱法[7]和气相色谱-质谱法[8],主要检测PFOA和PFOS这两种物质[9-11]。近年来由于对全氟烷酸类化合物毒性认识的加深,对于同时检测多种全氟化合物的研究也越来越多。文献[12-14]采用LC-MS/MS联用技术检测不同食品中的多种全氟化合物,文献[15-16]建立了LC-MS/MS法测定纺织品中多种全氟化合物的分析方法,但对于一系列的全氟化合物,从短碳链C4至长碳链C16的系列直链全氟羧酸和C4至C10的系列直链全氟磺酸化合物的分析检测方法尚未见报道。本文建立了液相色谱-串联质谱技术同时测定16种全氟烷酸类化合物的分析检测方法,检测化合物涉及常见的全氟羧酸(C4-C16)与全氟磺酸(C4-C10)目标化合物,方法的灵敏度高、准确可靠,可用于纺织品中全氟烷酸类化合物的检测分析。
1实验部分
1.1仪器与试剂
Agilent 1200液相色谱(美国安捷伦公司),配有G1312B二元混合泵;Agilent 6410三重四极杆串联质谱仪(美国安捷伦公司),配有电喷雾离子源(ESI)和MassHunter软件数据处理系统;Poroshell 120 EC-C18(100 mm×2.1 mm,2.7 μm)色谱柱;AS20500A 超声波发生器(AUTO Science 公司);Milli-Q超纯水机。
全氟丁酸(PFBA)、全氟戊酸(PFPeA)、全氟己酸(PFHxA)、全氟庚酸(PFHpA)、全氟壬酸(PFNA)、全氟癸酸(PFDA)、全氟十一酸(PFUnA)、全氟十二酸(PFDOA)、全氟十三酸(PFTRIDA)、全氟十四酸(PFTEDA)、全氟十六酸(PFHeDA)和全氟丁烷磺酸(PFBS)均购自挪威Chiron公司;全氟辛酸(PFOA)和全氟辛烷磺酸(PFOS)购自德国Dr.Ehrenstorfer公司;全氟己烷磺酸(PFHxS)和全氟癸烷磺酸(PFDS)购自加拿大Wellington公司。上述标准品纯度均为99.0%。甲醇(HPLC级)购自Tedia公司,氨水(分析纯)购自广州化学试剂厂,实验用水为超纯水。
1.2标准工作溶液
称取全氟烷酸系列标准物质各5 mg,分别用甲醇溶解定容至100 mL,配制成浓度为50 μg/mL的16种全氟烷酸单标储备液。移取50 μL和500 μL以上各储备液,分别用甲醇定容至25 mL,配制成浓度分别为0.1 μg/mL和1 μg/mL的全氟烷酸标准混合中间液。
移取以上全氟烷酸混合标准中间液,以甲醇为溶剂,配制成浓度分别为1,2,5,10,20,50,100,200,500,1 000 ng/mL的标准工作溶液。
1.3样品预处理
取面积为100 cm2的纺织样品,剪碎后放入100 mL带旋盖的螺口玻璃瓶中,加入50 mL甲醇,若不能将样品完全浸没则继续加入甲醇保证溶剂完全浸没样品,70 ℃下超声萃取60 min,将提取液过滤至150 mL圆底烧瓶内,再用10 mL甲醇多次洗涤试样和玻璃瓶壁,并用玻璃棒尽量将试样中吸附的溶剂挤压干,合并洗涤液于圆底烧瓶中。将提取液于50 ℃下旋转蒸发近干,甲醇定容至5 mL,用0.22 μm针式尼龙滤膜过滤,待测定。
1.4液相色谱-串联质谱条件
色谱条件:PoroShell 120 EC-C18(100 mm×2.1 mm,2.7 μm)色谱柱;柱温25 ℃;进样体积2 μL;流动相A:水,B:甲醇,采用梯度洗脱程序:0~2 min,10%B;2~3 min,10%~20%B;3~4 min,20%~45%B;4~5 min,45%~70%B;5~11 min,70%~85%B;11~18 min,85%~100%B;18~19 min,100%~75%B;19~20 min,75%~50%B;20~21 min,50%~20%B;21~24 min,20%~10%B;流速:0~11 min,0.3 mL/min;11~19 min,0.2 mL/min;19~24 min,0.3 mL/min。
质谱条件:电喷雾离子源(ESI),多反应监测(MRM),扫描方式为负离子模式,干燥气温度:350 ℃,氮气流速:7 L/min,雾化器压力:50 psi,毛细管电压:4 000 V,碰撞能量0~60 V(见表1),驻留时间20~50 ms。
2结果与讨论
2.1样品提取方式的选择
将监督抽查得到的含有全氟烷酸的同一阳性化纤材质样品剪碎,分别采用微波提取、快速溶剂提取、超声提取3种方法提取全氟烷酸类化合物,每个方法进行3次平行试验。图1为不同提取方式对样品中7种全氟烷酸类化合物提取浓度的比较。

图1 不同提取方法提取浓度的比较
结果表明,样品中全氟烷酸化合物PFPeA,PFNA,PFTEDA采用超声提取时效率最高,快速溶剂提取效率次之,微波提取效率相对较低;化合物PFBS,PFHpA和PFTRIDA采用快速溶剂提取时效率相对较低,超声提取与微波提取效率相当;化合物PFOS采用超声提取时效率较高,其他两种提取方法效率相当。综合以上结果,超声提取的效率最高,因此实验选择超声提取为纺织样品中全氟烷酸类化合物的萃取方式。
2.2流动相的选择
分别采用甲醇-水、甲醇-5 mmol/L醋酸铵水溶液(pH 4.5)、甲醇-0.1%氨水溶液作为流动相,对浓度均为10 ng/mL的混合标准溶液进行测定。结果表明,目标物质在甲醇-5 mmol/L醋酸铵水溶液体系中的响应最弱,在甲醇-0.1%氨水溶液体系的响应比甲醇-水体系稍强。原因可能是待测物质母离子均为[M-H]-的分子离子,中性或偏碱性流动相提供了待测物质容易脱去质子的环境,增加了母离子的形成。但在甲醇-0.1%氨水溶液体系中,PFBA与PFPeA离子的干扰大,基线较高,化合物PFBA分成3个峰,PFPeA与PFBS出峰时间长,峰形较差。因此实验选择甲醇-水溶液作为流动相。
2.3质谱条件的优化
将16种全氟烷酸标准溶液逐个在ESI负离子模式下以不同传输电压进行一级质谱扫描,结果表明12种全氟羧酸化合物的最强峰为准分子离子峰[M-H]-或分子失去羧基时的分子离子峰[M-45]-,4种全氟磺酸化合物的最强峰为[M-H]-的准分子离子峰和磺酸基团分子离子峰[SO3]-。分别对各准分子离子以0~80 V的碰撞能量进行子离子模式扫描,得到子离子信息和对应的碰撞能量值。全氟羧酸类化合物的子离子为分子失去羧基官能团后分子间相差若干个CF2片段的系列碎片离子,如[C3F7]-,[C4F9]-,[C5F11]-等[CnF2n+1]-离子片段;全氟磺酸类化合物的子离子为失去若干CnF2n+1饱和碳链基团并带有磺酸官能团的[CnF2nSO3]-碎片离子和[SO3]-、[FSO3]-离子。最后选取响应最大、干扰较少的碎片离子作为定量、定性离子。为得到较好的灵敏度,分别对子离子的选择、碎裂电压、碰撞能量等参数进行优化。图2A为PFNA的ESI-MS负模式扫描一级质谱图,在Fragmentor为120 V时,显示很强的PFNA准分子离子峰和失去羧基时的分子离子峰,即[C9F17O2]-和[C8F17]-;图2B为PFNA在碰撞能量为10 V时的子离子扫描质谱图,经准分子离子失去羧基后产生m/z为219,269,419的系列碎片离子峰,分别对应[C4F9]-,[C5F11]-和[C8F17]-。16种全氟烷酸类化合物优化后的参数和多反应监测色谱图见表1和图3。
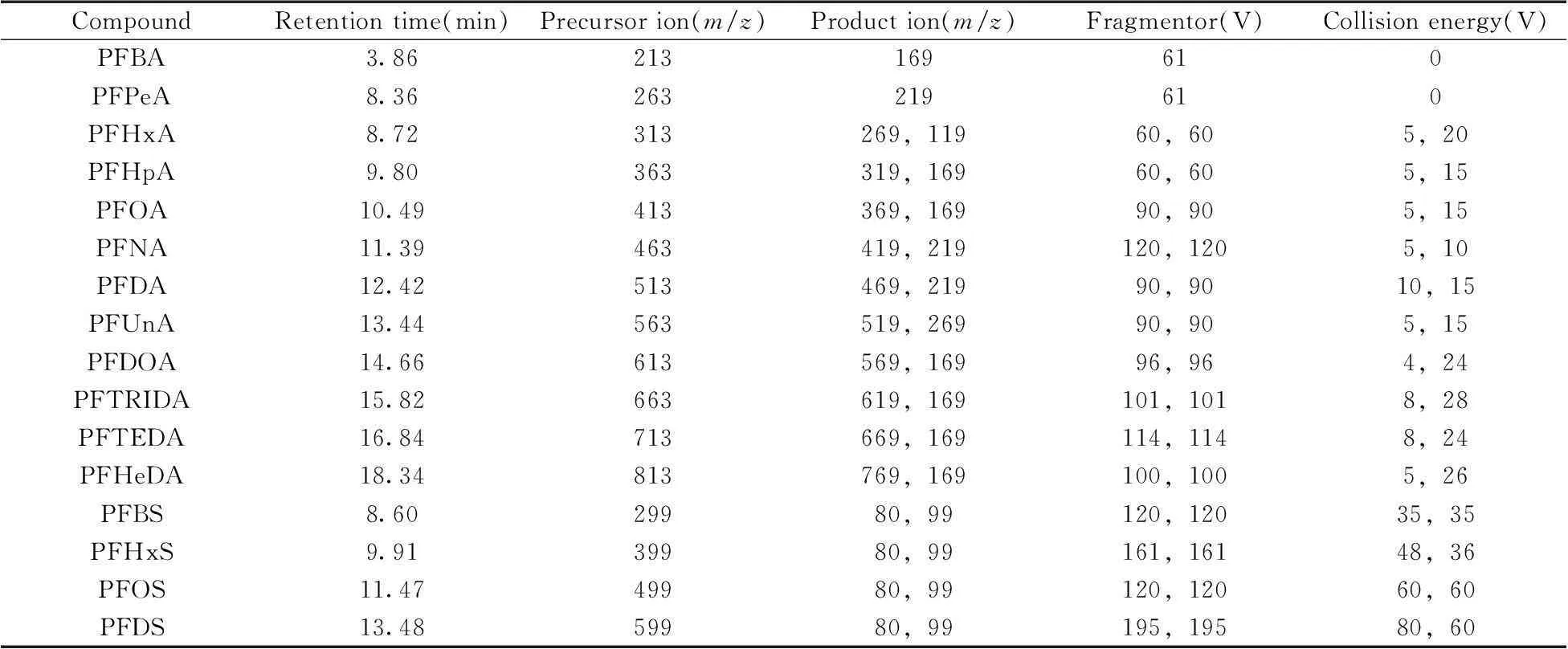
表1 16种全氟烷酸类化合物优化后的定量、定性离子对、碎裂电压及碰撞能量

2.4线性范围与定量下限
在优化条件下,对系列浓度全氟烷酸混合标准工作溶液进行测试,以各物质的浓度(X,ng/mL)为横坐标,对应峰面积(Y)为纵坐标绘制标准曲线,16种全氟烷酸在1~1 000 ng/mL范围内线性关系良好,相关系数(r)为0.995 2~0.999 9。以10倍信噪比(S/N)作为定量下限,得出16种全氟烷酸的方法定量下限为0.21~1.53 μg/m2。16种全氟烷酸化合物的线性方程、相关系数及定量下限见表2。

表2 16种全氟烷酸的线性回归方程、相关系数及定量下限
(续表2)

CompoundRegressionequationCorrelationcoefficient(r)Limitofquantitation(μg/m2)PFHxAY=1678X+1.438×1040.99870.35PFHpAY=1771X+1.264×1040.99780.39PFOAY=3609X+1.671×1040.99970.46PFNAY=1242X+1.370×1040.99840.60PFDAY=2879X+2.257×1040.99520.49PFUnAY=4778X+3.130×1040.99870.63PFDOAY=4798X+2.099×1040.99850.23PFTRIDAY=4855X+1.801×1030.99990.21PFTEDAY=3435X-5.408×1030.99970.39PFHeDAY=2095X+5.001×1030.99920.48PFBSY=479.3X+4.023×1030.99830.45PFHxSY=635.0X+4.287×1030.99920.21PFOSY=1825X+1.276×1040.99820.72PFDSY=1005X+2.642×1030.99520.25
2.5回收率与精密度
将面积为100 cm2的空白棉纺织样品剪碎后置于螺口玻璃瓶中,分别向样品中定量添加1 ng/mL混合标准溶液1 mL和10 mL,10 ng/mL混合标准溶液10 mL,得到最终添加质量为1 ng,10 ng和100 ng的空白基质加标样品。向其中加入50 mL甲醇,并使样品完全浸泡,每个添加水平平行测试6次。结果表明,16种全氟烷酸类化合物在空白基质中的加标回收率为95.3%~103.1%,相对标准偏差(RSD)不大于7.2%(见表3)。
对某含有7种全氟烷酸化合物(PFPeA,PFHxA,PFHpA,PFOA,PFNA,PFDA,PFDOA)的尼龙化纤实际样品进行加标回收实验,分别向样品中定量添加1 ng/mL混合标准溶液1 mL和10 mL,得到最终添加质量为1 ng和10 ng的基质加标样品。每个加标水平平行测试6次。结果表明:样品原来含有的7种全氟烷酸类化合物的加标回收率为84.8%~107.3%,其余9种全氟烷酸化合物的加标回收率为88.0%~107.4%,RSD不大于6.2%(见表3)。
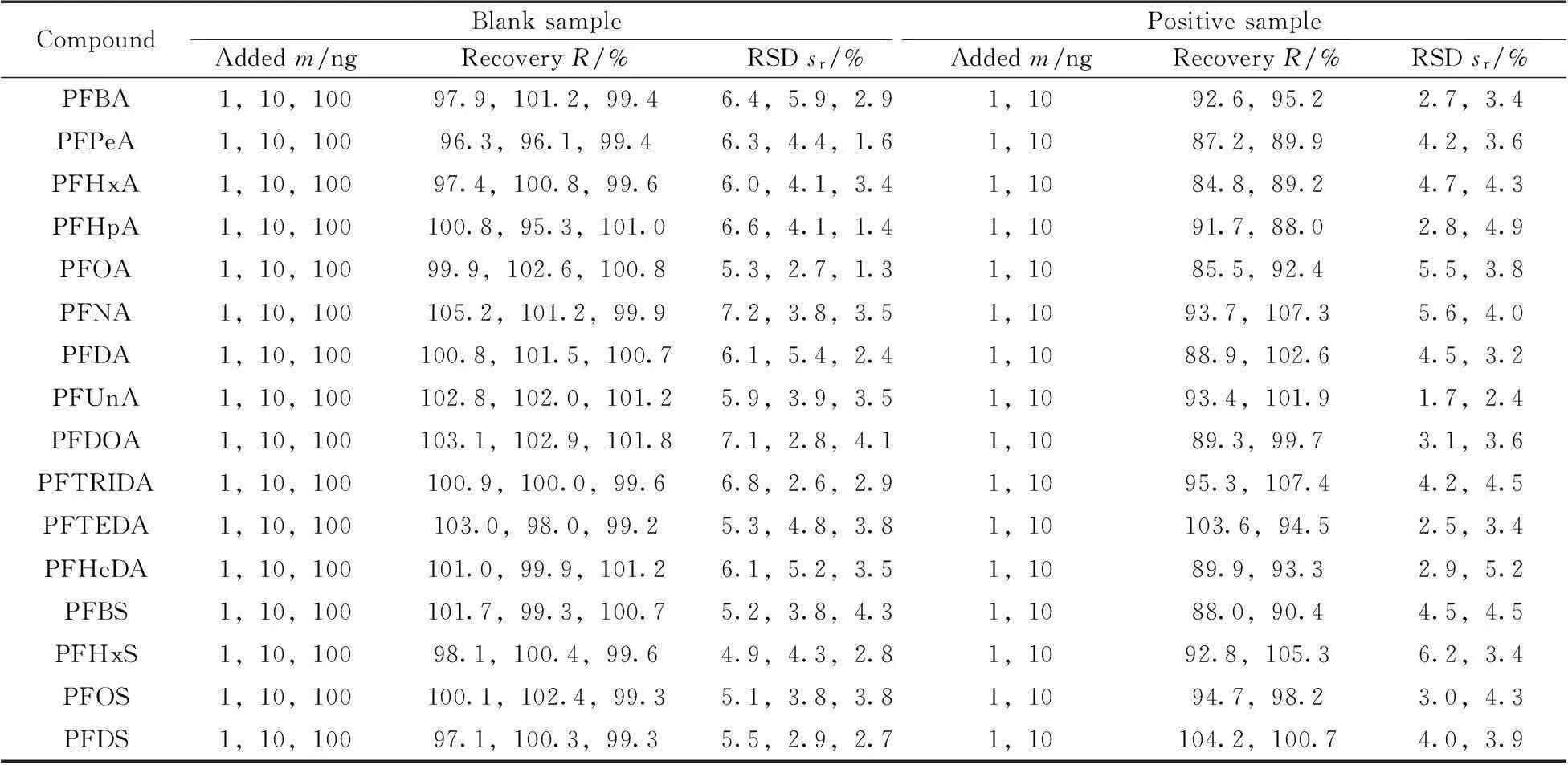
表3 16种全氟烷酸类化合物的回收率与相对标准偏差
2.6实际样品的测试
对6种材质共100个纺织样品进行检测,其中34个样品中检出全氟烷酸类化合物,且以化纤类纺织品的检出率最高(检出率达47%);其次是棉纺织品和混纺纺织品,检出率为19%;毛、麻、丝绸中均未检出。阳性样品中基本都含有多种全氟烷酸,且以C4~C9的全氟烷酸为主。表4为某化纤样品(涂层尼龙)和棉混纺样品(65%涤纶,35%棉)中全氟烷酸的检测结果,图4为其多反应监测色谱图。

表4 两个典型样品中全氟烷酸的含量
*no detected

3结论
本文建立了高效液相色谱-串联质谱法同时测定纺织品中16种全氟烷酸含量的方法。该方法具有操作简便、灵敏度高、精密度及准确性好的特点,适用于纺织品中上述全氟烷酸化合物的快速定量检测。
参考文献:
[1]Jahnke A,Berger U.J.Chromatogr.A,2009,1216(3):410-421.
[2]Peng S Y,Yan L J,Zhang J,Shen H Q.Chin.J.Chromatogr.(彭思远,严丽娟,张洁,申河清.色谱),2012,30(2):123-127.
[3]Lü T M,Liu S M,Wang J P.Dyeing&Finishing(吕铁梅,刘思明,王建平.印染),2010,14:36-41.
[4]Chen R Q.DyestuffsandColoration(陈荣圻.染料与染色),2014,15(4):12-22.
[5]Yu Y C,Xu D M,Luo C,Zhou Y,Peng T,Yue Z F.J.FoodSafetyQuality(余宇成,徐敦明,罗超,周昱,彭涛,岳振峰.食品安全质量检测学报),2014,8:2550-2558.
[6]Luo S P,Shang G Q,Chen M.J.FoodSafetyQuality(罗世鹏,商贵芹,陈明.食品安全质量检测学报),2013,4:995-998.
[7]SN/T 2842-2011.Determination of Perfluorooctane Sulfonoic Acid and Perfluorooctanoic Acid in Textiles-Liquid Chromatography-Tandem Mass Spectrometry Method.Industry Standard of Entry-Exit Inspection and Quarantine of the People's Republic of China(纺织品中全氟辛烷磺酸和全氟辛酸的测定 液相色谱-串联质谱法.中华人民共和国出入境检验检疫行业标准).
[8]Wang J Q,Lin D L,Wang G X,Li R,Lei N.Dyeing&Finishing(王建庆,林丹丽,王改侠,李戎,雷宁.印染),2010,(17):35-39.
[9]Stadalius M,Connplly P,L'Empereur K,Flaherty J M,Isemura T,Kaiser M A,Knaup W,Noguchi M.J.Chromatogr.A,2006,1123(1):10-14.
[10]Huang X L,Wu H Q,Huang F,Lin X S,Zhu Z X.Chin.J.Anal.Chem.(黄晓兰,吴惠勤,黄芳,林晓珊,朱志鑫.分析化学),2007,35(11):1591-1595.
[11]Yu H P,Lu L J,Zhang D H,Mu J,Zhou X,Li A J,Han D C,Rong H.J.TextileRes.(于徊萍,卢利军,张代辉,牟峻,周晓,李爱军,韩大川,荣会.纺织学报),2008,29(5):80-83.
[12]Kong D Y,Wang Y,Wang N,Shan Z J,Tan L C.Environ.Chem.(孔德洋,王懿,王娜,单正军,谭立超.环境科学),2012,31(5):743-747.
[13]Lan F,Feng S,Shen J C,Wu X P,Yue Z F.Chin.J.Anal.Chem.(蓝芳,冯沙,沈金灿,吴晓萍,岳振峰.分析化学),2013,41(12):1893-1898.
[14]Li J,Zhang H,Chai Z F,Shen J C,Yang B.J.Instrum.Anal.(李静,张鸿,柴之芳,沈金灿,杨波.分析测试学报),2014,33(10):1109-1115.
[15]Zhang X L,Liu C H,Xian Y P,Mai X X.J.Instrum.Anal.(张晓利,刘崇华,冼燕萍,麦晓霞.分析测试学报),2010,29(12):1182-1185.
[16]Liu H T,Jiang Q T,Chen X M,Zheng Z Q,Zhu X Y,Ying Y B.J.TextileRes.(刘慧婷,蒋沁婷,陈笑梅,郑自强,朱晓雨,应义斌.纺织学报),2010,31(5):97-101.
Determination of 16 Perfluoroalkyl Acids in Textiles by HPLC-MS/MS
ZHENG Jian-guo1*,LIU Wei2,ZHANG Zi-hao1*,LIU Ying-feng1,LI Quan-zhong1,LI Dan1,PENG Ying1,ZHANG Zeng-qiang2,ZHOU Ming-hui1
(1.Guangdong Entry-Exit Inspection and Quarantine Bureau,Guangzhou510623,China;2.School of Textiles and Clothing,Wuyi University,Jiangmen529020,China)
Abstract:A high performance liquid chromatography-tandem mass spectrometric(HPLC-MS/MS)method was developed for the determination of 16 perfluoroalkyl acids in textiles.Samples were extracted with methanol through ultrasonic method.The target ingredients were separated on a C18column(100 mm×2.1 mm,2.7 μm) using a mixture of methanol-water system as mobile phase by gradient elution.The 16 perfluoroalkyl acids were analyzed by MS under multiple reaction monitoring mode(MRM).The linear ranges of 16 perfluoroalkyl acids were between 1 ng/mL and 1 000 ng/mL.The limits of quantitation were between 0.21 μg/m2and 1.53 μg/m2.The recoveries ranged from 84.8%to 107.4%,with relative standard deviations(RSDs,n=6) not more than 7.2%.This method was fast,sensitive,accurate,precise and convenient to operate,and it was appropriate for the determination of perfluoroalkyl acids in textiles in routine tests.
Key words:textile;perfluoroalkyl acids;high performance liquid chromatography-tandem mass spectrometry(HPLC-MS/MS);determination
中图分类号:O657.63;F768.1
文献标识码:A
文章编号:1004-4957(2016)02-0213-06
doi:10.3969/j.issn.1004-4957.2016.02.013
*通讯作者:郑建国,博士,研究员,研究方向:分析化学,Tel:020-38290376,E-mail:zhengjg@iqtc.cn
基金项目:国家质检总局科研项目(2013IK003,2013IK095);质检公益性行业科研专项(2012104020)
收稿日期:2015-09-02;修回日期:2015-10-21
张子豪,硕士,助理工程师,研究方向:分析化学,Tel:020-38290373,E-mail:zhang_ziho@126.com
