基于气相色谱-质谱联用技术的痛风病人血清代谢特征分析
2016-03-24韦双双李海昌温成平许国旺
陈 娇,周 佳,韦双双,李海昌,温成平*,许国旺
(1.浙江中医药大学 基础医学院,中医临床基础研究所,浙江 杭州 310053;
2.中国科学院大连化学物理研究所,中国科学院分离分析化学重点实验室,辽宁 大连 116023)
基于气相色谱-质谱联用技术的痛风病人血清代谢特征分析
陈娇1,周佳1,韦双双1,李海昌1,温成平1*,许国旺2*
(1.浙江中医药大学基础医学院,中医临床基础研究所,浙江杭州310053;
2.中国科学院大连化学物理研究所,中国科学院分离分析化学重点实验室,辽宁大连116023)
摘要:痛风是一组仅见于人类的异质性疾病,随着时间的推移,将导致慢性关节炎并逐渐致残。该研究将基于气相色谱-质谱联用技术(GC-MS)的代谢组学方法应用于痛风病人的血清代谢特征分析。首先利用GC-MS获得痛风病人和健康人的血清代谢指纹图谱,采用多变量统计分析对所得数据进行分析。主成分分析(PCA)得分图显示,痛风病人与健康人的血清代谢谱有差异。通过偏最小二乘-判别分析(PLS-DA)对样品进行进一步分型,根据模型的变量重要性因子(VIP值)及非参数检验结果筛选差异代谢物。共筛选出43种可能与痛风相关的代谢物,并对其中22个变量进行结构鉴定,主要包括丙二醇、2,3-二羟基丁酸、2,4-二羟基丁酸、赤藓糖醇、苏糖醇、苏糖酸、阿拉伯糖醇、D-葡萄糖酸、肌醇、次黄嘌呤、尿酸、尿苷、3-羟基-3-甲基丁酸、鸟氨酸、吲哚-3-乳酸、单乙醇胺、甘油、甘油酸、月桂酸及亚油酸等代谢物。与健康人相比,痛风病人的糖代谢、核苷酸代谢、氨基酸代谢及脂类代谢均发生了明显的紊乱。这些结果将为痛风临床诊断及治疗提供重要依据。
关键词:痛风;代谢组学;气相色谱-质谱联用;血清
痛风曾被称作“病中之王”,其与其他疾病的高并发率及日渐升高的死亡率,已经使之成为当今世界困扰人类的主要疾病之一[1]。痛风是由于尿酸或尿酸盐结晶在细胞外液达到过饱和状态导致晶体沉积而引发的一类以急性反复性发作的晶体性关节炎为临床特征的嘌呤代谢紊乱疾病[2]。不同人群的总体患病率约为1.4%[3],且在世界范围内有增加的趋势[4],已成为男性中最常见的关节炎症疾病[5]。
痛风是人类认识的最古老疾病之一,在与之斗争的漫长岁月中,人类对它有着深刻的认识。但随着临床经验的积累及新技术的应用,新的问题逐渐显现[6]。1977年美国风湿病学会制定的痛风诊断标准,将高尿酸(男性>7 mg/dL,女性> 6 mg/dL)作为唯一的血清学诊断指标[7],但有证据显示将尿酸水平作为痛风的诊断标志易导致不确定诊断[8]。疾病分期对于正确认识痛风及临床指导十分重要,目前普遍根据自然病程进行分期,但无法体现痛风不同阶段的病理基础[9];而且这种分期方法侧重于将痛风定义为反复发作的急性爆发性疾病而忽略了晶体慢性沉积的影响,将会给痛风的有效管理和治疗造成一定的阻碍[10]。现代医学虽然对痛风的病因机制了解得较为深入,但是临床仍存在治疗不当的问题[4]。因此,需要对痛风这一古老疾病进行新的更深入的研究,从而更好地指导临床诊断及治疗。
代谢组学,作为系统生物学的一个分支,是通过考察机体受到刺激或扰动后体内小分子代谢物的变化来研究生物体系的一门科学[11-12]。主要研究反映病理生理等刺激和扰动引发的机体内源性代谢物的变化,在疾病诊断、发病机制探讨及药效学评价等方面具有极大的优势[13-15]。基于1H-核磁共振(NMR)的关节液代谢组学方法已被用于包括痛风及类风湿性关节炎在内的各类关节炎的区分[16]。也有学者基于高效液相色谱-二极管阵列法(HPLC-DAD)的代谢组学方法对痛风患者血清和尿液代谢物变化进行研究[17]。但较少有报道将气相色谱-质谱联用技术(GC-MS)应用于痛风的代谢组学研究。GC-MS是应用非常广泛的一种代谢组学分析方法,其高灵敏度及高分离效率非常适合进行全组分分析。与液相色谱-质谱联用技术(LC-MS)相比,GC-MS无明显的离子抑制效应[18],而且在色谱分析及质谱碎片的重复性方面有明显优势。
本研究拟用GC-MS方法对痛风病人的血清代谢轮廓进行研究,并利用多变量统计分析对代谢物进行模式识别,分析痛风病人及正常人的血清代谢指纹谱差异,筛选差异代谢物并加以鉴定,寻找痛风病人体内潜在的代谢变化及其相关代谢途径,并进行相关讨论。
1实验部分
1.1试剂与仪器
甲醇(色谱纯,Tedia公司,Fairfield,OH,USA);甲氧胺、N-甲基三甲基硅基三氟乙酰胺(MSTFA)、吡啶及定性所用标准样品(Sigma-Aldrich公司,St.Louis,MO,USA);超纯水由Milli-Q 系统(Millipore Corp,Millipore,MA,USA)提供。
Agilent 7890/5975C GC-MS气相色谱-质谱联用仪(Agilent Technologies,Santa Clara,CA,USA);冷冻离心浓缩仪(Labconco CentriVap System,Labconco.Kansas,MO,USA)。
1.2样品采集及预处理
血清样本包括29例痛风患者及26例健康人对照组。痛风患者样本纳入标准符合1977年美国风湿病学会痛风诊断标准,平均年龄为50.3±11.4岁,血尿酸的平均值为514.3±102.7 μmol/L。所有样本采集后置于-80 ℃保存。
血清样本处理方法:分析时,先将样本置于室温下解冻并混匀;50 μL 血清中加入200 μL冷甲醇(此操作在冰水浴中进行),涡旋30 s后离心10 min(4 ℃,12 000 g/min);取上清液冻干,分析前复溶于50 μL甲氧胺吡啶(20 mg/mL)中,在40 ℃水浴中肟化反应90 min;再加入40 μL MSTFA,40 ℃水浴下衍生反应60 min。质量控制(QC)样品制备:将进行分析的全部血清样本取等量混匀后,按照上述方法进行相同处理,得到QC样品。
1.3GC-MS分析条件
采用DB-5MS石英毛细管柱(30 m×0.25 mm×0.25 μm,J & W Scientific,Folsom,CA,USA)进行分离;进样体积为1 μL,分流比为10∶1;载气为氦气(99.999 6%),流速为1.2 mL/min;柱温箱升温程序:初始70 ℃保持3 min后,以5 ℃/min升温至300 ℃,并保持5 min;进样口温度为300 ℃,传输线温度为280 ℃;电子轰击离子(EI)源温度为230 ℃;溶剂延迟时间为4.8 min;质谱扫描范围m/z33~600;分析过程中随机安排样本进样顺序,每隔10个样本加入1个QC样品检测。
1.4数据处理
利用AMDIS 2.62软件(NIST,Boulder,CO,USA)对GC-MS得到的代谢谱图进行峰识别及重复峰解析,在MSD工作站(Agilent Technologies,Santa Clara,CA,USA)进行积分,得到由质荷比、保留时间及对应峰面积组成的数据矩阵。经方差归一化标度(UV Scaling)后,用SIMCA-P 11.0(Umetrics AB,Umea°,Sweden)软件对样本进行主成分分析(PCA)和偏最小二乘-判别分析(PLS-DA)。根据VIP值筛选差异代谢物,并利用SPSS21.0统计学软件(SPSS 21,International Business Machines Cor.,Armonk,USA)进行t检验,显著性水平设为p<0.05;依据所获得的质谱图,利用NIST05数据库(National Institute of Standards and Technology,Gaithersburg MD,USA)对筛选的差异代谢物进行结构鉴定,最后用标准品对鉴定结果进行验证。
2结果与讨论
2.1代谢组学方法考察
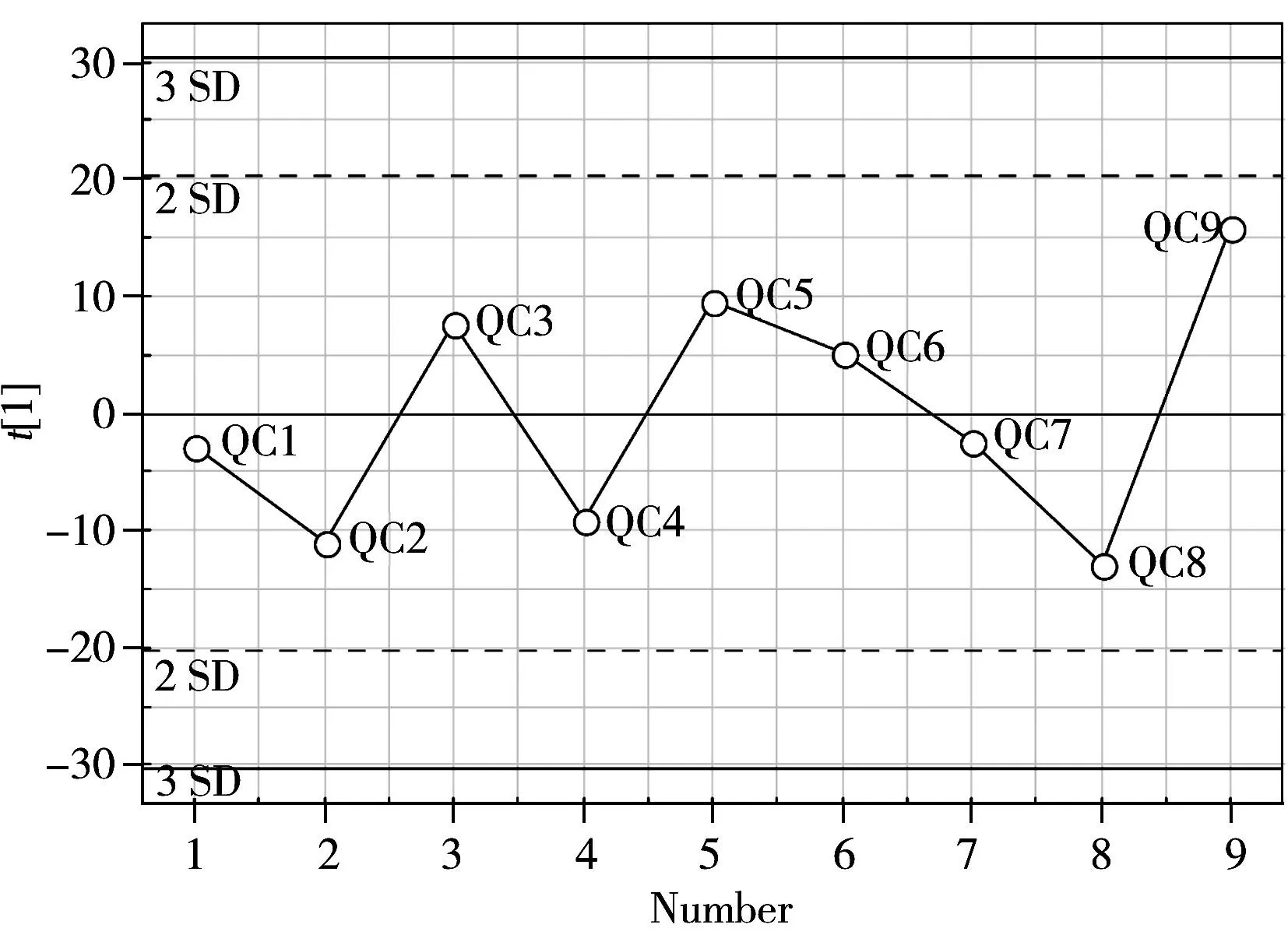
图1 QC样品的PCA分析结果Fig.1 The PCA score plot of QC samples

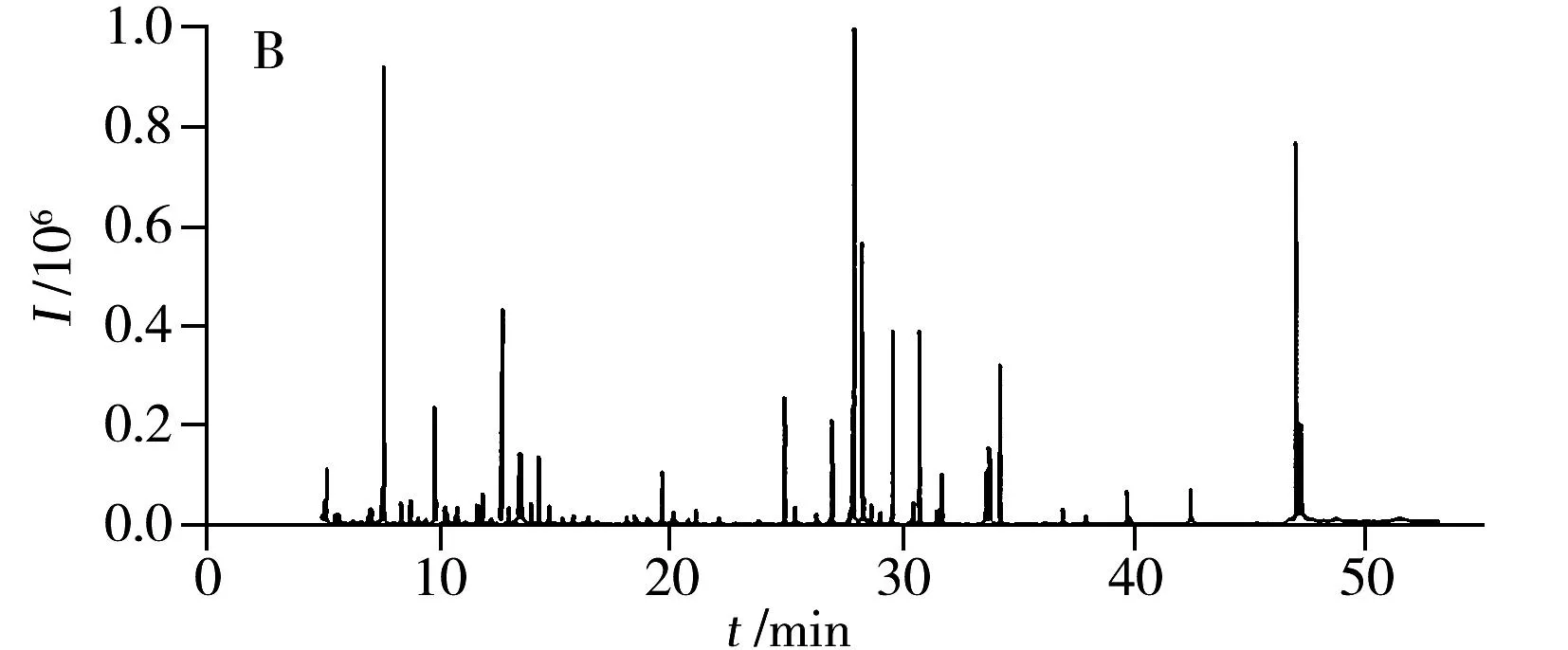
图2 痛风病人(A)和健康人(B)血清的典型总离子流色谱图Fig.2 Representative total ion current(TIC)chromatograms of serum from patients with gout(A)and healthy controls(B)
经去卷积后,共检测到324个代谢物信息。为了考察分析方法的稳定性,在分析序列中每隔6个样本加入1个QC样品。对QC样品进行PCA分析(如图1所示),所有QC样品均在2倍SD范围内,说明该方法的重复性好,能够满足代谢组学的分析要求。
2.2血清代谢组学分析
对痛风病人和健康人对照组的血清样本进行GC-MS分析,得到的典型总离子流色谱图如图2所示。经过修正80%规则[19]去除缺失值后,共得到197个变量进行下一步的统计学分析。


PCA是一种无监督的模式识别分析方法,可在多维空间对样本间差异进行直观显示。如图3A所示,在PCA模型中,痛风病人和健康人两组样品的代谢表型有一定的区分,说明痛风病人和健康人的血清代谢指纹存在差异。为了更好地对痛风病人与健康人的血清代谢谱进行分型并筛选差异代谢物,对代谢数据进行PLS-DA分析。PLS-DA是一种有监督的模式识别方法,目的是建立类别间的数学模型,使样本间达到最大分离。建立的模型解释能力参数R2Y=0.809,预测能力参数Q2=0.531,置换检验结果显示该模型不存在过拟合的现象。图3B是PLS-DA得分图,可以看到痛风病人与健康人的血清代谢差异区分更加明显。
根据PLS-DA模型的VIP值来筛选差异代谢物,VIP>1的变量被认为对分类起着关键作用(图3C)。对筛选的差异代谢物进行显著性检验,同时符合VIP>1且p<0.05的43个变量被认为与痛风有潜在关联。利用NIST05数据库对变量可能结构进行鉴定,并用标准品对鉴定结果的可靠性进行验证,最终共鉴定出22种代谢物(见表1)。与健康人对照组相比,痛风病人的碳水化合物代谢(丙二醇、2,3-二羟基丁酸、2,4-二羟基丁酸、赤藓糖醇、苏糖醇、苏糖酸、阿拉伯糖醇、D-葡萄糖酸、肌醇)、核苷酸代谢(次黄嘌呤、尿酸、尿苷)及氨基酸代谢(3-羟基-3-甲基丁酸、鸟氨酸、吲哚-3-乳酸)相关物质的水平均显著上调;脂类代谢(单乙醇胺、甘油、甘油酸、月桂酸及亚油酸)水平及甘氨酸、亚牛磺酸的血清含量显著下降。
2.3痛风相关代谢途径的变化
痛风是由于嘌呤类物质代谢紊乱,导致血尿酸水平升高而引发尿酸盐晶体沉积所致的一组代谢性疾病。对痛风病人体内代谢途径变化的研究将为痛风的诊断及治疗提供重要依据。本研究结果(图4)显示,与健康人相比,痛风患者糖代谢、核苷酸代谢、氨基酸代谢及脂类代谢均发生了一定程度的紊乱。
本研究发现在痛风病人的血清中尿酸及次黄嘌呤水平发生了显著升高,也有研究证明这两项水平升高是痛风的典型特征[20]。尿酸盐合成过多是继发性痛风的重要病因之一。人尿酸合成的速度主要取决于细胞内磷酸核糖焦磷酸(PRPP)的浓度。尿苷是PRPP的下游产物,D-葡萄糖酸是葡萄糖氧化的产物,能够转化为PRPP,二者在本研究中均被检测到显著上调,说明痛风病人体内尿酸的合成速度加快。另外,鸟氨酸的显著升高说明痛风病人的尿素循环也发生异常。
本研究中,痛风病人血清中多种有机酸的水平明显上调,其中3-羟基-3-甲基丁酸(HMB)是亮氨酸的活性代谢产物,动物研究发现膳食补充HMB会导致胶原沉积,临床样本实验也证明了这一点,且主要表现为羟脯氨酸含量升高[21]。血清中羟脯氨酸含量上升则与体内结缔组织增生或破坏密切相关,而痛风的主要特征正是尿酸盐结晶在关节、肾及周围结缔组织中沉积引发炎症。2,3-二羟基丁酸是苏氨酸的代谢产物[22]。苏氨酸是人体必需氨基酸,是一种生糖氨基酸,而亮氨酸作为支链氨基酸,在机体能量供应中也起着重要作用,它们下游产物的增加提示痛风病人能量消耗可能增加。研究表明,炎症和氧化应激在高尿酸血症的形成中起重要作用[23]。苏糖酸是抗坏血酸的主要代谢产物,而L-抗坏血酸是反映机体氧化应激状态的代谢物[24];本研究中苏糖酸呈现明显的上升趋势,说明痛风与氧化应激密切相关。肌醇与细胞内脂肪酸的氧化有关,所以肌醇的升高可能会加剧能量代谢和脂代谢异常[25]。

表1 鉴定得到的痛风病人和健康人的血清差异代谢物
*:p<0.05,** :p<0.01
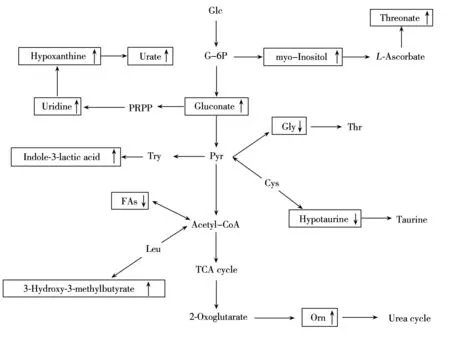
图4 重要差异代谢物在相关代谢通路中的变化
一碳单位是嘌呤、嘧啶的合成原料,甘氨酸分解代谢是体内一碳单位的主要来源。甘氨酸水平的下降可能是由于甘氨酸分解代谢加强,导致痛风病人体内嘌呤合成增加,引发嘌呤代谢紊乱。肥胖是痛风发病的一个重要相关因素,在肥胖症患者体内能够发现牛磺酸水平降低[26]。有研究进一步发现牛磺酸有抗炎[27]、抗氧化[28]及改善胰岛素敏感性[29]的作用,在本研究中明显下降的亚牛磺酸是牛磺酸合成的前体物质,这部分解释了痛风患者并发肥胖及糖尿病的原因。甘油、甘油酸、月桂酸及亚油酸的显著下调则说明痛风病人体内脂类代谢水平下降。
3结论
利用GC-MS对痛风病人及健康人的血清进行了代谢轮廓分析。利用多变量统计学分析对两组样本进行分析,结果显示痛风病人与健康人的血清代谢图谱有明显的差异,并鉴定出22个差异代谢物。与健康人相比,痛风病人核苷酸代谢、糖代谢及氨基酸代谢呈现显著的上升趋势,而脂类代谢则有明显下降。本研究证明GC-MS是进行疾病血清特征分析的有效手段,鉴定的差异代谢物有望成为潜在的生物标志物,并为痛风的临床诊断及机制的深入研究提供参考依据。
参考文献:
[1]Robinson P C,Dalbeth N.Expert.Opin.Pharmacother,2015,16(4):533-546.
[2]Sarawate C A,Patel P A,Schumacher H R,Yang W Y,Brewer K K,Bakst A W.J.Clin.Rheumatol.,2006,12(2):61-65.
[3]Annemans L,Spaepen E,Gaskin M,Bonnemaire M,Malier V,Gilbert T,Nuki G.AnnRheumDis.,2008,67(7):960-966.
[4]Crittenden D B,Pillinger M H.Annu.Rev.Med.,2013,64:325-337.
[5]Mikuls T R,Saag K G.Curr.Opin.Rheumatol.,2006,18(2):199-203.
[6]Wu D H.Chin.J.Rheumatol.(吴东海.中华风湿病学杂志),2015,19(1):1-3.
[7]Wallace S L,Robinson H,Masi A T,Decker J L,McCarty D J,Yu T F.ArthritisRheum.,1977,20(3):895-900.
[8]Guggi V,Calame L,Gerster J C.JointBoneSpine,2002,69(1):58-61.
[9]Bardin T,Richette P.Curr.Opin.Rheumatol.,2014,26(2):186-191.
[10]Harrold L R,Mazor K M,Negron A,Ogarek J,Firneno C,Yood R A.Rheumatology(Oxford),2013,52(9):1623-1629.
[11]Madsen R,Lundstedt T,Trygg J.Anal.Chim.Acta,2010,659(1/2):23-33.
[12]Priori R,Scrivo R,Brandt J,Valerio M,Casadei L,Valesini G,Manetti C.AutoimmunRev.,2013,12(10):1022-1030.
[13]Williamson M P,Humm G,Crisp A J.Br.J.Rheumatol.,1989,28(1):23-27.
[14]He H B,Ren X B,Wang X Y,Shi X Z,Wang X L,Ding Z J,Gao P,Xu G W.J.Pharm.Biomed.Anal.,2012,59:130-137.
[15]Gu Y,Lu C,Zha Q L,Kong H W,Lu X,Lu A P,Xu G W.Mol.Biosyst.,2012,8(5):1535-1543.
[16]Hügle T,Kovacs H,Heijnen I A,Daikeler T,Baisch U,Hicks J M,Valderrabano V.Clin.Exp.Rheumatol.,2012,30:240-245.
[17]Liu Y,Sun X M,Di D L,Quan J X,Zhang J,Yang X F.Clin.Chim.Acta,2011,412(23/24):2132-2140.
[18]Koek M M,Jellema R H,van der Greef J,Tas A C,Hankemeier T.Metabolomics,2011,7(3):307-328.
[19]Smilde A K,van der Werf M J,Bijlsma S,Werff v d,van der Vat B J,Jellema R H.Anal.Chem.,2005,77(20):6729-6736.
[20]Zhu S Y,Zhou Y D,Du G H.HeraldMed.(朱深银,周远大,杜冠华.医药导报),2006,8(25):803-806.
[21]Williams J Z,Abumrad N,Barbul A.Ann.Surg.,2002,236(3):369-375.
[22]Thompson J A,Markey S P,Fennessey P V.Clin.Chem.,1975,21(13):1892-1898.
[23]Violi F,Cangemi R,Brunelli A.Arterioscler.Thromb.Vasc.Biol.,2005,25(4):e37;author reply e37.
[24]Vincent A M,Russell J W,Low P,Feldman E L.Endocr.Rev.,2004,25(4):612-628.
[25]He H B,Shi X Z,Chen J,Gao P,Lei Y Y,Xu G W.Chin.J.Chromatogr.(和红兵,石先哲,陈静,高鹏,雷雅燕,许国旺.色谱),2012,30(3):245-251.
[26]Jeevanandam M,Ramias L,Schiller W R.Metabolism,1991,40(4):385-390.
[27]Marcinkiewicz J,Grabowska A,Bereta J,Stelmaszynska T.J.Leukoc.Biol.,1995,58(6):667-674.
[28]Hwang D F,Hour J L,Cheng H M.FoodChem.Toxicol.,2000,38(7):585-591.
[29]Haber C A,Lam T K,Yu Z,Gupta N,Goh T,Bogdanovic E,Giacca A,Fantus I G.Am.J.Physiol.Endocrinol.Metab.,2003,285(4):E744-E753.
Analysis of Serum Metabolic Characteristics in Patients with Gout Using Gas Chromatography-Mass Spectrometry
CHEN Jiao1,ZHOU Jia1,WEI Shuang-shuang1,LI Hai-chang1,WEN Cheng-ping1*,XU Guo-wang2*
(1.College of Basic Medical,Zhejiang Chinese Medical University,Hangzhou310053,China;2.CAS Key Laboratory of Separation Science for Analytical Chemistry,Dalian Institute of Chemical Physics,Chinese Academy of Sciences,Dalian116023,China)
Abstract:Gout is a highly heterogeneous disease which occurs only in human being,it would cause gouty arthritis,and even lead to disability.There could be obvious alterations of metabolites in the serum of the patient with gout,and the discovery of metabolic characteristics may be helpful for the clinical diagnosis and treatment of gout.A gas chromatography-mass spectrometry(GC-MS) based metabolic profiling method was employed to analyze the distinctive metabolic patterns of serum in gout patients.Serum samples collected from 29 gout patients and 26 healthy controls were analyzed.The principal component analysis(PCA) and partial least squares discriminant analysis(PLS-DA) were used to assess the metabolic data.Marked differences between gout patients and healthy controls were shown in PCA score plot.Variable importance for project values(VIP) and Student’s t-test were combined to pick out the significant metabolic changes.Compared with that of the control group,the serum metabolic characteristics of the gout group were featured by increased levels of metabolites related to nucleotide metabolism(hypoxanthine,uric acid and uridine),carbohydrate metabolism(2,3-dihydroxybutyrate,D-threitol,D-gluconic acid,myo-inositol,etc.) and amino acid metabolism(3-hydroxy-3-methylbutyrate,L-ornithine and indole-3-lactic acid),decreased levels of lipids(monoethanolamine,glycerol,glyceric acid,etc.),glycine and hypotaurine.The preliminary results suggest that GC-MS based metabolic profiling method appears to be a useful tool in the exploration of the serum metabolic characteristics of gout.These revealed disease-associated metabolic perturbations involved in multiple metabolic pathways including purine metabolism and the urea cycle,which could help to elucidate the pathogenesis of gout and provide a potential aid for the accurate diagnosis or treatment of gout.
Key words:gout;metabolomics;gas chromatography-mass spectrometry(GC-MS);serum
中图分类号:O657.63;S852.5
文献标识码:A
文章编号:1004-4957(2016)02-0137-06
doi:10.3969/j.issn.1004-4957.2016.02.003
*通讯作者:许国旺,博士,研究员,研究方向:代谢组学分析技术平台及其在疾病、中药、植物表型、食品安全等方面应用的研究,Tel:0411-84379530,E-mail:xugw@dicp.ac.cn
基金项目:浙江省科技厅计划项目-分析测试科技计划项目(2015C37045);国家自然科学基金青年科学基金项目(81403269);国家重点基础研究发展计划资助项目973计划(2014CB543001)
收稿日期:2015-08-17;修回日期:2015-10-19
温成平,博士,教授,研究方向:免疫风湿病的中医临床基础治法与临床研究,Tel:0571-86613131,E-mail:wengcp@163.com
