化妆品分析样品前处理方法研究进展
2016-03-24张艳树林振华胡玉玲李攻科
张艳树,林振华,胡玉玲,李攻科
(中山大学 化学与化学工程学院,广东 广州 510275)
化妆品分析样品前处理方法研究进展
张艳树,林振华,胡玉玲,李攻科*
(中山大学化学与化学工程学院,广东广州510275)
摘要:作为与人们日常生活紧密相关的消费品之一,化妆品中禁、限用成分的分析检测,对于监控化妆品质量、保证消费者使用安全具有重要的研究意义。由于化妆品基质复杂,基体干扰严重,难以对目标物进行直接检测,因此需要采用样品前处理技术对其进行分离富集。该文综述了近年来的化妆品样品前处理方法,包括消解法、液-液萃取、固相萃取、固相微萃取、液相微萃取技术、微波辅助萃取以及超声波辅助提取等,并对其发展方向进行了展望。
关键词:化妆品;样品前处理;综述;研究进展
随着人们生活水平不断提高和化妆品种类的多样化,化妆品已成为与人们生活紧密相关的必需品之一,其安全性问题也引起了人们的广泛关注。化妆品中添加的重金属会通过皮肤渗透,累积在人体内[1],其他有害物质如防腐剂、防晒剂、染色剂和激素等可引发皮炎、过敏反应等[2-3],对人体健康具有潜在危害。我国《化妆品卫生规范》(2007年版)中列出了1 286种禁用物质和406种限用物质[4]。因此,对化妆品中常见的禁、限用成分的分析检测对于严格控制化妆品的生产质量,保证消费者的身体健康具有重要的研究意义。图1是从2005~2015年间化妆品样品前处理相关文献的发表情况,文献发表数目总体呈上升趋势,从2011年开始增长速度明显加快。随着人们生活水平的提高,化妆品行业也得到迅速发展,不同功能和形态的化妆品不断出现以满足人们消费需要,因而化妆品样品的分析检测也越来越受到人们的关注。

图1 2005~2015年间化妆品样品前处理相关文献的发表情况Fig.1 Number of publications reporting on pretreatment of cosmetic samples during 2005-2015source:CNKI and Web of Science;keywords:sample treatment or sample preparation and cosmetic;searching time:from January 1,2005 to August 26,2015
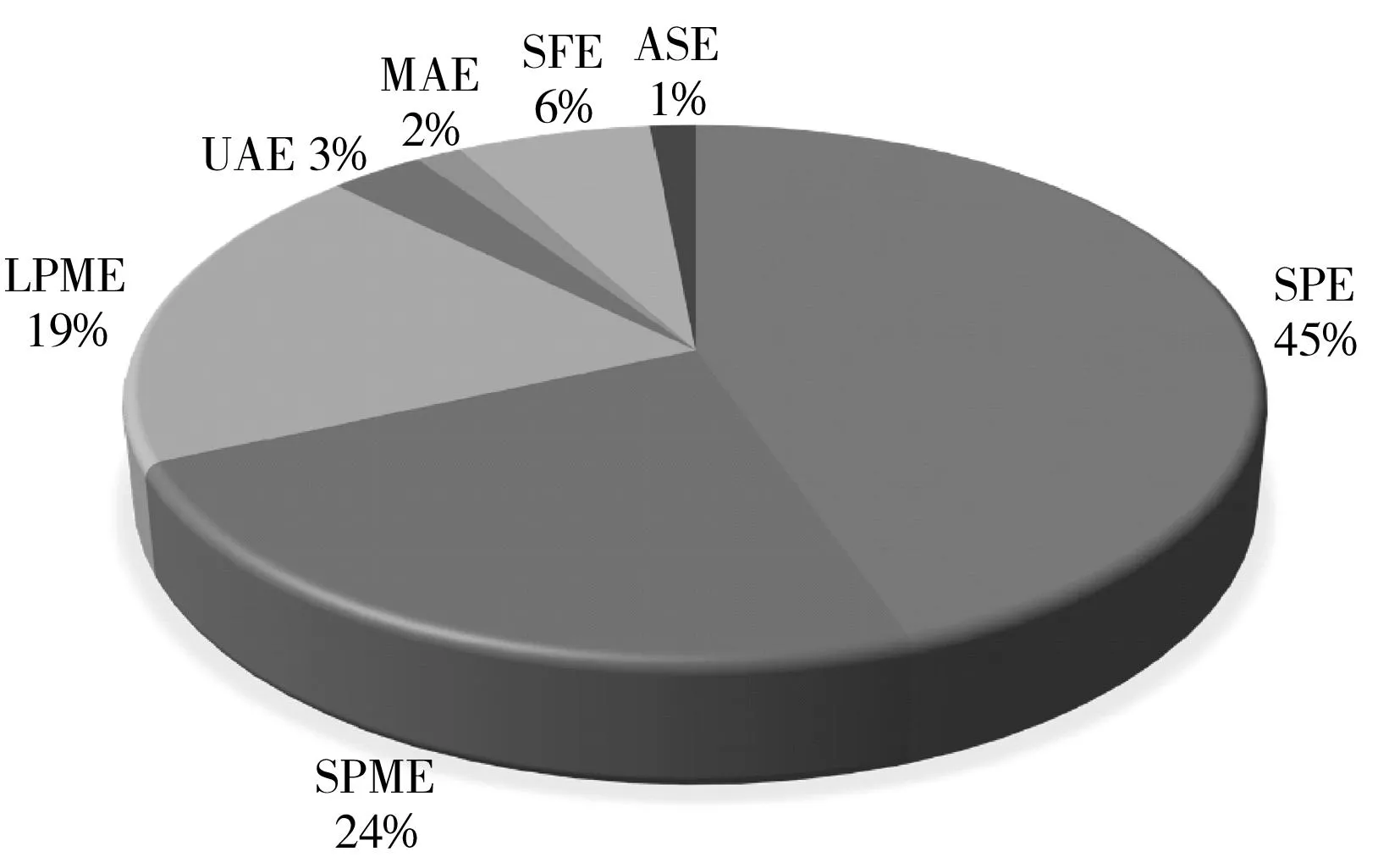
图2 2005~2015年间常用的样品前处理技术在化妆品前处理应用的相关文献发表情况Fig.2 Sample pretreatment techniques for cosmetic analysis published during 2005-2015SPE:solid phase extraction;SPME:solid phase microextraction;LPME:liquid phase microextraction;MAE:microwave-assisted extraction;UAE:ultrasound-assisted extraction:SFE:super-critical fluid extraction;ASE:accelerated solvent extraction

由于化妆品形态多样,包括固体、液体、乳状、胶状和膏状等,各类样品基体不同,成分复杂,基质干扰物多,难以对样品中的目标物直接进行分析检测,因此需要根据检测目标,选择合适的样品前处理技术,排除基体干扰,分离富集样品中的目标物,以达到准确测定的目的。
传统用于化妆品样品前处理的方法包括消解法、液液萃取法和浊点萃取法等,这些经典的样品前处理方法虽适用范围广,但普遍存在操作复杂、耗时长、有机溶剂用量大等缺点。近年来发展了许多新型的样品前处理技术,如固相萃取(SPE)、固相微萃取(SPME)、液相微萃取(LPME)、超声辅助萃取(UAE)、微波辅助萃取(MAE)等[10]。图2列出了2005~2015年间新型样品前处理技术用于化妆品前处理相关文献的发表情况。从图中可以看出,SPE、SPME和LPME大量应用于化妆品样品前处理,这些技术的发展较为成熟,克服了上述传统样品前处理技术的缺点,具有较好的分析灵敏度和选择性,其他如MAE、UAE和SFE等方法目前虽应用较少,但因具有萃取效率高、操作简便、环境污染小和更适用于固体样品前处理等优点,逐渐受到重视。表1中详细总结了目前用于化妆品样品前处理的各种方法的适用对象以及优缺点。

表1 常用的化妆品样品前处理方法的适用对象及优缺点
(续表1)

Pretreatmentmethod(样品前处理方法)Applicablematrix(适用对象)Advantage(优点)Disadvantage(缺点)固相萃取技术(SPE)液体、乳液、膏霜类以及油状类(如洗发水、调色剂和面霜)无相分离,操作简便,选择性好回收率低,固相萃取柱易被堵塞固相微萃取技术(SPME)液体、霜膏类和乳液(如爽肤水、防晒霜)分离、富集和进样合为一体,方法简单、快速,萃取涂层易磨损,价格昂贵,重现性差液相微萃取技术(LPME)液体、乳液(如洗发液、爽肤水)萃取效率高,快速,有机溶剂消耗少,灵敏度高稳定性较差,不利于重复使用超声波辅助提取法(UAE)固体、液体、乳液以及膏霜类(如粉饼、爽肤水、护发乳以及面霜)操作简便,效率高,成本低,适合大量样品的处理空化强度、溶剂特性、颗粒大小和致密程度均影响提取率,需配合离心、过滤等后续操作微波辅助萃取(MAE)固体、膏霜类(如口红、防晒霜)加热均匀,快速,操作简单,溶剂消耗少需要极性提取剂,后续需要过滤等步骤加速溶剂萃取(ASE)固体、膏霜类(如口红、洗发膏)封闭体系可降低溶液挥发,有机溶剂消耗少,回收率高仪器成本高,分析物需热稳定性好超声辅助雾化(乳化)微萃取(UNE,UAEM)液体、乳液(洗发液、沐浴露和调节剂)提取效率高,节省溶剂仪器成本高超临界流体萃取(SFE)固体、膏霜类(如口红、睫毛膏)快速,选择性好,溶剂消耗少,富集倍率高,易与色谱实现在线联用萃取装置昂贵,水含量高,易造成节气门堵塞
目前,有关化妆品样品前处理技术的综述性文章较少。2013年,Cabaleiro等[11]对1992~2012年间用于化妆品样品前处理方法的相关文献进行了综述,重点介绍了后期新发展的样品前处理技术(如LPME、UAE、MAE、ASE和SFE等)在化妆品样品前处理领域的应用。而国内有关化妆品样品前处理方法的综述尚未见报道。本文详细综述了近几年来化妆品样品前处理方法的研究进展,包括传统的样品前处理方法如消解法、液液萃取法,以及后续发展的相分离样品前处理方法和场辅助萃取技术等。
1传统的样品前处理技术
消解法、液液萃取法和浊点萃取法作为经典的样品前处理技术,在化妆品样品前处理中有较为广泛的应用,这些传统的方法成熟可靠,且适用于各种形态化妆品的前处理,但普遍存在操作复杂、耗时长且消耗大量有机溶剂的缺点,环境污染大。此外,通常需要后续的纯化过程去除杂质,可与其他样品前处理技术如固相萃取技术联用。
1.1消解法
消解法多用于化妆品中重金属分析的样品前处理过程,主要包括干法灰化、湿法消解和微波消解法,适用于处理各种形态的化妆品样品。通过消解法进行样品预处理后,可采用ICP-MS、ICP-OES和AAS等检测手段,对化妆品中如铅、砷和汞等重金属进行分析检测。如柳玉红等[12]采用干灰化法消解样品,氢化物原子荧光光度法测定化妆品中的锑,灰化温度450 ℃,灰化时间4 h,该方法的检出限为0.14 μg/L,回收率为83.8%~113.0%。干法灰化需要高温灼烧化妆品样品以除去有机成分,但高温易造成砷、汞等挥发性元素的损失。许菲菲等[13]采用湿式消解法和微波消解法处理样品后,原子荧光光谱法同时测定化妆品中的砷和锑,检出限分别为0.010 μg/L和0.027 μg/L,回收率分别为90.0%~102.2%和88.3%~102.8%。Al-Saleh等[14]采用湿法消解处理样品,通过原子吸收法检测了口红和眼影样品中的铅。张爱平等[15]建立了微波消解结合石墨炉原子吸收光谱测定化妆品中铅的分析方法,成功用于5种化妆品中铅的测定,回收率为95.0%~106.1%,检出限为0.33 ng/mL,该方法有望用于化妆品中痕量铅的检测。张遴等[16]通过微波消解进行样品前处理,采用ICP-MS同时测定化妆品中的铅、镉、铬、砷和汞,回收率为96.0%~116.0%。Volpe等[17]采用微波消解法处理眼影样品,FAAS法检测样品中的铅,ICP-MS法检测镉、钴、铬和镍。湿法消解和微波消解法均需采用强酸处理样品,但湿法消解耗时较长,且空白值高,操作中易引入污染,相比之下,微波消解法耗时短、操作简便、样品无损失,因此,在测定化妆品中的重金属时,微波消解法用于样品的前处理过程最为广泛。
1.2液-液萃取法
液-液萃取(Liquid-liquid extraction,LLE)是最常用的传统样品前处理技术,应用范围广且技术成熟。李玮等[18]选用二氯甲烷-丙酮(9∶1)作为唇膏和指甲油样品的提取剂。采用有机溶剂溶解样品,以水作溶剂对样品进行前处理后,采用HPLC同时检测了样品中的胭脂红、萘酚黄、日落黄等7种着色剂。李慧勇等[19]采用乙腈水溶液-正己烷萃取化妆品中的4种生育酚异构体及α-生育酚乙酸酯。一般情况下,加热、振荡、离心分离等操作在液-液萃取中是必要的,并且,液-液萃取法的选择性差,与目标分析物极性相似的杂质易被同时萃取,需要后续的操作对样品进行纯化。钟志雄等[20]采用乙酸-乙腈溶液提取样品中的铵和6种烷基胺,用固相萃取柱去除阴离子、中和氢离子后,采用离子色谱法分析。这些耗时的操作过程增加了液-液萃取的操作难度,有机溶剂的大量使用也极大增加了环境负荷。
液-液萃取用于化妆品样品前处理时,乳化作用是常见的问题,这是由于表面活性剂是化妆品中常见的原料,乳化作用会导致有机相和水相难以分层,造成萃取产物损失,降低萃取效率。因此,选用液-液萃取法用于萃取化妆品样品时,需针对实际样品类型优化萃取条件,防止乳化现象。赵珊等[21]建立了化妆品中7种性激素同时测定的分析方法,在样品前处理阶段,首先在试样中加入氢氧化钠溶液与样品中的油脂成分进行皂化反应,该步骤可明显减少乳化现象,然后选用二氯甲烷和乙酸乙酯(40∶1)作为萃取溶剂,萃取率为84.6%~98.0%。李铭等[22]采用液-液萃取法萃取化妆品中的硼酸及硼酸盐,通过实验发现,对于市售的润肤膏霜、润肤乳液等脂溶性化妆品,采用乙腈作为萃取剂有较好的破乳效果,联合离子色谱法检测,回收率为87%~108%。
1.3浊点萃取法
浊点萃取法(Cloud-point extraction,CPE)基于表面活性剂的浊点现象,改变外部条件而使表面活性剂溶液发生相分离,从而实现样品中待测物的萃取,相比传统的液-液萃取法,具有有机溶剂体积小和操作简单的优点。Wu等[23]采用Triton X-114为表面活性剂,浊点萃取法为样品前处理技术,用于防晒霜中3种苯甲酮类物质的分析。Soruraddin等[24]选用Triton X-100为表面活性剂,采用浊点萃取法富集化妆品中的硒,经过离心和定量溶解后采用双硫腙分光光度法测定硒的浓度,通过浊点萃取预处理过程提高了检测的灵敏度,检出限为4.4 ng/mL。Liu等[25]以非离子表面活性剂AEO9为萃取溶剂,采用浊点萃取法分离化妆品中4种抗氧化剂,与高效液相色谱法联用,实现了化妆品中没食子酸丙酯、叔丁基对苯二酚、叔丁基羟基茴香醚和二叔丁基对甲酚的同时检测,该方法无需繁琐的样品前处理过程,具有简单、高效的优点。
2相分离样品前处理技术
相分离样品前处理技术是指在无外场作用下使目标分析物在萃取介质和样品基质之间进行动态分配,包括固相萃取、固/液相微萃取等,这类样品前处理技术具有选择性好、灵敏度高和消耗有机溶剂少的优点。目前,该类技术在化妆品样品前处理中多用于有机物的分离分析。
2.1固相萃取
固相萃取技术(Solid phase extraction,SPE)是近年来发展较为成熟的样品前处理技术,克服了传统的液液萃取中有机溶剂消耗大、操作复杂的缺点,且无相分离操作过程,大大减少了对环境的污染,具有操作简便、选择性好等优点,是化妆品前处理领域应用较为广泛的一种前处理方法。固相萃取剂的选择可提高对目标物的选择性和分析的灵敏度,根据不同的目标物选择合适的固相萃取剂,可实现对各类形态化妆品中有机物和重金属的分析检测。目前文献报道的用于化妆品样品前处理的固相萃取材料包括传统的市售固相萃取柱和离子交换柱,以及近年来发展的新型材料如分子印迹聚合物、功能化纳米复合材料、碳纳米管和金属有机骨架等。这些新型固相萃取剂的应用,解决了传统的固相萃取柱选择性差的问题,提高了对目标分析物的选择性,因此不断发展具有更高灵敏度和选择性的新型固相萃取材料仍是固相萃取技术的重要研究方向。表2列出了固相萃取技术在化妆品样品前处理中的应用情况。

表2 固相萃取在化妆品样品前处理中的应用
2.2固相微萃取
固相微萃取技术(Solid phase microextraction,SPME)无需有机溶剂,具有操作简便、分析快速的优点,集分离、富集和进样于一体,易于自动化。用于化妆品样品前处理时以液体或半固体类样品的处理为主,如霜类、乳类或爽肤水等,与GC和HPLC等分析检测手段联用,可实现在线分析检测,多为有机物的分析。
Li等[41]采用紫外光聚合法制备了聚乙二醇高分子固相微萃取涂层,结合HPLC法,用于化妆品中非挥发性对羟基苯甲酸酯类防腐剂的检测。Tsai等[42]采用聚丙烯酸酯涂层包覆的石英纤维,联用GC-MS分析手段,用于化妆品中抗氧化剂和防腐剂的检测。Fei等[43]制备了聚乙二醇二丙烯酸酯涂层修饰的固相微萃取纤维,并结合HPLC,建立了化妆品中苯甲酸酯类防腐剂的检测方法,固相微萃取纤维表现出良好的稳定性和重复性。Wang等[44]制备了一种新型的含氮碳纳米颗粒包覆的不锈钢金属纤维,结合HPLC,用于防晒霜中紫外线吸收剂的检测,检出限为0.02 μg/L,回收率为89.2%~119%。搅拌棒吸附萃取,相比固相微萃取纤维,厚度更大,因而具有更大的萃取容量和稳定性。Melo 等[45]提出了搅拌棒萃取结合液相色谱的分析方法,实现了身体乳霜、止汗药霜和防晒霜中4种防腐剂(甲基、乙基、丙、丁-苯甲酸酯)的同时测定,定量下限为30~200 μg/g。固相微萃取技术的核心是固相微萃取涂层,制备对目标分析物具有高选择性、稳定性好、灵敏度高的新型涂层有利于扩展固相微萃取的应用范围。
2.3液相微萃取
液相微萃取技术(Liquid phase microextraction,LPME)于1996年由Nuhu等[46]提出,该技术解决了传统液-液萃取法消耗溶剂量大的问题,集采样、萃取和分离富集为一体,具有萃取效率高、有机溶剂用量少、分析快速、灵敏度高等优点,是一种环境友好的样品前处理技术。目前液相微萃取在化妆品样品前处理的应用,以粘性半固态和液态化妆品为主,如面霜、洗发液、爽肤水等;分析物多为有机物,如苯甲酸酯类和邻苯二甲酸酯类等防腐剂,后续联用气相色谱或液相色谱等检测手段进行分析。LPME包括单滴液液微萃取(SDME)、分散液液微萃取(DLLME)和中空纤维液液微萃取(HF-LPME)3种形式。表3中列出了LPME在化妆品样品前处理中的应用,目前关于LPME用于化妆品样品前处理的相关文献较多,其中以DLLME的应用最广。

表3 液相微萃取在化妆品样品前处理中的应用
* no data
3场辅助样品前处理技术
场辅助样品前处理技术包括微波辅助萃取、超声辅助提取等,该技术通过在外场的作用下,加速目标物在萃取溶剂和样品基质之间的动态分配,大大加快传质速率,提高萃取速率,缩短萃取时间。这类前处理技术更适用于固体类样品的前处理,可将目标物快速、有效地从固体基质转移至合适的萃取溶剂中,在固态和膏霜状的化妆品样品前处理中应用较多,后续可与固相萃取、固/液相微萃取等技术联用以实现对目标物的进一步分离。
3.1超声波辅助提取
超声波辅助提取法(Ultrasound-assisted extraction,UAE)是使溶剂在超声波辅助下进行提取,利用其产生高速、强烈的空化效应和搅拌作用,缩短提取时间,提高提取效率。UAE比传统的溶剂提取方法更为广泛地用于化妆品的样品前处理,主要集中在有机物(如防腐剂、激素等物质)的分析方面,乙醇和甲醇是最常使用的提取溶剂。半固体类(乳霜、乳液、凝胶类)、液体类(爽肤水、卸妆油)和固体类(粉饼、口红)等绝大多数化妆品样品均可用该法进行样品前处理。相比其他前处理方法,超声辅助提取法用于化妆品中有机物提取时,具有操作简便、效率高且成本低的优点。陈会明等[64]在超声辅助条件下,用甲醇提取化妆品中的6种酞酸酯,包括邻苯二甲酸二甲酯(DMP)、二乙酯(DEP)、二丁酯(DBP)、丁基苄基酯(BBP)、二(2-乙基己)酯(DEHP)和二正辛酯(DOP),HPLC法进行测定,待测物的回收率为85%~110%。武婷等[65]利用甲醇超声提取,并结合反相高效液相色谱(RP-HPLC)方法,同时测定了化妆品中的24种防腐剂,回收率为90.6%~97.8%。何乔桑等[66]采用超声辅助提取法,用甲醇提取化妆品中的紫外吸收剂,结合HPLC实现了化妆品中12种紫外吸收剂的同时检测。该方法操作简单,回收率为97.4%~107.5%,检出限为0.002~0.1 mg/L。Liu等[67]利用超声辅助法从化妆品中提取松脂酸(AA)和脱氢枞酸(DHAA),HPLC-MS检测,检出限为8.2~10.8 μg/L(AA)和19.4~24.3 μg/L(DHAA)。Ma等[68]采用超声辅助提取结合固相萃取的样品前处理方法,从化妆品中分离22种香豆素衍生品,并采用UPLC-MS/MS进行分析检测。Yang等[69]采用双频超声波辅助萃取法处理样品,结合HPLC法,同时测定了化妆品中的7种甾体激素,该方法的检出限为20~50 μg/L,加标回收率为86.0%~113.2%。Kuligowski等[70]利用超声辅助从化妆品中提取乙醇酸,采用在线液相色谱-傅立叶变换近红外光谱进行分析,检出限为0.034 mg/mL,回收率为99.6%~101%。
3.2微波辅助萃取
微波辅助萃取(Microwave-assisted extraction,MAE)利用电磁场的作用使固体或半固体物质中的某些有机物成分与基体有效分离,并能保持分析对象的原本化合物状态[71-72],在化妆品样品前处理中有着一定的应用。Shih等[73]利用微波辅助萃取从化妆品中提取出防晒剂,并用于液相色谱分析。该方法成功用于化妆品中Eusolex 2292、4360和63003类防晒剂的提取,检出限为2.0~4.0 μg/L。Salvador等[74]采用微波辅助萃取进行样品前处理,连续注射分光光度法检测口红中的氧苯酮,检出限为3.0 μg/mL。
4其他样品前处理技术
除了上述常用的样品前处理技术,近年来新发展的一些技术也开始用于化妆品样品前处理,如加速溶剂萃取、超声辅助雾化(乳化)微萃取和超临界流体萃取等。
4.1加速溶剂萃取
加速溶剂萃取(Accelerated solvent extraction,ASE)是指提高萃取过程的压力和温度,从而提升萃取速度和效率的一种萃取方法。由于整个操作处于封闭系统中,能够有效降低因溶剂挥发造成的环境污染,同时有机溶剂用量少,回收率高,是一种固体、半固体样品前处理技术。加速溶剂萃取法用于化妆品样品前处理时,一般用于样品中有机物的萃取,但ASE的仪器设备成本较高,限制了该技术的应用,因此ASE用于化妆品样品前处理的文献报道并不多。Lamas等[75]建立了固相分散加压液相萃取(PLE)结合GC-MS检测化妆品中26种疑似香味过敏原的方法。该方法展现出良好的线性关系(r>0.996)和精密度(RSD≤10%),检测范围为0.01~2.0 μg/g,远小于欧洲化妆品法规限制的最低标准。
4.2超声辅助雾化(乳化)微萃取
超声辅助雾化萃取(Ultrasonic nebulization extraction,UNE)是在超声辅助萃取基础上建立的一种新型萃取技术,相比于传统的超声辅助萃取,具有更高的超声波频率,更高的提取效率以及节省溶剂等优点。Wei等[56]采用超声辅助雾化联合分散液液微萃取的样品前处理方法,用GC法成功实现了化妆品中6种对羟基苯甲酸酯类化合物的同时检测,检出限为2.0~9.5 μg/g,回收率为81.9%~108.7%。
超声辅助乳化微萃取(Ultrasound-assisted emulsification microextraction,UAEM)利用超声波使水溶液中微量有机萃取溶剂发生均匀乳化,并迅速达到传质平衡,具有有机溶剂消耗少、富集倍率高等优点。Kamarei等[76]利用超声辅助乳化微萃取法富集化妆品和水样中的邻苯二甲酸酯,结合HPLC检测,该法检出限为0.005~0.01 μg/L。Lavilla等[77]采用超声辅助乳化微萃取联合UV-Vis作为一种新型检测手段,用于以水为基底的化妆品中(如洗发液、沐浴露和乳液等)甲醛的分析检测,该法检出限为0.02 μg/g,与欧洲官方的检测方法相比,在灵敏度和取样微型化上有很大改善。
4.3超临界流体萃取
超临界流体萃取(Supercritical fluid extraction,SFE)是利用压力和温度对超临界流体溶解能力的影响而进行的萃取,相比传统方法具有取样体积小、无有害溶剂的优点,消除了有机溶剂对人体和环境的危害。目前,CO2是常用的超临界流体,通过优化温度、压力等实验条件,可用于固态、液态和半固态等各种形态的化妆品(如防晒霜、睫毛膏、口红和爽肤水等)的样品前处理,分析物以有机物为主,包括防腐剂、防晒剂和抗氧化剂等。
Scalia等[78-81]最先采用SFE为前处理方法,分别萃取肥皂、唇膏等固态化妆品中的对羟基苯甲酸酯、抑菌剂(三氯生)、防晒剂和呫吨染料,联用HPLC进行分析,回收率满意,与传统液-液萃取法相比具有更好的精密度和分析速度。Salvador等[82]首次采用SFE萃取口红中的水杨酸三甲环己酯,结合HPLC检测,检出限为4 μg/mL。Lee等[83]建立了SFE前处理结合LC-MS的方法,同时测定了化妆品中的防腐剂和抗氧化物。样品经超临界流体萃取后采用反相C18柱分离,该方法的线性范围为10~20 000 ng/g,检出限为4.7~142 ng/g。Wang等[84]利用SFE进行前处理,采用毛细管电泳法(CZE)和HPLC检测防晒霜中的苯甲酮,平均回收率为92%。
5结论与展望
随着人类生活水平的不断提高,各种各样的化妆类产品相继产出,化妆品的安全性也受到了人们的广泛关注。消费者需求的不断增长使化妆品趋向多功能化,成分也更加复杂,给化妆品样品的分析检测带来了巨大挑战。复杂的基体干扰严重影响了对目标分析物的选择性和检测灵敏度,因此,采取合适的样品前处理技术排除干扰组分,富集待测组分显得尤为重要。传统的样品前处理方法如液-液萃取法,需消耗大量的有机溶剂,造成严重的环境污染,且萃取效率较低,选择性不够好。近几年新发展并得到广泛应用的固相萃取、固相微萃取和液相微萃取技术,不需或只需少量溶剂,操作简便,萃取效率高,灵敏度和选择性也大大提高。然而市售的固相萃取柱通常对单一物质的选择性较差,发展对目标物具有高选择性的固相萃取剂(如分子印迹聚合物)已成为重要的研究内容,但目前有关于分子印迹用于化妆品样品前处理的报道较少。固相微萃取和液相微萃取法虽然具有集采样、萃取、富集于一体和易于实现自动化的优点,但涂层的选择和制备是难点,且化妆品基体复杂,干扰较多,涂层的重现性和稳定性不佳。超临界流体萃取和加速溶剂萃取等新发展的样品前处理技术,相比传统的溶剂萃取,大大提高了萃取效率,但较高的仪器成本和维修费用限制了这些技术在化妆品样品前处理中的大范围应用。因此,研究建立新型更环保、更稳定和更有效的前处理方法仍是化妆品样品前处理的重要研究内容。
致谢:感谢广东省疾病预防控制中心钟志雄高级工程师在文献检索方面的帮助。
参考文献:
[1]Bocca B,Pino A,Alimonti A,Forte G.Regul.Toxicol.Pharm.,2014,68(3):447-467.
[2]Koniecki D,Wang R,Moody R P,Zhu J P.Environ.Res.,2011,111(3):329-336.
[3]Nohynek G J,Antignac E,Re T,Toutain H.Toxicol.Appl.Pharm.,2010,243(2):239-259.
[4]Wang Y,Ma Q,Bai H,Wang C,Ding L,Meng X S,Chen Y X.J.Instrum.Anal.(王烨,马强,白桦,王超,丁岚,孟宪双,陈云霞.分析测试学报),2012,31(10):1288-1293.
[5]Chen D W,Jin X L.Chin.J.Anal.Lab.(陈德文,金训伦.分析试验室),2010,29(5):238-242.
[6]Huang R,Ye J,Fu X H.ChinaSurfactantDeterg.Cosmet.(黄荣,叶峻,傅小红.日用化学工业),2014,44(1):39-44.
[7]Pellegrini M,Marchei E,Pacifici R,Rotolo M C,Pichini S.J.Pharm.Biomed.,2011,55(4):842-847.
[8]Beneito-Cambra M,Herrero J M,Ramis-Ramos G.Anal.Methods,2013,5(2):341-354.
[10]Cabaleiro N,De la Calle I,Bendicho C,Lavilla I.TrACTrendsAnal.Chem.,2014,57:34-46.
[11]Cabaleiro N,De la Calle L,Bendicho C,Lavilla L.Anal.Methods,2013,5:323-340.
[12]Liu Y H,Li T,Wang P,Li J,Wu D N.J.Environ.Health(柳玉红,李婷,王萍,李洁,吴大南.环境与健康杂志),2013,30(5):442-444.
[13]Xu F F,Liu Y L,Lou W B,Xu Y Y.Chin.J.Anal.Lab.(许菲菲,刘亚丽,楼文斌,徐艳艳.分析试验室),2010,29(10):401-402.
[14]Al-Saleh I,Al-Enazi S,Shinwari N.Regul.Toxicol.Pharm.,2009,54(2):105-113.
[15]Zhang A P,Weng L F,Ge H M,Wang H W,Zhang W G.Chem.Anal.Meterage(张爱平,翁利丰,葛红梅,王红卫,张文国.化学分析计量),2013,22(4):33-36.
[16]Zhang L,Zhong Z Q,Qiao G H,Deng A F.J.FoodSafetyQuality(张遴,钟战强,乔冠华,邓阿粉.食品安全质量检测学报),2015,6(2):699-703.
[17]Volpe M G,Nazzaro M,Coppola R,Rapuano F,Aquino R P.Microchem.J.,2012,101:65-69.
[18]Li W,Rui C,Tu H Y,Zhao K,Wang X,Zhou M,Wang N.Chin.J.Anal.Lab.(李玮,芮昶,屠海云,赵凯,王啸,周敏,王娜.分析试验室),2011,(12):85-89.
[19]Li H Y,Xi S F,Tan J H,Wang J C,Xiong X T,Zhao T T,Wu C S,Guo C H.J.Instrum.Anal.(李慧勇,席绍峰,谭建华,王继才,熊小婷,赵田甜,吴楚森,郭长虹.分析测试学报),2014,33(4):416-421.
[20]Zhong Z X,Li G K,Zhu B H,Luo Z B,Wu X M.Chin.J.Chromatogr.(钟志雄,李攻科,朱炳辉,罗志彬,吴西梅.色谱),2010,28(7):702-707.
[21]Zhao S,Wu D N,Wang P.Chin.J.Chromatogr.(赵珊,吴大南,王鹏.色谱),2004,22(3):267-269.
[22]Li M,Ling X F,Zheng H G,Guo Y.ChinaSurfactantDeterg.Cosmet.(李铭,凌小芳,郑洪国,郭烨.日用化学工业),2015,45(4):233-236.
[23]Wu Y W,Jiang Y Y,Liu J F,Xiong K.Electrophoresis,2008,29(4):819-826.
[24]Soruraddin M H,Heydari R,Puladvand M,Zahedi M M.Int.J.Anal.Chem.,2011,2011:1-8.
[25]Liu C,Wang J,Yang Y L.Anal.Methods,2014,6(15):6038-6043.
[26]Li L,Wang H B,Li R Y.ChinaSurfactantDeterg.Cosmet.(立林,王海波,李仁勇.日用化学工业),2014,44(2):108-111.
[27]Liu J,Ji X N,Zuo Y,Qu H,Qiu X.J.Mol.Sci.(刘晶,纪晓娜,左妍,曲红,邱雪.分子科学学报),2014,30(3):257-259.
[28]Zhu R,Zhao W,Zhai M,Wei F,Cai Z,Sheng N,Hu Q.Anal.Chim.Acta,2010,658(2):209-216.
[29]Alqadami A,Abdalla M,Alothman Z,Omer K.Int.J.Environ.Res.PublicHealth,2013,10(1):361-374.
[30]Sid K H,Rafiej J,Bani F,Khanchi A R,Hoveidi H.Int.J.Environ.Res.,2010,4(2):289-296.
[31]Márquez-Sillero I,Aguilera-Herrador E,Cárdenas S,Valcárcel M.J.Chromatogr.A,2010,1217(1):1-6.
[32]Ghassempour A,Abbaci M,Talebpour Z,Spengler B,Römpp A.J.Chromatogr.A,2008,1185(1):43-48.
[33]Liu M,Li X Y,Li J J,Su X M,Wu Z Y,Li P F,Lei F H,Tan X C,Shi Z W.Anal.Bioanal.Chem.,2015,407(13):3875-3880.
[34]Liu S Y,Huang X H,Wang X F,Jin Q,Zhu G N.J.Sep.Sci.,2014,37(9/10):1134-1140.
[35]Zhou W,Wang P G,Krynitsky A J,Rader J I.J.Chromatogr.A,2011,1218(44):7956-7963.
[36]Rocío-Bautista P,Martínez-Benito C,Pino V,Pasán J,Ayala J H,Ruiz-Pérez C,Afonso A M.Talanta,2015,139:13-20.
[37]Li N,Zhu Q,Yang Y,Huang J L,Dang X P,Chen H X.Talanta,2015,132(15):713-718.
[38]Ara K M,Pandidan S,Aliakbari A,Raofie F,Amini M M.J.Sep.Sci.,2015,(38):1213-1224.
[39]Zhai Y J,Li N,Lei L,Yang X,Zhang H Z.Anal.Methods,2014,6(23):9435-9445.
[40]Joo K M,Shin M S,Jung J H,Kim B M,Lee J W,Jeong H,Lim K M.Talanta,2015,137:109-119.
[41]Li H F,Lin J M.ExperimentalTechnologyandManagement(李海芳,林金明.实验技术与管理),2011,28(11):273-285.
[42]Tsai T F,Lee M R.Chromatographia,2008,67(5/6):425-431.
[43]Fei T,Li H F,Ding M Y,Lin J M.J.Sep.Sci.,2011,34(13):1599-1606.
[44]Wang T E,Guo M,Song W,Zhang Y D,Du X Z.Anal.Methods,2015,7(8):3385-3394.
[45]Melo L P,Queiroz M E.J.Sep.Sci.,2010,33(12):1849-1855.
[46]Nuhu A A,Basheer C,Saad B.J.Chromatogr.B,2011,879(17/18):1180-1188.
[47]Rima Z,Edita A,Vida V.Chemija,2007,18(3):25-29.
[48]Cabaleiro N,De la Calle I,Bendicho C,Lavilla I.Anal.Chim.Acta,2012,733(6):28-33.
[49]Moradi M,Yamini Y.J.Chromatogr.A,2012,1229(16):30-37.
[50]Farajzadeh M A,Djozan D,Bakhtiyari R F.Talanta,2010,81(4/5):1360-1367.
[51]Feng C H,Jiang S R.Microchim.Acta,2012,177(1/2):167-175.
[52]Zhou C H,Tong S S,Chang Y X,Jia Q,Zhou W H.Electrophoresis,2012,33(8):1331-1338.
[53]Jia X Y,Han Y,Wei C,Duan T C,Chen H T.J.Anal.At.Spectrom.,2011,26(7):1380-1386.
[54]Guo J B,Wu H,Du L M,Fu Y L.Anal.Methods,2013,5(16):4021-4026.
[55]Xue Y,Chen N,Luo C,Wang X X,Sun C.Anal.Methods,2013,5(9):2391-2397.
[56]Wei H,Yang J,Zhang H,Shi Y.J.Sep.Sci.,2014,37(17):2349-2356.
[58]Farajzadeh M A,Marzi Khosrowshahi E,Khoshmaram L.J.Iran.Chem.Soc.,2015,12(6):1061-1069.
[59]Kang M Q,Sun S,Li N,Zhang D H,Chen M G,Zhang H Q.J.Sep.Sci.,2012,35(16):2032-2039.
[61]Ranjbari E,Hadjmohammadi M R.Talanta,2015,139(1):216-225.
[62]Msagati T A,Barri T,Larsson N,Jonsson J A.Int.J.Cosmet.Sci.,2008,30(4):297-307.
[63]Esrafili A,Yamini Y,Ghambarian M,Moradi M.Chromatographia,2014,77(3/4):317-327.
[64]Chen H M,Wang C,Wang X.J.Instrum.Anal.(陈会明,王超,王星.分析测试学报),2004,23(4):61-64.
[65]Wu T,Wang C,Wang X,Ma Q,Zhang F,Liu L.Chin.J.Anal.Chem.(武婷,王超,王星,马强,张帆,刘柳.分析化学),2007,35(10):1439-1443.
[66]He Q S,Xu N,Li J,Liao S F.Chin.J.Chromatogr.(何乔桑,徐娜,李晶,廖上富.色谱),2011,29(8):762-767.
[67]Liu J,Liu M,Li X,Lu X,Chen G,Sun Z,Li G,Zhao X,Zhang S,Song C,Wang H,Suo Y R,You J M.J.Chromatogr.A,2014,1371(5):20-29.
[68]Ma Q,Xi H W,Ma H J,Meng X S,Wang Z M,Bai H,Li W T,Wang C.Chromatographia,2015,78(3/4):241-249.
[69]Yang D H,Lin W M,Dai X L,Wang B.FlavourFragranceCosmetics(杨德辉,林蔚梅,戴学良,王兵.香料香精化妆品),2015,(1):45-47.
[70]Kuligowski J,Breivogel A,Quintás G,Garrigues S,de la Guardia M.Anal.Bioanal.Chem.,2008,392(7/8):1383-1389.
[71]Fan Y C,Zhu Y.Chin.J.Chromatogr.(范云场,朱岩.色谱),2007,25(5):633-640.
[72]Liu C J.GuangzhouChem.Ind.(刘春娟.广州化工),2008,35(3):53-55.
[73]Shih Y,Cheng F C.J.Chromatogr.A,2000,876(1):243-246.
[74]Salvador A,Chisvert A,Camarasa A,Pascual-Martí M C,March J G.Analyst,2001,126(8):1462-1465.
[75]Lamas J P,Sanchez-Prado L,Garcia-Jares C,Lores M,Llompart M.J.Chromatogr.A,2010,1217(52):8087-8094.
[76]Kamarei F,Ebrahimzadeh H,Yamini Y.Microchem.J.,2011,99(1):26-33.
[77]Lavilla I,Cabaleiro N,Pena F,De la Calle I,Bendicho C.Anal.Chim.Acta,2010,674(1):59-63.
[78]Scalia S,Games D E.Analyst,1992,117(5):839-841.
[79]Santo Scalia M G.J.Soc.Cosmet.Chem.,1994,45:35-42.
[80]Scalia S.J.Chromatogr.A,2000,870(1):199-205.
[81]Scalia S,Simeoni S.Chromatographia,2001,53(9/10):490-494.
[82]Salvador A,Gadea I,Chisvert A,Pascual-Martí M C.Chromatographia,2001,54(11/12):795-797.
[83]Lee M R,Lin C Y,Li Z G,Tsai T F.J.Chromatogr.A,2006,1120(1):244-251.
[84]Wang S P,Lee W.J.Chromatogr.A,2003,987(1):269-275.
Advance on Pretreatment Methods for Cosmetic Samples Analysis
ZHANG Yan-shu,LIN Zhen-hua,HU Yu-ling,LI Gong-ke*
(School of Chemistry and Chemical Engineering,Sun Yat-sen University,Guangzhou510275,China)
Abstract:Cosmetic has been one of the consuming goods which is closely related to people’s daily life.Thus,it is of great significance for the analysis and detection of the banned or restricted substances in cosmetic.Due to the complex matrix and serious interferences,it is difficult to realize the direct detection of target analytes in cosmetic.Therefore,sample pretreatment techniques are required for the separation and enrichment of the target analytes.In this paper,some sample pretreatment methods for cosmetic samples including liquid-liquid extraction,solid phase extraction,solid phase microextraction,liquid phase microextraction,microwave-assisted extraction and ultrasonic-assisted extraction,etc.are reviewed.Also,the future trends of pretreatment of cosmetic samples are prospected.
Key words:cosmetic;sample pretreatment;review;research progress
中图分类号:O658.2;G353.11
文献标识码:A
文章编号:1004-4957(2016)02-0127-10
doi:10.3969/j.issn.1004-4957.2016.02.002
*通讯作者:李攻科,博士,教授,研究方向:复杂样品分离分析、光谱与色谱分析,Tel:020-84110922,E-mail:cesgkl@mail.sysu.edu.cn
基金项目:国家自然科学基金项目(21107008,91232703,21475153);高等学校博士学科点专项项目(20120171110001);广东省自然科学基金项目(S2013010012091,2015A030311020)
收稿日期:2015-08-27;修回日期:2015-09-27
