铁粉和氧化铜与足量稀硫酸反应的实验探究
2017-07-13刘晓愚丁伟宗华
刘晓愚+丁伟+宗华
摘要:采用定性和定量相结合的方法,对铁粉和氧化铜与足量稀硫酸反应进行了实验研究。探寻铁粉和氧化铜用量的差异及不同硫酸浓度对反应先后顺序的影响;根据酸碱理论、氧化还原标准电极电势以及化学动力学等角度进行分析,得出了实验结论及适宜的反应条件。旨在为初中化学教学提供相关的实验和理论依据。
关键词:铁粉;氧化铜;稀硫酸;竞争反应;实验探究
文章编号:1005–6629(2017)6–0076–03 中图分类号:G633.8 文献标识码:B
在初中教学中,往往需要判断铁粉和氧化铜与足量的稀硫酸反应后溶液中溶质的成分。学生对这个混合体系中反应先后顺序的认识不同,部分学生认为铁粉比氧化铜活泼,所以铁粉先和稀硫酸反应,当铁粉反应完后氧化铜再和稀硫酸反应;也有学生认为铁粉和氧化铜同时与稀硫酸发生反应,没有先后之分,因此得出的结论也各不相同。究竟在铁粉和氧化铜与稀硫酸的反应中有没有竞争关系?铁粉和氧化铜物质的量的差异及硫酸浓度的不同会不会导致结果不同?本文对于这些问题进行了实验研究。
1 实验探究
1.1 不同量铁粉和氧化铜与足量1mol/L稀硫酸反应
(1)实验药品:铁粉(上海光铧科技有限公司化学试剂分公司,分析纯)、氧化铜(上海凌峰化学试剂有限公司,化学纯)、98%浓硫酸(昆山晶科微电子材料有限公司,分析纯)
(2)实验仪器:电子天平、药匙、量筒(100mL,50mL,25mL,10mL)、胶头滴管、烧杯(100mL)
(3)实验方案及现象(见表1)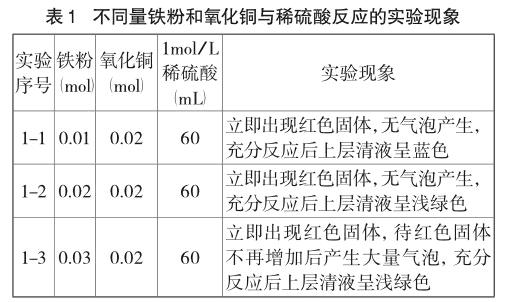
实验1-1中,铁粉与氧化铜物质的量之比为1:2,在混合粉末中加入足量的稀硫酸后,立即观察到红色固体产生,无气泡冒出,充分反应后的混合物取上层清液,溶液颜色为蓝色。这一实验事实说明氧化铜先与稀硫酸反应生成硫酸铜,然后铁粉与硫酸铜发生置换反应,生成硫酸亚铁和单质铜,由于氧化铜量多,因此硫酸铜没有被完全置换,上层清液呈浅蓝色。在此过程中,铁粉没有与稀硫酸发生化学反应就已被消耗完。
实验1-2中,铁粉与氧化铜等物质的量混合,加入足量稀硫酸,得到了与第一个实验几乎相同的现象。唯一的区别是,充分反应时铁粉恰好将生成的硫酸铜完全置换生成硫酸亚铁和单质铜,因此上层清液呈浅绿色。
实验1-3中,铁粉与氧化铜物质的量之比为2:1时,在混合粉末中加入足量稀硫酸后同样先生成红色固体,当红色固体不再增加后,铁粉再与稀硫酸反应生成氢气,以气泡形式逸出。气泡逸出速度不随硫酸消耗而减慢,认为铁、铜和稀硫酸形成了原电池,产生原电池效应。
(4)实验结论
从上述三个实验现象中可以得出,在硫酸足量且浓度为1mol/L的情况下,无论铁粉的物质的量是小于、等于还是大于氧化铜的物质的量,反应间均存在竞争关系,其先后顺序如下:氧化铜先与稀硫酸反应生成硫酸铜,铁粉再与硫酸铜发生置换反应,如果铁粉剩余再与稀硫酸反应生成氢气。
1.2 铁粉和氧化铜与不同量稀硫酸反应
(1)实验药品:同1.1(1)
(2)实验仪器:同1.1(2)
(3)实验方案与现象(见表2)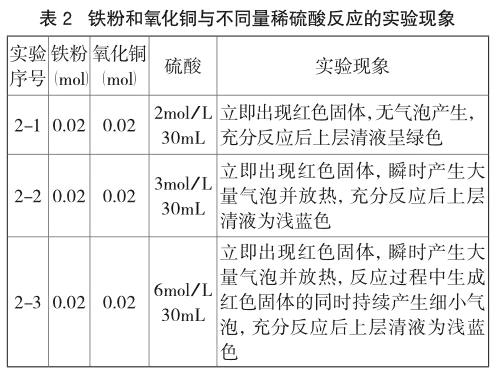
实验2-1中硫酸浓度为2mol/L,实验现象与1-2使用1mol/L硫酸无明显区别。
当实验2-2中硫酸浓度达到3mol/L时,红色固体和大量气泡同时产生,触摸到烧杯外壁明显发烫。硫酸浓度的增加使得铁粉与稀硫酸反应速率大大加快,因此铁粉和氧化铜粉末接触硫酸的瞬间同时发生反应。然而气泡很快不再产生,红色固体持续析出,说明铁置换硫酸铜的反应占据了上风。由于铁粉尚未将硫酸铜置换完全,反应结束后上层清液为浅蓝色。
实验2-3中,加入6mol/L的硫酸后立即生成红色固体,瞬时产生大量气泡并放出大量的热。反应的过程中,不断生成红色固体并持续冒出细小气泡,反应结束后上层清液为浅蓝色。该实验现象表明,硫酸浓度增大到一定程度后,动力学因素起决定作用,三个反应同时发生。
(4)实验结论
通过以上三个实验可以发现,当铁粉和氧化铜粉末物质的量相等时,硫酸浓度的增加会加快铁与硫酸的反应速率:当硫酸浓度为3mol/L时,铁粉同时与硫酸铜和硫酸发生反应,但大量气泡瞬时逸出后就不再产生,与此同时,单质铜在不断地析出,说明瞬时过后铁粉已转为和硫酸铜反应。当硫酸浓度为6mol/L时,氧化铜和硫酸、铁粉和硫酸、铁粉和硫酸铜的反应同时发生,直至铁粉耗尽。而硫酸浓度较小(2mol/L)时无气泡产生,说明对铁和硫酸反应速率无影响。
2 理论分析
根据Lewis酸碱理论和HSAB理论,硬酸与硬碱优先结合,因此氧化铜最先与稀硫酸反应生成硫酸铜和水。而铁与硫酸铜和铁与稀硫酸的反应属于氧化还原反应,查标准电极电位表可知:

对于实验2-2和2-3现象和电动势计算不符的情况,从化学反应动力学角度能够得到合理的解释。铁和稀硫酸的反应属于基元反应,反应速率ν=kcFecH2SO4。从速率方程可以得到,铁和稀硫酸的反应速率与硫酸浓度成正比。当硫酸的浓度不断增加,铁和硫酸的反应速率不断加快,硫酸浓度达到3mol/L时,铁和硫酸、铁和硫酸铜的反应同时发生,因此,观察到红色固體和大量气泡同时产生。但随着反应进行,硫酸浓度下降,反应速率降低,动力学因素对于铁与硫酸的反应影响减弱,以热力学因素为主,铁与稀硫酸的反应停止,直至硫酸铜耗尽,剩余的铁粉才继续与稀硫酸反应。当硫酸浓度为6mol/L时,铁和硫酸、铁和硫酸铜同时发生反应,反应过程中硫酸浓度降低不显著,因此观察到生成红色固体的同时有细密的气泡产生。
3 实验结论
(1)在铁粉和氧化铜的混合物中加入足量1mol/L稀硫酸,当铁粉的物质的量小于、等于或大于氧化铜的物质的量时,反应顺序均为氧化铜先与硫酸反应生成硫酸铜,铁粉将硫酸铜中的铜置换出来,如果铁粉剩余,再与稀硫酸反应生成氢气。
(2)当铁粉和氧化铜等物质的量时,硫酸的浓度会对铁和稀硫酸的反应速率造成一定影响,当硫酸浓度大于2mol/L时,会加快铁粉与稀硫酸的反应速率,导致铁粉同时与硫酸铜和硫酸反应。为避免铁粉同时与硫酸反应,建议反应使用的稀硫酸浓度不超过2mol/L。
本研究采取定性与定量相结合的实验方式,研究了铁粉和氧化铜与足量稀硫酸反应间的竞争关系,通过探究和分析得到了各反应之间的先后顺序,并给出了实验适宜的稀硫酸浓度范围。该体系中反应先后顺序的确定,解决了困扰多年的问题,旨在给初中教师的教学提供相关的实验和理论依据[1,2],并对碱性氧化物和金属同时与酸反应这一类问题的研究,提供一定的借鉴意义[3,4]。
参考文献:
[1]朱传征,高剑南.现代化学基础[M].上海:华东师范大学出版社,1998:199.
[2]华彤文,王颖霞,卞江,陈景祖.普通化学原理(第四版)[M].北京:北京大学出版社,2014:473.
[3]刘智成.现代酸碱理论在有机化学中的应用[J].化学教育,2010,(6):9~12.
[4]刘连亮.高中化学中“竞争反应”的归类解析[J].化学教学,2012,(12):67~68.
