碳酸钠、碳酸氢钠与稀盐酸反应的实验设计
2021-08-11王荣明
王荣明
摘要: 人教版高中化学必修第一册中第56页,只是简单的说明了碳酸钠、碳酸氢钠能与稀盐酸发生反应。根据课程标准的要求,需要学生自己探究反应的本质,并且历年高考中对这部分知识是“理解”, 要求较高,此类考题出现的频率也很高。我们在教学过程中发现学生对这部分内容理解并应用比较困难,针对这种上课被动接受而无法解题的现象,我们设计了一组实验,帮助学生探究碳酸钠、碳酸氢钠与稀盐酸反应的本质,并在上课过程中加以应用,取得了很好的效果。
关键词:碳酸钠 碳酸氢钠 稀盐酸 实验设计
一、问题的提出
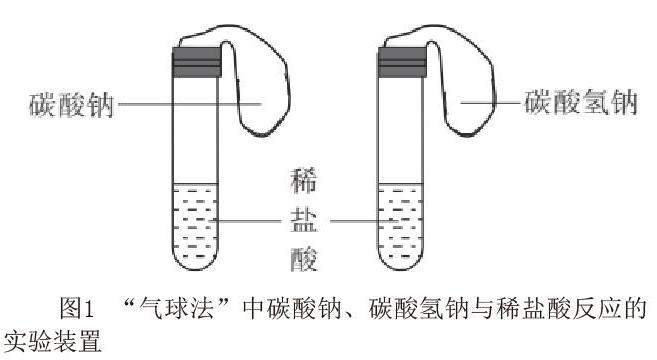
碳酸钠、碳酸氢钠分别与稀盐酸反应时,碳酸氢钠与稀盐酸的反应一步到位,而碳酸钠与稀盐酸的反应则是分步进行的。人教版高中化学必修第一册中第56页,只是简单的说明了碳酸钠、碳酸氢钠能与稀盐酸发生反应,并未对反应的本质进行探究。现有的教学设计中多把碳酸钠和碳酸氢钠与稀盐酸的反应设计成学生分组实验或教师演示实验模式。无论采用哪种教学设计,“气球法”仍然是设计中的主要方法[1-2](图1)。笔者通过多次实验发现,此设计中存在以下不足:一是气球简单套在试管口,气密性差,气球胀大的同时容易脱落;二是将碳酸钠、碳酸氢钠倒进试管的过程中,部分粉末粘附在气球里、试管壁上,从而导致实验效果不好甚至失败。针对以上实验存在的不足,笔者设计了一个实验装置简单、操作方便、实验现象明显、实验成功率高的实验。
二、实验设计
1.实验原理
碳酸钠与稀盐酸的反应是分步进行的(Na2CO3 + HCl == NaHCO3 + NaCl; NaHCO3 + HCl == NaCl + CO2↑+ H2O);而碳酸氢钠与稀盐酸的反应一步到位(NaHCO3 + HCl == NaCl + CO2↑+ H2O)。在相同的条件下,碳酸氢钠与稀盐酸反应生成CO2的速率比碳酸钠要快。
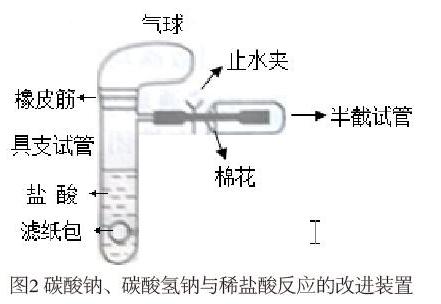
2.实验器材及装置图
具支试管,半截试管,乳胶管,止水夹, 气球,橡皮筋,滤纸;碳酸钠固体,碳酸氢钠固体,0.5 mol/L HCl(aq),澄清石灰水。
3.实验操作步骤及现象
首先,分别在两支具支试管内装入 15 毫升 0.5mol╱L 的盐酸,用滤纸分别包好碳酸钠和碳酸氢钠,并把滤纸包放进气球里;将气球套在试管口上并用橡胶圈扎紧。其次,在具支试管的支管处紧紧套上乳胶管,并用止水夹夹紧乳胶管的出口;取半截试管用澄清石灰水润湿内壁待用。再次,将气球内的滤纸包倒入具支试管里,觀察比较气球胀大的速度,以及反应停止后气球的大小。最后,将半截试管套住乳胶管,乳胶管口离半截试管的底端 1 厘米左右,用棉花塞住试管口,慢慢松开止水夹,注意控制出气速度,可观察到气球慢慢干瘪,试管变模糊即澄清石灰水变浑浊。
4.实验结论
通过以上实验,使大多数学生都能理解碳酸钠与盐酸反应的本质,并能在此类题目中加以应用。当把不足的盐酸加到碳酸钠溶液中,首先生成碳酸氢钠而没有产生二氧化碳气体,随着盐酸的继续加入,碳酸氢钠才反应产生了二氧化碳气体,即Na2CO3+HCl= NaHCO3+NaCl, NaHCO3+HCl= NaCl+H2O+CO2↑,并且等物质的量的碳酸钠和碳酸氢钠分别与足量的盐酸反应时所得二氧化碳气体的量相等。
三.实验设计优点
该实验设计既形象又直观,实验材料容易得到,实验装置简单、仪器和药品的用量少、操作简单方便,用滤纸包住药品,避免药品少量粘附在气球内和试管内壁上而导致实验失败,且气泡溢出的速度快慢明显。盐酸的浓度控制在 0.5 mol╱L 左右时反应现象最佳,反应的剧烈程度比较好区分。整个装置气密性好,充气后气球的大小明显,同时,检验了反应后的生成物二氧化碳气体。
四、实验设计效果评价
碳酸钠、碳酸氢钠与稀盐酸反应的实验设计既可形象直观地比较反应速率的快慢,也可深层次地探究反应的本质,充分体现了化学是一门以实验为基础的科学。在实验中求真知,把学生平时解题中的实际情况与实验结合起来,针对性很强。通过实验让学生感知反应的本质,不断培养学生的探索精神,不断调动学生的求知欲,从而达到自主学习的目的。即便以后考试中遇到类似的题目,学生也就能迎刃而解了。
