福建省龙岩市禽致病性大肠杆菌的血清型、毒力因子及耐药研究
2016-03-03杨立军韩先干尹会方罗燕秋左佳坤吕小龙吴小卡王少辉李金贵于圣青
杨立军,韩先干,尹会方,罗燕秋,左佳坤,徐 达,吕小龙,吴小卡,周 键,王少辉,李金贵,于圣青
(1.扬州大学兽医学院,扬州 225009;2.中国农业科学院上海兽医研究所,上海 200241;3.龙岩学院,龙岩 364012)
·研究论文·
福建省龙岩市禽致病性大肠杆菌的血清型、毒力因子及耐药研究
杨立军1,2,韩先干2,尹会方3,罗燕秋2,左佳坤2,徐 达2,吕小龙2,吴小卡2,周 键2,王少辉2,李金贵1,于圣青2
(1.扬州大学兽医学院,扬州 225009;2.中国农业科学院上海兽医研究所,上海 200241;3.龙岩学院,龙岩 364012)
本研究对2015年分离自福建省龙岩市的139株禽致病性大肠杆菌(Avian pathogenic Escherichia coli, APEC)的血清型、毒力因子分布及耐药性等进行检测,并对血清型与耐药性、毒力因子分布和耐药性之间的相关性进行分析,以期为APEC的防控提供参考。对139株分离菌株的血清型检测结果表明,O1血清型(11株)、O2血清型(14株)和O78血清型(14株)占全部菌株的28%;对分离菌株毒力基因检测结果表明,4%和7.1%的菌株检测到papC基因和vat基因,14.3%和19.3%的菌株检测到aatA基因和cva/ cvi基因。而iucD(82%)、tsh(59%)、iss(55%)和irp2(44.6%)基因在分离菌株中具有较高的检出率;药敏实验结果表明,分离株存在多重耐药性,99 %以上分离菌株对红霉素、克林霉素和利福平耐受,86%的分离菌株对10种以上抗生素耐受,57.3%的菌株对13种药物都耐受;对血清型、耐药性与致病性之间的分析结果表明,分离的O1、O2和O78血清型的菌株,其中50%的菌株是含有5种以上毒力基因的强毒株,且在分离的含有5种以上毒力基因的强毒株中,50%的菌株对13种抗生素耐受,90%的菌株对10种以上药物耐受。
禽致病性大肠杆菌;毒力;耐药性;血清型
禽大肠杆菌病是由禽致病性大肠杆菌(Avian pathogenic Escherichia coli,APEC)感染所引起的禽类不同类型疾病的总称,可引起禽类的败血症、气囊炎、卵黄性腹膜炎等,是2~12 周龄的鸡和火鸡的一种常见传染病[1]。近年来,随着集约化养禽业的发展,该病不但严重制约养禽业的健康发展,同时也对食品安全构成威胁,因此开展对 APEC 的防控研究,具有重要的经济及社会意义。
研究表明,APEC的血清型日益复杂,在种类增加的基础上,与地区、宿主等亦有很大相关性,我国已经发现有50余种对禽致病的大肠杆菌血清型。研究表明,不同地区来源的分离菌株,其优势血清型亦有差异。例如,南通市分离株优势血清型为O78、O24、O11,盐城市分离株为O78、O87,扬州市分离株为O93、O24、O88,常州市分离株优势血清型为O78、O109,徐州市分离株为O78、O1、O86,泰州市分离株为O86、O9。国外研究表明,APEC的主要流行血清型是O1、O2和O78[12]。
细菌的毒力因子在致病菌的致病过程中发挥重要作用,APEC的主要毒力因子包括:粘附素(adhesins)、铁螯合蛋白系统(aerobactin iron-sequestering system)、耶尔森杆菌素(yersiniabactin)、血清增强存活因子(increase serum survival)、外膜蛋白(outer membrane proteins)、大肠杆菌素(colicin production)、温度敏感血凝素(t e m p e r a t u r e-s e n s i t i v e hemagglutinin)、溶血素(hemolysin E)、空泡自动转运毒素(vat)和志贺毒素(shigatoxin)等[2]。在APEC分离株中,其毒力因子的分布差异导致其对宿主的致病性存在差异。
2015年,本实验室在福建省龙岩市部分养殖场分离鉴定APEC 139株,并对分离菌株的血清型、毒力基因的组成和耐药性等进行了研究,为APEC致病机制的研究以及对该地区禽大肠杆菌病的防控提供参考。
1 材料与方法
1.1 试剂和菌种 APEC菌株为本实验室在2015年在福建省龙岩市的家禽养殖企业分离获得;DNA Marker、2×ES Taq Master Mix购自北京康为世纪公司;引物合成由英潍捷基(上海)贸易有限公司完成;药敏纸片购自杭州天和公司;麦康凯培养基购自青岛高科园海博公司;大肠杆菌O1、O2和O78单因子血清购自中国兽医药品监察所。
1.2 APEC的分离鉴定 将分离自病禽的菌株,接种于麦康凯鉴别培养基中,挑取疑似菌株,参照文献[3]设计大肠杆菌鉴定引物(表1),对分离菌株进行PCR鉴定。PCR反应体系:PCR Master Mix 10 μL、上下游引物各1 μL、模板1μL、超纯水7μL。PCR反应条件:94℃ 预变性4 min; 94℃变性40 s,52℃退火40 s,72℃延伸1 min,共30个循环; 72℃延伸10 min。
1.3 APEC的O血清型鉴定 参照文献[3、12]中大肠杆菌血清型鉴定引物(表1),用PCR对分离菌株的O1、O2和O78血清型进行初步鉴定。对PCR鉴定为阳性结果的菌株,再进行玻片凝集试验验证。将分离的菌株接种于LB固体培养基中,培养过夜,用0.5%石炭酸生理盐水洗下培养物,制成菌悬液,121℃高压2 h,制备菌体抗原。分别取10 μL菌体抗原和大肠杆菌O抗原血清置于玻板上混匀。明显凝集者为阳性,同时以菌体抗原与0.5%石炭酸生理盐水混合物作对照[4]。
1.4 APEC毒力相关基因的检测 参照文献[3],设计8种毒力基因的检测引物(表1)。PCR反应体系和反应条件同上。

表1 APEC的血清型以及毒力基因鉴定引物Table 1 Primers used for the identif cation of virulence-associated genes of Avian pathogenic Escherichia coli
1.5 APEC的药物敏感性检测 参照美国临床和实验室标准化研究所(CLSI)制定的抗菌药物敏感性试验执行标准,选取14种抗菌药,分别为克林霉素、四环素、环丙沙星、壮观霉素、头孢曲松、红霉素、利福平、新霉素、阿奇霉素、复方新诺明、头孢拉定、氯霉素、氨苄西林和头孢噻吩进行试验。新鲜的被检细菌培养于LB琼脂平板上,将药敏纸片均匀贴于固体培养基表面,37℃培养过夜后,测量药敏片的抑菌圈直径。参照CLSI标准,判定被检细菌对每种药物的敏感性,分别为敏感(susceptible,S)、中敏(intermediate,I)或耐药(resistance,R)菌株[5]。
2 结果
2.1 APEC的分离、鉴定及血清型鉴定 根据临床症状和病理变化,结合麦康凯培养基的培养和PCR鉴定结果(图1),共分离禽大肠杆菌139株。
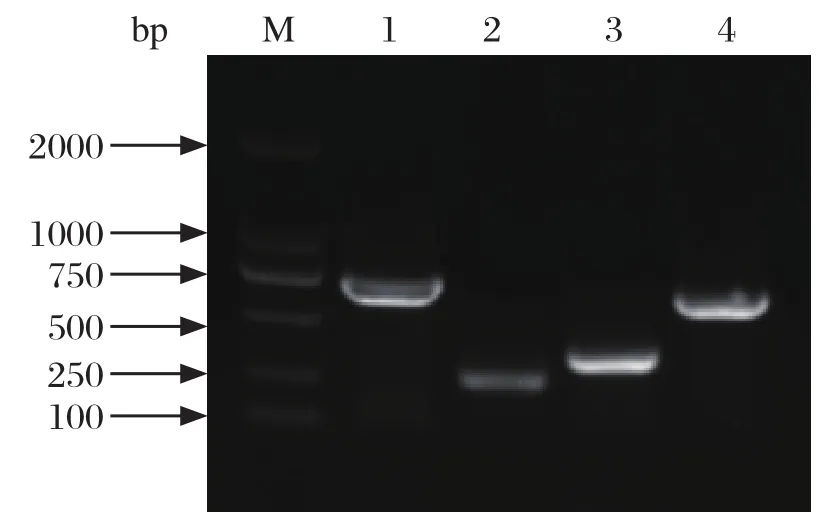
图1 APEC及其血清型的PCR鉴定Fig. 1 Identif cation of APEC and serotypes using PCR amplif cation
参照文献[3、12]的大肠杆菌血清型鉴定引物(表1),对分离菌株的O1、O2和O78血清型进行PCR初步鉴定。对PCR鉴定阳性结果的菌株,再分别用O1、O2和O78血清进行鉴定。结果表明(表2),139株APEC中共有O1血清型11株,O2血清型14株,O78血清型14株,占全部菌株的28%,其他血清型100株,占全部菌株的72%。

表2 139株禽致病性大肠杆菌的血清型分布Table 2 Serotype distributions of 139 strains of Avian pathogenic Escherichia coli
2.2 APEC毒力相关基因的检测 在不同的分离菌株中,分别扩增到了8种毒力基因(图2),对不同菌株中8种毒力基因的检测结果表明,iucD(14株,82%)、tsh(82株,58.6%)、iss(77株,55%)和irp2(62株,44.6%)有较高的分布率,其余毒力基因分布率均低于20%:cva/cvi(27株,19.3%)、aatA(20株,14.3%)、papc(6株,4.3%)和vat(6.7%)(图3)。iucD、tsh、iss和 irp2检出率大于50%,为重要的APEC毒力基因。对各菌株毒力基因分布统计显示,含有4个以上毒力基因的菌株有45株(32.4%),含有5个以上毒力基因的强毒菌株共有20株(14.4%),其中iss、iucD和tsh这3个毒力基因几乎在每个强毒菌株中都可以检测到,而irp2在强毒菌株的检出率高达95%。表明这4个基因是APEC的保守毒力基因,可能在APEC对宿主的致病过程中发挥重要作用(表3)。
2.4 APEC耐药性检测 分离菌株的耐药性检测结果表明,对红霉素、克林霉素耐受的有138株(99.3%),耐10种以上药物的菌株有125株(90.6%),其中对13种药物都耐受的菌株有65株(47.1%),表明分离菌株存在多重耐药性(表4)。分离菌株仅有37株对壮观霉素和头孢曲松敏感,对其他抗生素的耐药性都在90%以上。
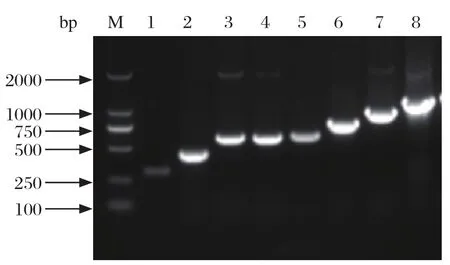
图2 8种毒力基因的PCR鉴定结果Fig. 2 PCR amplif cation of 8 virulence genes
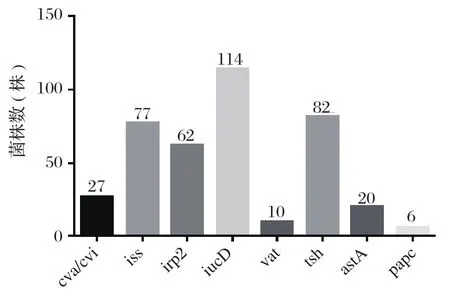
图3 8种毒力相关基因在139株禽致病性大肠杆菌的分布Fig. 3 Distribution of 8 virulence-associated genes in 139 strains of Avian pathogenic Escherichia coli

表3 8种毒力基因在强毒菌株(含5个以上毒力基因)中的分布Table 3 Distribution of 8 virulence-associated genes in virulent isolates

表4 139株禽致病性大肠杆菌的药敏试验Table 4 Drug sensitivity assay for 139 strains of Avian pathogenic Escherichia coli
2.5 APEC血清型、毒力和耐药性之间的关系 在20株含有5种以上毒力基因的强毒菌株中,有5株O1、3株O2和2株O78菌株,合计占强毒菌株的50%。在20株含有5种以上毒力基因的强毒菌株中,对13种药物都耐受的有10株(50%),耐10种以上药物的有19株(90%),表明强毒株存在广泛的耐药性。
3 讨论
本研究对福建省龙岩市分离大肠杆菌的血清型鉴定结果显示,O1、O2和O78只占分离菌株的28%,不是当地流行的优势血清型。本实验室在上海市、江苏省等地分离的大肠杆菌优势血清型则为O1、O2和O78,表明APEC的血清型分布具有地域差异[6,7]。但本次分离到的O1、O2和O78菌株中50%为强毒株,表明可能在O1、O2和O78血清型中,强毒株分布比例高。
对分离菌株的毒力基因检测结果表明:iucD(14株,82%)、tsh(82株,59%)、iss(77株,55.4%)和irp2(62株,44.6%)在分离菌株中具有较高的检出率,与本实验室在江苏省、安徽省等地分离的菌株的毒力基因检测结果相符[8]。
分离菌株耐药性检测结果表明,临床分离的APEC中57.3%的菌株能耐受13种抗生素,90.6%的菌株耐受10种以上抗生素。其中对利福平、红霉素、克林霉素、新霉素、头孢噻吩、四环素、头孢拉定、阿奇霉素、氯霉素的均耐药菌株占95%以上,表明目前APEC多重耐药性仍很严重,这与抗菌药的不合理使用以及大肠杆菌的血清型众多有关[9]。造成APEC存在广泛耐药性的原因可能是在外界高浓度的抗生素选择压力下,一些具有耐药特性的菌株或一些耐药能力更强的菌株能够生存下来,而这种耐药性可以在细菌间传播,因而导致细菌耐药及多重耐药现象的出现,从而导致以抗生素预防及治疗当地鸡场的大肠杆菌病效果不佳。
对血清型、耐药性与致病性之间的分析结果表明,强毒株存在多重耐药性,APEC的毒力与耐药性之间具有一定的相关性。对优势血清型菌株耐药情况进行统计分析,血清型与耐药性之间没有明显相关性,相同耐药性可出现于不同血清型的菌株中,同一血清型的菌株也会表现出不同的耐药性[10]。本研究通过对分离的APEC菌株的血清型、耐药性及毒力基因的研究,为针对分离地区APEC的流行态势,探究APEC可能的致病机理及防控工作提供参考。
[1] Ewers C, Janssen T, Wieler L H. Avian pathogenic Escherichia coli (APEC)[J]. Berl Munch Tierarztl Wochenschr, 2003, 116∶ 381-395.
[2] Janßen T, Schwarz C, Preikschat P, et al. Virulenceassociated genes in avian pathogenic Escherichia coli (APEC) isolated from internal organs of poultry having died from colibacillosis [J]. Int J Med Microbiol, 2001, 5(291)∶ 371-378.
[3] 韩先干, 白灏, 刘蕾, 等. 禽致病性大肠杆菌安徽分离株luxS和pfs基因的克隆、表达与细胞外合成AI-2活性检测[J].微生物学报, 2012, 52 (9)∶ 1167-1172.
[4] 白灏, 韩先干, 于圣青, 等. 禽致病性大肠杆菌江苏、安徽分离株的生物学特性分析[J]. 微生物学通报, 2013, 40(7)∶ 1315-1322.
[5] 陈文静, 韩先干, 于圣青, 等. 鸭致病性大肠杆菌的分离鉴定及其生物学特性分析[J]. 中国动物传染病学报, 2010, 18(2)∶ 34-40.
[6] 陆承平. 兽医微生物学 [M]. 4版. 北京∶ 中国农业出版社,2007∶ 99-107.
[7] Ewers C, Janssen T, Wieler L. Avian pathogenic Escherichia coli (APEC)[J]. Berl Munch Tierarztl Wochenschr, 2002, 116(9-10)∶ 381-395.
[8] Han Y, Han X, Yu S, et al. The waaL gene is involved in lipopolysaccharide synthesis and plays a role on the bacterial pathogenesis of avian pathogenic Escherichia coli[J]. Vet Microbiol, 2014, 172(3-4)∶ 486-491
[9] Skidmore B J, Morrison D, Chiller J M, et al. Immunologic properties of bacterial lipopolysaccharide (LPS). II. The unresponsiveness of C3H/HeJ Mouse spleen cells to LPS-induced mitogenesis is dependent on the method used to extract LPS[J]. J Exp Med, 1975, 142(6)∶ 1488-1508.
[10] 张宇曦, 韩先干, 左佳坤, 等. 禽致病性大肠杆菌脂多糖核心型分布与毒力基因的相关性分析[J]. 微生物学通报, 2015, 14(7)∶ 1315-1322.
[11] Dou X, Gong J, Han X, et al. Characterization of avian pathogenic Escherichia coli isolated in eastern China[J]. Gene, 2015, 576∶ 244-248.
[12] Wang S, Meng Q, Dai J, et al. Development of an allelespecific PCR assay for simultaneous sero-typing of avian pathogenic Escherichia coli predominant O1, O2, O18 and O78 strains[J]. PLoS One, 9(5)∶ e96904.
SEROTYPES, PATHOGENICITY AND ANTIBIOTIC RESISTANCE OF AVIAN PATHOGENIC ESCHERICHIA COLI STRAINS FROM LONGYAN CITY, FUJIAN PROVINCE
YANG Li-jun1, HAN Xian-gan2, YIN Hui-fan3, LUO Yan-qiu2, ZUO Jia-kun2, XU Da2, LV Xiao-long2, WU Xiao-ka2, ZHOU Jian2, WANG Shao-hui2, LI Jin-gui1, YU Sheng-qing2
(1. College of Veterinary Medicine, Yangzhou University, Yangzhou 225009, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 3. College of Life Science, Longyan University, Longyan 364012, China)
The aim of the study was to investigate the serotypes, virulence factors and drug resistance of avian pathogenic Escherichia coli (APEC) strains isolated from Longyan city, Fujian province. The serotypes of the APEC isolates were identif ed by agglutination withspecif c antisera. Virulence-associated genes were investigated by PCR amplif cation. Drug susceptibility was tested according to National Committee for Clinical Laboratory Stands (NCCLS). Agglutination with specif c antisera showed that serotypes O1, O2 and O78 were dominant, which accounted for 28% of these isolates. PCR amplif cation of the virulence-associated genes showed that iucD, tsh, iss and irp2 were amplif ed from more than 50% of these strains. Drug susceptibility test showed that 86% of the strains were resistant to more than 10 antibiotics. A half of the isolates containing f ve or more virulent genes belonged to O1, O2 and O78 serotypes. There was a good correlation between APEC virulence and drug resistance but no signif cant correlation between serotypes and drug resistance.
Avian pathogenic Escherichia coli; virulence; drug resistance; serotype
S852.612
A
1674-6422(2016)06-0024-06
2016-02-19
上海市科技兴农重点攻关项目[沪农科攻字(2015)第1-9号];国家自然科学基金(31370045、31372402、31572523);公益性行业(农业)科研专项(201303044)
杨立军,男,硕士研究生,预防兽医学专业
于圣青,E-mail:yus@shvri.ac.cn;李金贵,E-mail:jgli@yzu.edu.cn
