猪δ冠状病毒Nsp5的体外表达及其蛋白酶活性分析
2016-03-03肖文婕朱心宇彭贵青
张 欢,肖文婕,曾 哲,朱心宇,董 楠,彭贵青
(1. 华中农业大学动物医学院,武汉430070;2. 华中师范大学第一附属中学,武汉 430223)
·研究论文·
猪δ冠状病毒Nsp5的体外表达及其蛋白酶活性分析
张 欢1,肖文婕2,曾 哲1,朱心宇1,董 楠1,彭贵青1
(1. 华中农业大学动物医学院,武汉430070;2. 华中师范大学第一附属中学,武汉 430223)
猪δ冠状病毒(Porcine deltacoronavirus, PDCoV)是一种新发现的肠道冠状病毒,可引起仔猪的腹泻。冠状病毒编码的非结构蛋白Nsp5是一种3C样蛋白酶,在病毒多聚前体蛋白加工以及免疫调节中发挥重要作用。本研究以PDCoV CHN-HN-2014株为模板,通过RT-PCR扩增Nsp5基因并将其克隆到原核表达载体pET-28a(+)中,构建了重组表达质粒。将重组质粒转化到大肠杆菌BL21(DE3),经IPTG诱导后SDS-PAGE检测,结果表明Nsp5可在大肠杆菌中高效、可溶性表达。采用镍亲和层析对表达的Nsp5蛋白进行纯化,并通过荧光共振能量转移方法检测了其蛋白酶活性,结果表明纯化的Nsp5蛋白能够有效切割含有PDCoV Nsp5氨基端自切割位点的十二肽底物,证实体外表达的Nsp5重组蛋白具有良好的蛋白酶切割活性。猪δ冠状病毒Nsp5蛋白的克隆、表达及其蛋白酶活性检测,为深入研究该蛋白的功能奠定了基础。
猪δ冠状病毒;Nsp5;蛋白酶活性
冠状病毒(Coronavirus)是一类具有囊膜的单股正链R N A病毒,分为4个属:α冠状病毒属(Alphacoronavirus)、β冠状病毒属(B e t a c o r o n a v i r u s)、γ冠状病毒属(Gammacoronavirus)以及新确定的δ冠状病毒属(Deltacoronavirus)[1]。猪δ冠状病毒(Porcine deltacoronavirus, PDCoV)最早于2012年由香港的研究人员在鉴定哺乳动物与禽类的新冠状病毒时发现[2]。2014年美国多个州的猪场爆发猪δ冠状病毒感染,引起母猪和仔猪出现严重腹泻、呕吐、脱水,严重者甚至致死,给养猪业带来巨大经济损失[3,4]。随后,韩国、加拿大、泰国以及中国大陆也先后报道了猪δ冠状病毒的存在[5-8]。
冠状病毒编码多种蛋白酶,其中非结构蛋白Nsp5是一种与微RNA病毒3C蛋白酶类似的蛋白酶,称为3C样蛋白酶[9]。该蛋白酶具有切割活性,可以将多聚前体蛋白切割为成熟的非结构蛋白。除了具有切割活性外,还发现冠状病毒的Nsp5是一种干扰素的拮抗分子,在病毒的免疫调控中发挥重要作用[10]。目前,严重急性呼吸综合征冠状病毒(Severe acute respiratory syndrome coronavirus, SARSCoV)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV)等冠状病毒的Nsp5的蛋白酶切割活性已经被证实,并作为潜在的药物靶标受到广泛关注[11]。作为新发现的冠状病毒,PDCoV的Nsp5是否具有同样的蛋白酶切割活性尚不清楚。本研究将PDCoV的Nsp5在大肠杆菌中进行了高效表达,并对其蛋白酶切割活性进行了检测分析。
1 材料与方法
1.1 材料 猪肾上皮细胞(LLC-PK)购自国家实验细胞资源共享平台;PDCoV CHN-HN-2014株为本实验室从临床发病猪中分离[5];原核表达载体pET-28a(+)购自Novagen公司;感受态细胞E. coli DH5α、E. coli BL21(DE3)由本实验室保存;限制性内切酶Nco I、Sal I、高保真酶Prime STARTM、dNTPs、DNA Marker等均为大连宝生物公司(TakaRa)产品;T4 DNA连接酶、蛋白质Marker为Fermentas公司产品;DNA琼脂糖凝胶回收试剂盒、质粒小量提取试剂盒购自天根生化科技(北京)有限公司;琼脂糖、胰蛋白胨、酵母浸出物购自OXOID公司;Trizol试剂为Omega公司产品;反转录试剂盒(FastStart DNA Master SYBR Green I Mix reagent kit)购自罗氏公司(ROCHE);三羟甲基氨基甲烷(Tris base)、甘氨酸、十二烷基硫酸钠(SDS)、卡那霉素购自BIOSHARP公司。
1.2 引物的设计与合成 根据PDCoV CHN-HN-2014株的基因组序列(GenBank 登录号∶ KT336560),设计一对可扩增Nsp5 基因的特异性引物,并分别在引物上下游引入Nco I、Sal I酶切位点,引物由北京擎科新业生物技术有限公司合成。上游引物:5'-GCACCATGGCAGCAGGTATCAAAATCC TC-3',下游引物:5'-GCAGTCGACCTGCAATGA AATTGGAGCC-3',加粗倾斜部分为酶切位点。
1.3 Nsp5基因的扩增 取-80℃冰箱内保存的PDCoV CHN-HN-2014,以0.01MOI接种于长满单层的LLC-PK细胞,培养24 h后提取细胞内RNA,利用反转录试剂盒反转成cDNA。建立50 μL扩增体系:5×PrimeSTAR buffer(Mg2+plus)10 μL、dNTP Mixture(2.5 m mol/L each)4 μL、上下游引物各1 μL、模板cDNA 2 μL、PrimestarTMHS DNA polymerase 0.5 μL、ddH2O 31.5 μL。按照如下条件进行扩增:94℃预变性5 min;98℃ 变性10 s,56℃退火30 s,72℃延伸1 min。34个循环之后72℃延伸10 min。PCR产物于琼脂糖凝胶中电泳观察拍照并用凝胶DNA回收试剂盒进行回收。
1.4 重组表达质粒pET-28a-Nsp5的构建及鉴定 将回收的PCR产物与pET-28a(+)载体同时用Nco I、Sal I双酶切后进行胶回收,用T4 DNA连接酶于22℃温箱中过夜,将连接产物转化DH5α感受态细胞。挑取单个菌落至LB液体培养基中培养,提取质粒进行酶切鉴定。阳性克隆经DNA测序进一步证实,命名为pET-28a-Nsp5。
1.5 重组蛋白的表达及SDS-PAGE凝胶电泳分析 分别将pET-28a-Nsp5和空载体pET-28a(+) 转化到BL21 (DE3) 感受态细胞,挑取单个菌落于含有卡那霉素的LB液体培养基中培养过夜。按照1∶100的比例接种菌液到LB液体培养基中,37℃、160 r/min摇床振荡培养约2 h,加入终浓度为1 mmol/L的无菌IPTG诱导剂进行诱导。分别在诱导前和诱导后3、4、5、6 h取样1 mL,10 800×g 离心1 min,收集菌体,加入100 μL ddH2O 重悬菌体,再加入25 μL的5×SDS-PAGE上样缓冲液,沸水煮10 min,样品经12%的SDS-PAGE胶电泳分离并用考马斯亮蓝染色。
1.6 重组蛋白的大量表达与纯化 确定原核重组Nsp5蛋白可以稳定表达后,再次诱导100 mL重组菌液,离心去除上清后加入PBS重悬菌体,通过压力破碎仪破碎后,10 800×g 离心20 min,分别取上清和沉淀进行SDS-PAGE凝胶电泳分析,确定重组蛋白的表达形式。重组蛋白的纯化采用镍亲和层析方法,按照GE Healthcare公司的操作手册进行。
1.7 重组表达蛋白的Western blot鉴定 吸取含阳性重组质粒pET-28a-Nsp5或者空载体pET-28a(+)的大肠杆菌BL21(DE3)菌液接种于含卡那霉素的LB液体培养基中,加入IPTG诱导剂进行诱导,分别取未诱导和诱导5 h后的菌液进行破碎处理,吸取上清样品进行SDS-PAGE。电泳结束后转移到PVDF膜上,用10%脱脂乳摇床上室温封闭2 h,TBST洗涤3次;用1∶2000稀释的His标签鼠源单抗作为一抗摇床上室温孵育4 h,TBST洗涤3次;加入1∶5000稀释的辣根过氧化物酶(HRP)标记的羊抗鼠IgG二抗摇床上室温孵育2 h,TBST洗涤3次,用化学发光底物进行显色。
1.8 Nsp5蛋白酶切割活性检测 本研究中采用荧光共振能量转移的方法(FRET)检测蛋白酶活性。根据PDCoV Nsp4/Nsp5蛋白酶识别和剪切位点的特异性,在南京金斯瑞生物科技有限公司合成一个十二肽底物,从N端到C端依次为Dabcyl-LKTKLQ↓AGIKIL-E-Edan,Dabcyl(4-(4-Dimethylaminophenylazo)benzoyl,4'-(4'-二甲氨基氮苯)苯甲酸为淬灭基团连接在N 端的氨基酸残基L上,Edans(5-[(2-aminoethyl)amino] naphthalene-1-sulfonic acid,5'-(2'-氨基乙胺基萘)-1-磺酸)为荧光基团连接在 C 端氨基酸残基上。用340 nm 波长光激发,检测 485 nm 波长下荧光值的变化。该多肽完整时,荧光基团和淬灭基团之间的距离很小,荧光基团的能量被特异性淬灭。经蛋白酶在特异性位点识别剪切后多肽底物断裂,荧光基团和淬灭基团分离间距变大,荧光基团恢复自身荧光。每个实验组设置3个重复,在黑色96孔板中依次加入40 μL缓冲液(20 mmol HEPES, 50 mmol Nacl、0.4 mmol EDTA、30% glycerol、4 mmol DTT, pH 8.0),10 μL 终浓度50 nmol/μL 的Nsp5纯化蛋白,50 μL 终浓度50 μmol/mL 的荧光底物。37℃,每隔1 min测定1次340 nm激发光下的发射光(485 nm),进行23个循环,以不加Nsp5蛋白酶的样品为空白对照,将所得数据绘制酶反应曲线。
2 结果
2.1 Nsp5基因的PCR扩增 利用特异性引物扩增PDCoV CHN-HN-2014株 Nsp5基因,PCR产物经琼脂糖凝胶电泳,可观察到1条1.0 kb左右的特异性条带(图1),与预期大小(923 bp)相符。
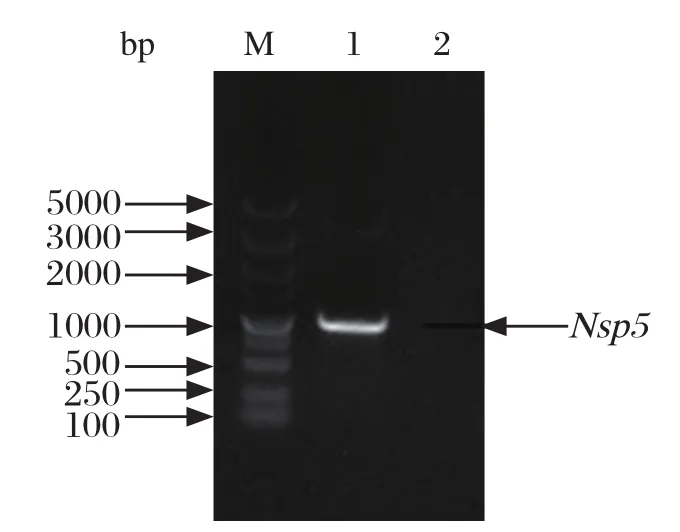
图1 PDCoV CHN-HN-2014株Nsp5基因的PCR扩增Fig. 1 Amplif cation of PDCoV CHN-HN-2014 Nsp5 gene by PCR
2.2 pET-28a-Nsp5重组质粒的构建 将PCR扩增产物纯化后用Nco I和Sal I双酶切,插入经同样酶切的pET-28a(+)载体,获得重组质粒pET-28a-Nsp5。重组质粒经Nco I和Sal I双酶切鉴定正确(图2),表明Nsp5基因已经成功插入pET-28a(+)中。进一步通过测序证实插入基因的位置、方向以及读码框均正确。

图2 pET-28a-Nsp5质粒的酶切鉴定Fig. 2 Identif cation of pET-28a-Nsp5 digested with restriction enzyme
2.3 重组Nsp5蛋白的诱导表达、可溶性分析及纯化将pET-28a-Nsp5转化BL21(DE3)后通过IPTG诱导表达,收集的样品经SDS-PAGE分析,发现重组质粒pET-28a-Nsp5经IPTG诱导后可稳定表达分子量大约为34 kDa的特异性蛋白,而空载体pET-28a(+)则没有出现相应的目的蛋白条带。蛋白表达量随着诱导时间延长逐渐增加,5 h后蛋白表达量基本不再增加(图3)。
为了进一步验证表达蛋白的特异性,将IPTG诱导5 h的细胞裂解液进行SDS-PAGE,转印PVDF膜,通过His标签抗体进行Western blot分析,发现重组Nsp5蛋白的泳道在34 kDa处有特异性反应条带,而空载体转化菌及未诱导的菌液在相应位置则没有反应条带(图4),表明Nsp5蛋白正确表达并且具有良好的反应活性。
将诱导后收集的菌体重悬后进行液压破碎,离心后分别收取上清和沉淀进行SDS-PAGE检测,发现重组Nsp5蛋白主要以可溶性蛋白进行表达(图5)。将收集的可溶性蛋白经Ni-NTA柱进行纯化,SDS-PAGE分析证实纯化的蛋白纯度在90% 以上(图5)。
2.4 Nsp5蛋白酶的酶反应曲线 将纯化的Nsp5蛋白与合成的底物混合后,置于多功能酶标仪中,将温度设置为37℃进行反应,每隔1 min测定体系的荧光强度,共测定23次。从测定的结果可以看出,体系中的荧光强度随着酶反应时间的进行而不断增加(图6),表明Nsp5存在着切割活性。
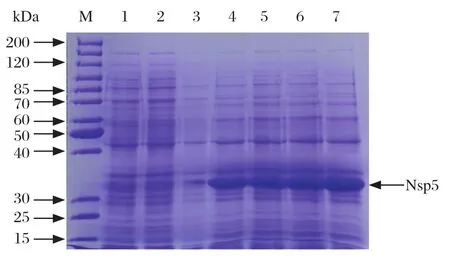
图3 重组质粒pET-28a-Nsp5的原核表达Fig. 3 Prokaryotic expression of the recombinant plasmid pET-28a-Nsp5
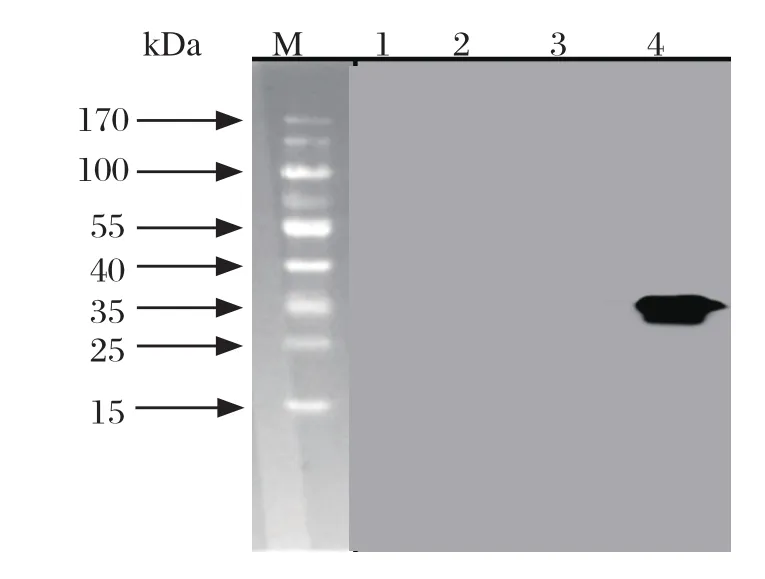
图4 重组Nsp5蛋白的Western blot检测Fig. 4 Identif cation of recombinant Nsp5 protein by Western blot

图5 重组Nsp5蛋白的可溶性分析及纯化Fig. 5 Solubility analysis and purif cation of the recombinant Nsp5 protein
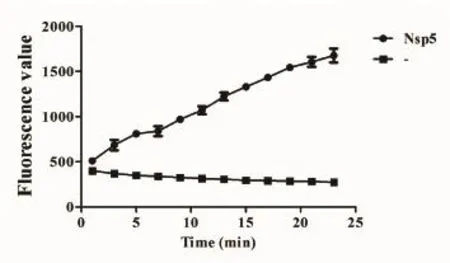
图6 Nsp5蛋白酶反应曲线Fig. 6 Reaction curve of Nsp5 protease
3 讨论
自2014年PDCoV在美国大规模爆发以来[3],对养猪业的危害逐渐引起人们的重视。同时,PDCoV是目前唯一成功被分离的δ冠状病毒,已成为研究δ冠状病毒致病与免疫机理的良好模型,对其进行深入研究具有重要的基础研究意义。
冠状病毒在基因组转录和翻译过程中,位于基因组5' 端的第一个开放阅读框架所编码的多聚蛋白pp1a和pp1b首先被翻译出来,随后被病毒编码的木瓜样蛋白酶与3C样蛋白酶切割加工成为成熟的非结构蛋白[9]。木瓜样蛋白酶由Nsp3编码,主要负责Nsp1~Nsp4(α、β冠状病毒)以及Nsp2~Nsp4(γ、δ冠状病毒)的切割,而3C样蛋白酶由Nsp5编码,负责对Nsp4~Nsp16进行切割,因此Nsp5也被称为冠状病毒的主蛋白酶[9]。冠状病毒3C样蛋白酶的切割位点非常保守,而且对底物识别具有很强的特异性。根据这一特性,我们预测了PDCoV 非结构蛋白的切割位点,并据此合成了含有PDCoV Nsp4/Nsp5切割位点的十二肽底物(LKTKLQ↓AGIKIL)。采用荧光共振能量转移方法证实体外表达纯化的PDCoV Nsp5具有切割活性,通过生物化学实验证实了预测的切割位点正确。
研究发现,在体外表达SARS-CoV Nsp5时,蛋白酶的两端是否带有标签以及标签的长度对其蛋白酶活性有非常重要的影响[12,13]。在本研究中,曾将6xHis标签置于Nsp5的N端,发现其蛋白酶活性不强,于是将6xHis标签置于Nsp5的C端,结果显示纯化的重组蛋白的蛋白酶活性显著增强,推测6xHis标签在N端时影响了PDCoV Nsp5的结构,从而降低了其蛋白酶活性。
作为冠状病毒的主蛋白酶,Nsp5不仅在病毒非结构蛋白加工方面发挥重要作用,而且还参与酶解宿主蛋白、RNA结合以及病毒复制等过程[14],因此一直被认为是开发抗冠状病毒药物的最好靶标。本研究通过基因工程方法获得了具有活性的PDCoV 3C样蛋白酶,为抗PDCoV抑制剂及3C蛋白酶检测方法的研发奠定了基础。另外,以前的研究发现SARSCoV的Nsp5具有拮抗干扰素产生的特性,但其作用机制不清楚。2015年本课题组研究证实猪流行性腹泻病毒(Porcine epidemic diarrhea virus, PEDV)Nsp5通过切割干扰素信号通路中的关键分子NEMO负调控干扰素产生[15]。目前关于PDCoV调控干扰素产生的信号通路还未见报道,但我们的初步研究证实PDCoV感染能够抑制双链RNA类似物poly(I∶C)诱导的干扰素产生(待发表)。PDCoV的Nsp5是否与PEDV的Nsp5一样通过切割免疫通路中的关键分子发挥免疫调节作用,值得进一步深入研究。
参考文献
[1] Chan J F, To K K, Tse H, et al. Interspecies transmission and emergence of novel viruses∶ lessons from bats and birds [J]. Trends Microbiol, 2013, 21(10)∶ 544-555.
[2] Woo P C, Lau S K, Lam C S, et al. Discovery of seven novel mammalian and avian coronaviruses in the genus deltacoronavirus supports bat coronaviruses as the gene source of alphacoronavirus and betacoronavirus and avian coronaviruses as the gene source of gammacoronavirus and deltacoronavirus [J]. J Virol, 2012, 86(7)∶ 3995-4008.
[3] Wang L, Byrum B, Zhang Y. Detection and genetic characterization of deltacoronavirus in pigs, Ohio, USA, 2014 [J]. Emerg Infect Dis, 2014, 20(7)∶ 1227-1230.
[4] Li G, Chen Q, Harmon K M, et al. Full-length genome sequence of porcine deltacoronavirus strain USA/ IA/2014/8734 [J]. Genome Announc, 2014, 2(2)∶ e00278-14.
[5] Dong N, Fang L R, Zeng S L, et al. Porcine deltacoronavi rus in mainland China [J]. Emerg Infect Dis, 2015, 21(12)∶ 2254-2255.
[6] Lee S H, Lee C H. Complete genome characterization of Korean porcine deltacoronavirus strain KOR/KNU14-04/2014 [J]. Genome Announc, 2014, 2(6)∶ e01191-14.
[7] Song D, Zhou X, Peng Q, et al. Newly emerged porcine deltacoronavirus associated with diarrhoea in swine in China∶ identification, prevalence and full-length genome sequence analysis [J]. Transbound Emerg Dis, 2015, 62(6)∶ 575-580.
[8] Janetanakit T, Lumyai M, Bunpapong N, et al. Porcine deltacoronavirus, Thailand, 2015 [J]. Emerg Infect Dis, 2016, 22(4)∶ 757-759.
[9] Sawicki S G, Sawicki D L, Younker D, et al. Functional and genetic analysis of coronavirus replicase-transcriptase proteins [J]. PLoS Pathog, 2005, 1(4)∶ e39.
[10] Totura A L, Baric R S. SARS coronavirus pathogenesis∶host innate immune responses and viral antagonism of interferon [J]. Curr Opin Virol, 2012, 2(3)∶ 264-275.
[11] Hilgenfeld R. From SARS to MERS∶ crystallographic studies on coronaviral proteases enable antiviral drug design [J]. FEBS J, 2014, 281(18)∶ 4085-4096.
[12] Xue X Y, Yang H T, Shen W, et al. Production of authentic SARS-CoV M(pro) with enhanced activity∶application as a novel tag-cleavage endopeptidase for protein overproduction [J]. J Mol Biol, 2007, 366(3)∶965-975.
[13] Grum-Tokars V, Ratia K, Begaye A, et al. Evaluating the 3C-like protease activity of SARS-Coronavirus∶recommendations for standardized assays for drug discovery [J]. Virus Res, 2008, 133(1)∶ 63-73.
[14] Perlman S, Netland J. Coronaviruses post-SARS∶ update on replication and pathogenesis [J]. Nat Rev Microbiol, 2009, 7(6)∶ 439-450.
[15] Wang D, Fang L R, Shi Y L, et al. Porcine Epidemic diarrhea virus 3C-Like protease regulates its interferon antagonism by cleaving NEMO [J]. J Virol, 2015, 90(4)∶2090-2101.
PROKARYOTIC EXPRESSION AND PROTEASE ACTIVITY OF PORCINE DELTACORONAVIRUS NSP5
ZHANG Huan1, XIAO Wen-jie2, ZENG Zhe1, ZHU Xin-yu1, DONG Nan1, PENG Gui-qing1
(1. College of Veterinary Medicine, Huazhong Agricultural University, Wuhan 430070, China; 2. No.1 Middle School Affiliated to Central China Normal University, Wuhan 430223, China)
Porcine deltacoronavirus (PDCoV) is a newly identif ed enteropathogenic coronavirus, causing diarrhea in suckling piglets. The nonstructural protein 5 (Nsp5) encoded by coronavirus is a 3C-like protease, and plays a key role in the process of viral polyproteins and immune regulation. In this study, the Nsp5 gene of PDCoV CHN-HN-2014 strain was amplified and subcloned into prokaryotic expression vector pET-28a(+), generating the recombinant expressing plasmid. After induction with IPTG, the fusion protein Nsp5-His was eff ciently expressed in E. coli BL21 (DE3) in soluble form. The recombinant protein was further purif ed with Ni-NTA aff nity column and its protease activity was detected by f uorescence resonance energy transfer (FRET) method. The results showed that the purif ed recombinant protein eff ciently cut the chemosynthetic 12 peptide that contained the N-terminal cleavage site of PDCoV Nsp5, indicating that Nsp5 possessed protease activity. The progress in cloning, expression and analysis of protease activity of Nsp5 will lay the foundation for the future functional research of PDCoV.
Porcine deltacoronavirus; Nsp5; protease activity
S852.659.6
A
1674-6422(2016)06-0006-6
2016-04-19
国家科技支撑计划(2015BAD12B02)
张欢,女,博士研究生,预防兽医学专业
彭贵青,E-mail∶ penggq@mail.hzau.edu.cn
